IQGAP1 - IQGAP1
Protein IQGAP1 aktivující Ras GTPázu (IQGAP1) také známý jako p195 je všudypřítomně vyjádřen protein že u lidí je kódován IQGAP1 gen.[5][6][7] IQGAP1 je protein lešení podílí se na regulaci různých buněčných procesů od organizace organizace aktin cytoskelet, přepis a buněčná adheze k regulaci buněčný cyklus.
Dějiny
IQGAP1 byl objeven v roce 1994.[5]Jeho název vychází ze skutečnosti, že jeho doména související s RasGAP (GRD) má sekvenční homologii s Sar1 GTPáza.[8] Předpokládalo se, že IQGAP1 bude fungovat jako Protein aktivující GTPázu (GAP) protein, který podporuje změnu ras GTPasy z aktivních GTP na formy vázané na HDP. Navzdory homologii GAP domény IQGAP k sar1 a skutečnosti, že IQGAP1 váže Rho GTPasy Rac1 a Cdc42, IQGAP ve skutečnosti funkci GAP nemá. Místo toho váže aktivní formy (vázané na GTP) RAC1 a CDC42 s vyšší afinitou než formy vázané na GDP a stabilizuje aktivní formu in vivo.[9]
IQGAP1 je nyní rozpoznán jako proteinové lešení, které integruje signály regulující buněčná adheze, aktin cytoskelet, buněčný cyklus,[9] a další buněčné funkce. IQGAP je obzvláště zajímavý jako terapeutický cíl, protože funguje jako uzel pro tolik signálních drah zapojených do rakovina postup.
Výraz
Analýza exprese IQGAP1 v lidských tkáních ukázala, že skelet je víceméně všudypřítomně exprimován.[10] Obvykle se nachází v jádro, plazmatická membrána, a cytoplazma. Jinými slovy se nachází v buňce i v různých typech tkání. Expresní analýza také ukázala, že IQGAP1 je nadměrně exprimován u mnoha rakovin a u agresivnějších kolorektálních a ovariálních karcinomů je IQGAP1 lokalizován na invazivní přední straně novotvaru, což naznačuje roli v mobilizaci buněk.[8] Důležité je, že přibližně 10% genů, které vykazují zvýšenou expresi v metastazující buňky jsou vazebnými partnery IQGAP1.[8]
Domény
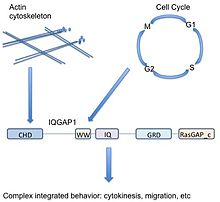
IQGAP1 je 190 kDa protein s 5 doménami.[9] A proteinová doména je podsekcí proteinu, který se v biologii objevuje několikrát a může existovat nezávisle na okolním proteinu. Je to velmi podobné podsekcím jiných proteinů a mohlo by být vyříznuto ze současného proteinu, existovat a fungovat samo o sobě, nebo být vloženo do nového řetězce proteinů a stále správně fungovat. Protože tato oblast proteinu je konzervována v aminokyselinové sekvenci a struktuře, lze ji charakterizovat funkcí nebo vazebným partnerem. IQGAP1 má 5 dobře známých domén oddělených jinými aminokyselinami.

Počínaje N-konec (nebo přední část proteinu), IQGAP1 obsahuje a doména homologie kalponinu (CHD), který zprostředkovává vazbu aktinu[11] a váže kalponin.
WW, nebo doména poly-prolin protein-protein, tak pojmenovaný kvůli dvěma funkčně konzervovaným tryptofanům, W, je doména interakce protein-protein, která se asociuje s oblastmi jiných proteinů bohatými na prolin.[12][13]
The WW doména následuje 4 IQ motivy které tvoří IQ doménu. Tato doména se váže klimodulin,[14] protein známý jako senzor vápníku, který může vázat a regulovat mnoho cílových proteinů.[15]
GRD (doména související s rasGAP) sleduje doménu IQ. Tato doména je velmi podobná funkční podjednotce Ras Proteiny aktivující GTPázu (GAPs), a proto se předpokládalo, že má funkci GAP. IQGAP1 se váže Rho GTPasy CDC42 a RAC1 IQGAP1 je však neobvyklý v tom, že ve skutečnosti nemá žádnou GAP funkci a místo toho stabilizuje proteiny vázané na GTP v jejich aktivním stavu.[16]
Nakonec má IQGAP1 karboxylovou koncovou sekvenci RasGAP_c důležitou pro vazbu Beta-katenin a E-kadherin.[9]
Související bílkoviny
Homologové IQGAP1 jsou u druhů známé jako divergentní jako kvasinky, červi a lidé (stejně jako u jiných savců), i když domény nejsou vždy vysoce konzervované.[9]
IQGAP1 je nejvíce studovaným členem rodiny IQGAP proteinů lešení. Mezi další dva členy rodiny patří IQGAP2 a IQGAP3 které mají mnohem omezenější výrazové vzorce ve srovnání s IQGAP1. IQGAP2 se nachází v játrech, žaludku a krevních destičkách a je 62% identický s IQGAP1,[9] ale zdá se, že má z hlediska patologie drasticky odlišnou funkci.[17]
Zdá se, že v mozku hraje IQGAP3 důležitou roli v neuronální morfogenezi.[18]
Funkce
Tento gen kóduje člena IQGAP rodina. Protein obsahuje čtyři IQ domény, jeden doména homologie kalponinu, jeden Ras-GAP doména a jeden WW doména. Interaguje s komponentami cytoskelet[19] jako je formin Dia1 (mDia1 ),[20] s molekulami buněčné adheze (CAM ) a s několika signálními molekulami k regulaci buňky morfologie a pohyblivost. Například exprese IQGAP1 je nezbytná pro růst neuronových procesů na molekule PTPmu buněčné adheze (PTPRM ).[21] Exprese proteinu je upregulována genovou amplifikací ve dvou rakovina žaludku buněčné linie[7] a jeho nadměrná exprese a odlišná lokalizace membrány je také pozorována u řady nádorů.[22]
Interakce
IQGAP1 je uzel protínaný mnoha signálními cestami. Jako takový má mnoho vazebných partnerů, z nichž mnozí mají zásadní roli v řízení buněčného cyklu a aktinového cytoskeletu.
Ukázalo se, že IQGAP1 komunikovat s:
- Kalmodulin 1,[23][24]
- CDC42,[6][25][26][27][28]
- CDH1,[29]
- CLIP1,[26]
- PRKACA,[30]
- RAC1,[6][25][26][28] a
- S100B.[31]
- Actin - cytoskeletální struktura
- ARF6
- APC
- Beta-katenin –Adheze buněk a signalizace WNT: transkripce
- B-raf - Cesta MAPK
- CD44
- Erk1 / 2 - MAPK dráha, kontrola buněčného cyklu, proliferace
- Mek ½ - MAPK dráha, kontrola buněčného cyklu, proliferace
- Src
- PTPmu (PTPRM )[21]
- kompletní seznam na [32]
Funguje jako lešení
Vazba na bílkoviny sama o sobě nevytváří zajímavý příběh. Mnohem důležitější je výsledek závazné události. Mění vázání lokalizaci cílového proteinu? Aktivuje cíl nebo nějakým způsobem mění konformaci cíle (nebo efektorové molekuly)? Jako lešení protein, IQGAP1 váže a reguluje mnoho cílů - jeho rolí je integrovat a zprostředkovat signalizaci z různých cest a izolovat klíčové členy cesty od přeslech.
Lešení se organizují signální dráhy —Pomoc regulovat, jak mohou být různé extracelulární signály přenášeny stejnými členy kanonické cesty do různých buněčných výstupů.[33] Obecně platí, že lešení regulují výstup, lokalizaci a selektivitu cest.[34]
Jako lešení zapojené do různých signálních drah (aktin cytoskelet, buněčná adheze, buněčný cyklus, transkripce), IQGAP1 má jedinečnou schopnost potenciálně spojovat různé buněčné funkce. Například IQGAP1 je spojen s dynamikou aktinů prostřednictvím přímé vazby aktinu a nepřímé regulace prostřednictvím Cdc42 / Rac1, ale také moduluje Cesta MAPK který je spojen s řízením buněčného cyklu. IQGAP1 tedy může spojovat signalizaci MAPK (rozhodnutí o osud buňky ) na cytoskelet nebo buněčnou adhezi (potenciálně ovlivňující tato rozhodnutí) - důležitý důsledek pro rakovinu.
Pro zjednodušení může IQGAP1 kvůli své rozmanité škále vazebných partnerů působit jako spojení mezi logicky souvisejícími, ale molekulárně odlišnými buněčnými funkcemi. Ve výše uvedeném příkladu je vyžadováno přeskupení aktinového cytoskeletu proliferace (cytokineze v době mitóza ). IQGAP1 pomáhá buňkám jak naslouchat signálům, tak na ně reagovat, přičemž hraje nedílnou roli ve spojování bodů mezi signály pro proliferaci a skutečnou buněčnou odezvou.
Klíčové cesty
ERK MAPK
The Ras →Raf →MEK →ERK Signální dráha MAPK hraje nedílnou součást procesů proliferace buněk, diferenciace, a apoptóza. Tato cesta je zachována napříč všemi eukaryoty.
Různé extracelulární signály indukují dráhu ERK MAPK včetně EGF, IGF-1, PDGF, a NGF.[33] Různá lešení této dráhy, včetně IQGAP1, jsou zodpovědná za modulaci buněčné odpovědi na aktivitu této dráhy. Například v dané buněčné linii může aktivace jedním extracelulárním signálem vyvolat diferenciaci, ale ne proliferaci, zatímco aktivace stejné dráhy ERK MAPK jiným extracelulárním signálem indukuje proliferaci, ale nikoli diferenciaci.[33] Zdá se, že IQGAP1 je zodpovědný za specifický výstup dráhy po aktivaci EGF.
IQGAP1 hraje významnou roli v šíření této signalizační dráhy MAPK. IQGAP se přímo váže b-RAF,[35] MEK1 / 2 a ERK1 / 2 a je ve skutečnosti nezbytný pro fosforylaci (aktivaci) ERK po stimulaci EGF.[36][37]
Cytoskeletální kontrola (dynamika aktinů)
Actin je hlavním stavebním kamenem cytoskeletu každé eukaryotické buňky. Dynamika aktinu hraje v pohyblivost buněk (vlákna jsou vytvořena na náběžné hraně pohyblivé buňky a dekonstruována na ústupové hraně). IQGAP1 váže aktin a ovlivňuje dynamiku aktinů lokalizací na přední hranu a náborem polymerace aktinu stroje.[8][9][19]
IQGAP1 se váže a je terčem Rho GTPáz CDC42 a RAC1 což jsou dobře známé regulátory aktinového cytoskeletu.[38][39] I přes svůj název IQGAP1 nemá funkci GAP a místo toho stabilizuje aktivní Cdc42. Toto zvýšení v místním fondu aktivních Cdc42 stimuluje aktin tvorba vlákna a tedy filopodia formace.[9]
IQGAP1 může zesíťovat aktin,[40] a v mnoha organismech je IQGAP1 zapojen do cytokineze.[41]
Přilnavost
Kadheriny jsou rodinou adhezivních proteinů, které se lokalizují na buněčný povrch, kde ukotví buňku k sousedům tím, že se sevře na extracelulární část sousedních kadherinů. Actin váže a-catenin který váže beta-katenin což zase váže E-kadherin. E-kadherin vyčnívá do extracelulárního prostoru, aby uchopil extracelulární domény sousedních E-kadherinů. IQGAP1 se lokalizuje na kontakty mezi buňkami a váže aktin, b-katenin a E-kadherin, což oslabuje tyto spoje a tím snižuje adhezi mezi buňkami.[9][42] IQGAP oslabuje adhezi buněk vytlačením a-kateninu z komplexu.[43]
Aktivní RAC1 váže IQGAP1 na zesíťující aktinová vlákna a brání IQGAP1 v interakci s beta-katenin stabilizující kontakty buňka-buňka.[44] Když však IQGAP1 neváže Rac1, váže beta-katenin a vytěsňuje a-katenin z buněčného adhezního komplexu kadherin-katenin.
Transkripce
IQGAP1 také ovlivňuje transkripci přes Wnt signální cesta jeho interakcí s beta-katenin.[8] Beta-katenin je obvykle izolován v komplexu a vyloučen z jádra, ale při aktivaci WNT je tento komplex rozbit a beta-katenin se translokuje do jádra, kde aktivuje transkripční programy. IQGAP1 váže b-katenin a zvyšuje nukleární lokalizaci a expresi transkripčních cílů beta-kateninu.
Klinický význam
IQGAP1 je spojen s cytoskeletální dynamika, přepis, buněčná adheze, buněčný cyklus, a morfologie, z nichž všechny jsou narušeny v rakovina. Jako modulační protein protínající všechny tyto dráhy může IQGAP1 spojit mnoho z nich a je také zodpovědný za jejich správné šíření. Protože rakovina je onemocnění charakterizované narušením mnoha těchto buněčných procesů, je IQGAP1 logický onkogen kandidát a terapeutický cíl.
Analýza výrazů zahrnovala IQGAP1 v kolorektální, dlaždicová buňka, prsa, žaludeční, játra, plíce, a ovariální rakoviny,[45] a u některých z těchto druhů rakoviny vyšší hladiny exprese IQGAP1 naznačují špatnou prognózu.[46]
Aby rakovina mohla metastázovat, buňky musí získat migrační schopnosti a napadnout jiné tkáně. Prostřednictvím Rac1 / CDC42 reguluje IQGAP1 buněčnou adhezi a dynamiku aktinů.
V normálních buňkách se IQGAP1 lokalizuje do oblastí s vysokým obratem aktinu. Tato charakteristika se odráží v invazivních tkáních, kde se IQGAP1 lokalizuje na přední hranu migrujících buněk.[8] Nadměrná exprese IQGAP1 byla spojena se zvýšenou migrací a invazí do buněčné linie lidského epiteliálního karcinomu prsu (MCF-7 buňky).[8][47] IQGAP1 může být také zapojen do deregulace proliferace a diferenciace prostřednictvím své modulace Cesta ERK MAPK.
IQGAP1 může být nezbytný pro tumorigeneze. Vyřazení IQGAP1 v rakovinných buňkách MCF-7 snížilo zhoubný fenotyp (proliferace závislá na séru a růst nezávislý na ukotvení). U 100% myší injikovaných buňkami MCF-7 s nadměrnou expresí IQGAP1 se vyvinuly nádory a tyto nádory byly vysoce invazivní. Kontrolní buňky MCF-7 tvořily nádory u 60% myší a buňky MCF-7 se stabilním potlačením IQGAP1 tvořily nádory pouze 20% času.[47] Mechanismus, jak může IQGAP1 modulovat tumorigenezi / invazi prostřednictvím svých různých vazebných partnerů, je velmi zajímavý.
Myši s nulovou hodnotou IQGAP1 se zdají být významně normální, přičemž jedinou abnormalitou v anamnéze života je zvýšení žaludku hyperplazie.[48] IQGAP1 tedy může být účinným terapeutickým cílem, pokud má jeho příklep malý účinek na homeostatický tkáň, ale její exprese je u rakoviny důležitá.
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000140575 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000030536 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ A b Weissbach L, Settleman J, Kalady MF, Snijders AJ, Murthy AE, Yan YX, Bernards A (září 1994). "Identifikace lidského proteinu souvisejícího s rasGAP obsahující motivy vázající kalmodulin". J. Biol. Chem. 269 (32): 20517–21. PMID 8051149.
- ^ A b C Hart MJ, Callow MG, Souza B, Polakis P (srpen 1996). „IQGAP1, protein vázající kalmodulin s doménou související s rasGAP, je potenciálním efektorem pro cdc42Hs“. EMBO J.. 15 (12): 2997–3005. doi:10.1002 / j.1460-2075.1996.tb00663.x. PMC 450241. PMID 8670801.
- ^ A b „Entrez Gene: IQGAP1 IQ motiv obsahující protein aktivující GTPázu 1“.
- ^ A b C d E F G White CD, Brown MD, Sacks DB (červen 2009). „IQGAP v rakovině: rodina proteinů lešení podstupujících tumorigenezi“. FEBS Lett. 583 (12): 1817–24. doi:10.1016 / j.febslet.2009.05.007. PMC 2743239. PMID 19433088.
- ^ A b C d E F G h i Briggs MW, Pytle DB (červen 2003). „Proteiny IQGAP jsou nedílnou součástí cytoskeletální regulace“. EMBO Rep. 4 (6): 571–4. doi:10.1038 / sj.embor.embor867. PMC 1319206. PMID 12776176.
- ^ "IQGAP1: Souhrn genů a bílkovin". Atlas lidského proteinu. Citováno 2011-05-31.
- ^ Stradal T, Kranewitter W, Winder SJ, Gimona M (červenec 1998). "CH domény znovu navštíveny". FEBS Lett. 431 (2): 134–7. doi:10.1016 / S0014-5793 (98) 00751-0. PMID 9708889.
- ^ Sudol M, Chen HI, Bougeret C, Einbond A, Bork P (srpen 1995). "Charakterizace nového modulu vázajícího protein - doména WW". FEBS Lett. 369 (1): 67–71. doi:10.1016 / 0014-5793 (95) 00550-S. PMID 7641887.
- ^ Macias MJ, Wiesner S, Sudol M (únor 2002). "Domény WW a SH3, dvě různá lešení pro rozpoznávání liginů bohatých na prolin". FEBS Lett. 513 (1): 30–7. doi:10.1016 / S0014-5793 (01) 03290-2. PMID 11911877.
- ^ Rhoads AR, Friedberg F (duben 1997). „Sekvenční motivy pro rozpoznávání kalmodulinu“. FASEB J.. 11 (5): 331–40. doi:10.1096 / fasebj.11.5.9141499. PMID 9141499.
- ^ Stevens FC (srpen 1983). "Calmodulin: úvod". Umět. J. Biochem. Cell Biol. 61 (8): 906–10. doi:10.1139 / o83-115. PMID 6313166.
- ^ Kurella VB, Richard JM, Parke CL, Lecour LF, Bellamy HD, Worthylake DK (květen 2009). „Krystalová struktura domény související s proteinem aktivující GTPázu z IQGAP1“. J. Biol. Chem. 284 (22): 14857–65. doi:10,1074 / jbc.M808974200. PMC 2685667. PMID 19321438.
- ^ White CD, Khurana H, Gnatenko DV, Li Z, Odze RD, Sacks DB, Schmidt VA (2010). „IQGAP1 a IQGAP2 se v hepatocelulárním karcinomu recipročně mění“. BMC Gastroenterol. 10: 125. doi:10.1186 / 1471-230X-10-125. PMC 2988069. PMID 20977743.
- ^ Wang S, Watanabe T, Noritake J, Fukata M, Yoshimura T, Itoh N, Harada T, Nakagawa M, Matsuura Y, Arimura N, Kaibuchi K (únor 2007). „IQGAP3, nový efektor Rac1 a Cdc42, reguluje růst neuritů“. J. Cell Sci. 120 (Pt 4): 567–77. doi:10.1242 / jcs.03356. PMID 17244649.
- ^ A b Brandt DT, Grosse R (listopad 2007). „Pochopte: řízení lokální dynamiky aktinů pomocí IQGAP“. EMBO Rep. 8 (11): 1019–23. doi:10.1038 / sj.embor.7401089. PMC 2247391. PMID 17972901.
- ^ Brandt DT, Marion S, Griffiths G, Watanabe T, Kaibuchi K, Grosse R (červenec 2007). „Dia1 a IQGAP1 interagují při migraci buněk a tvorbě fagocytárního kalíšku“. J. Cell Biol. 178 (2): 193–200. doi:10.1083 / jcb.200612071. PMC 2064439. PMID 17620407.
- ^ A b Phillips-Mason PJ, Gates TJ, Major DL, Sacks DB, Brady-Kalnay SM (2006). „Receptorový protein-tyrosin fosfatáza PTPmu interaguje s IQGAP1“. The Journal of Biological Chemistry. 281 (8): 4903–10. doi:10,1074 / jbc.M506414200. PMID 16380380.
- ^ Johnson M, Sharma M, Henderson BR (březen 2009). "Regulace IQGAP1 a role v rakovině". Buňka. Signál. 21 (10): 1471–8. doi:10.1016 / j.cellsig.2009.02.023. PMID 19269319.
- ^ Li Z, Sacks DB (únor 2003). „Objasnění interakce kalmodulinu s IQ motivy IQGAP1“. J. Biol. Chem. 278 (6): 4347–52. doi:10,1074 / jbc.M208579200. PMID 12446675.
- ^ Briggs MW, Li Z, Sacks DB (březen 2002). „Stimulace transkripční koaktivace beta-kateninem zprostředkovaná IQGAP1 je modulována kalmodulinem“. J. Biol. Chem. 277 (9): 7453–65. doi:10,1074 / jbc.M104315200. PMID 11734550.
- ^ A b Kuroda S, Fukata M, Kobayashi K, Nakafuku M, Nomura N, Iwamatsu A, Kaibuchi K (září 1996). „Identifikace IQGAP jako domnělého cíle pro malé GTPasy, Cdc42 a Rac1“. J. Biol. Chem. 271 (38): 23363–7. doi:10.1074 / jbc.271.38.23363. PMID 8798539.
- ^ A b C Fukata M, Watanabe T, Noritake J, Nakagawa M, Yamaga M, Kuroda S, Matsuura Y, Iwamatsu A, Perez F, Kaibuchi K (červen 2002). "Rac1 a Cdc42 zachycují mikrotubuly prostřednictvím IQGAP1 a CLIP-170". Buňka. 109 (7): 873–85. doi:10.1016 / S0092-8674 (02) 00800-0. PMID 12110184.
- ^ Joyal JL, Annan RS, Ho YD, Huddleston ME, Carr SA, Hart MJ, Sacks DB (červen 1997). "Kalmodulin moduluje interakci mezi IQGAP1 a Cdc42. Identifikace IQGAP1 pomocí nanoelektrosprayové tandemové hmotnostní spektrometrie". J. Biol. Chem. 272 (24): 15419–25. doi:10.1074 / jbc.272.24.15419. PMID 9182573.
- ^ A b Zhang B, Chernoff J, Zheng Y (duben 1998). "Interakce Rac1 s proteiny aktivujícími GTPázu a domnělými efektory. Srovnání s Cdc42 a RhoA". J. Biol. Chem. 273 (15): 8776–82. doi:10.1074 / jbc.273.15.8776. PMID 9535855.
- ^ Li Z, Kim SH, Higgins JM, Brenner MB, Sacks DB (prosinec 1999). „IQGAP1 a kalmodulin modulují funkci E-kadherinu“. J. Biol. Chem. 274 (53): 37885–92. doi:10.1074 / jbc.274.53.37885. PMID 10608854.
- ^ Nauert JB, Rigas JD, Lester LB (září 2003). "Identifikace komplexu IQGAP1 / AKAP79 v beta-buňkách". J. Cell. Biochem. 90 (1): 97–108. doi:10.1002 / jcb.10604. PMID 12938160.
- ^ Mbele GO, Deloulme JC, Gentil BJ, Delphin C, Ferro M, Garin J, Takahashi M, Baudier J (prosinec 2002). „S100B vázající zinek a vápník interaguje a kolokalizuje s IQGAP1 během dynamického přeskupení buněčných membrán“. J. Biol. Chem. 277 (51): 49998–50007. doi:10,1074 / jbc.M205363200. PMID 12377780.
- ^ https://www.ncbi.nlm.nih.gov/gene/8826[úplná citace nutná ]
- ^ A b C Pytle DB (listopad 2006). „Role proteinů lešení v signalizaci MEK / ERK“. Biochem. Soc. Trans. 34 (Pt 5): 833–836. doi:10.1042 / BST0340833. PMID 17052209.
- ^ Dobrý MC, Zalatan JG, Lim WA (květen 2011). „Lešení proteiny: rozbočovače pro řízení toku buněčné informace“. Věda. 332 (6030): 680–6. Bibcode:2011Sci ... 332..680G. doi:10.1126 / science.1198701. PMC 3117218. PMID 21551057.
- ^ Ren JG, Li Z, Sacks DB (červen 2007). „IQGAP1 moduluje aktivaci B-Raf“. Proc. Natl. Acad. Sci. USA. 104 (25): 10465–9. Bibcode:2007PNAS..10410465R. doi:10.1073 / pnas.0611308104. PMC 1965536. PMID 17563371.
- ^ Roy M, Li Z, Sacks DB (duben 2004). „IQGAP1 váže ERK2 a moduluje jeho aktivitu“. J. Biol. Chem. 279 (17): 17329–37. doi:10,1074 / jbc.M308405200. PMID 14970219.
- ^ Roy M, Li Z, Sacks DB (září 2005). „IQGAP1 je skelet pro signalizaci proteinkinázy aktivovanou mitogenem“. Mol. Buňka. Biol. 25 (18): 7940–52. doi:10.1128 / MCB.25.18.7940-7952.2005. PMC 1234344. PMID 16135787.
- ^ Hala A (květen 1992). „Ras-související GTPasy a cytoskeleton“. Mol. Biol. Buňka. 3 (5): 475–9. doi:10,1091 / mbc. 3,5.475. PMC 275601. PMID 1611153.
- ^ Narumiya S (srpen 1996). "Malá GTPáza Rho: buněčné funkce a přenos signálu". J. Biochem. 120 (2): 215–28. doi:10.1093 / oxfordjournals.jbchem.a021401. PMID 8889802.
- ^ Fukata M, Kuroda S, Fujii K, Nakamura T, Shoji I, Matsuura Y, Okawa K, Iwamatsu A, Kikuchi A, Kaibuchi K (listopad 1997). "Regulace zesíťování aktinového vlákna pomocí IQGAP1, cíl pro Cdc42". J. Biol. Chem. 272 (47): 29579–83. doi:10.1074 / jbc.272.47.29579. PMID 9368021.
- ^ Machesky LM (březen 1998). "Cytokinesis: IQGAPs find a function". Curr. Biol. 8 (6): R202–5. doi:10.1016 / S0960-9822 (98) 70125-3. PMID 9512410.
- ^ Kuroda S, Fukata M, Nakagawa M, Fujii K, Nakamura T, Ookubo T, Izawa I, Nagase T, Nomura N, Tani H, Shoji I, Matsuura Y, Yonehara S, Kaibuchi K (srpen 1998). „Role IQGAP1, cíle malých GTPáz Cdc42 a Rac1, při regulaci adheze buněk k buňkám zprostředkovanou E-kadherinem“. Věda. 281 (5378): 832–5. Bibcode:1998Sci ... 281..832K. doi:10.1126 / science.281.5378.832. PMID 9694656.
- ^ Fukata M, Kuroda S, Nakagawa M, Kawajiri A, Itoh N, Shoji I, Matsuura Y, Yonehara S, Fujisawa H, Kikuchi A, Kaibuchi K (září 1999). „Cdc42 a Rac1 regulují interakci IQGAP1 s beta-kateninem“. J. Biol. Chem. 274 (37): 26044–50. doi:10.1074 / jbc.274.37.26044. PMID 10473551.
- ^ Noritake J, Watanabe T, Sato K, Wang S, Kaibuchi K (květen 2005). „IQGAP1: klíčový regulátor adheze a migrace“. J. Cell Sci. 118 (Pt 10): 2085–92. doi:10.1242 / jcs.02379. PMID 15890984.
- ^ Atlas lidských bílkovin: http://www.proteinatlas.org/ENSG00000140575
- ^ McDonald KL, O'Sullivan MG, Parkinson JF, Shaw JM, Payne CA, Brewer JM, Young L, Reader DJ, Wheeler HT, Cook RJ, Biggs MT, Little NS, Teo C, Stone G, Robinson BG (květen 2007) . „IQGAP1 a IGFBP2: cenné biomarkery pro stanovení prognózy u pacientů s gliomem“. J. Neuropathol. Exp. Neurol. 66 (5): 405–17. doi:10.1097 / nen.0b013e31804567d7. PMID 17483698.
- ^ A b Jadeski L, Mataraza JM, Jeong HW, Li Z, Sacks DB (leden 2008). „IQGAP1 stimuluje proliferaci a zvyšuje tumorigenezi lidských epiteliálních buněk prsu“. J. Biol. Chem. 283 (2): 1008–17. doi:10,1074 / jbc.M708466200. PMID 17981797.
- ^ Li S, Wang Q, Chakladar A, Bronson RT, Bernards A (leden 2000). „Žaludeční hyperplazie u myší postrádajících domnělý efektor Cdc42 IQGAP1“. Mol. Buňka. Biol. 20 (2): 697–701. doi:10,1128 / mcb.20.2.697-701.2000. PMC 85173. PMID 10611248.
Další čtení
- Tirnauer JS (2004). „Nové cytoskeletální spojení pro APC: spojené s aktinem prostřednictvím IQGAP“. Dev. Buňka. 7 (6): 778–80. doi:10.1016 / j.devcel.2004.11.012. PMID 15572120.
- McCallum SJ, Wu WJ, Cerione RA (1996). „Identifikace domnělého efektoru pro Cdc42Hs s vysokou sekvenční podobností s proteinem IQGAP1 souvisejícím s RasGAP a vazebným partnerem Cdc42Hs s podobností s IQGAP2“. J. Biol. Chem. 271 (36): 21732–7. doi:10.1074 / jbc.271.36.21732. PMID 8702968.
- Bashour AM, Fullerton AT, Hart MJ, Bloom GS (1997). „IQGAP1, protein vázající Rac a Cdc42, přímo váže a zesíťuje mikrofilamenta“. J. Cell Biol. 137 (7): 1555–66. doi:10.1083 / jcb.137.7.1555. PMC 2137827. PMID 9199170.
- McCallum SJ, Erickson JW, Cerione RA (1998). „Charakterizace asociace proteinu vázajícího aktin, IQGAP a aktivovaného Cdc42 s Golgiho membránami“. J. Biol. Chem. 273 (35): 22537–44. doi:10.1074 / jbc.273.35.22537. PMID 9712880.
- Sugimoto N, Imoto I, Fukuda Y, Kurihara N, Kuroda S, Tanigami A, Kaibuchi K, Kamiyama R, Inazawa J (2001). „IQGAP1, negativní regulátor adheze mezi buňkami, je upregulován genovou amplifikací v 15q26 v buněčných liniích rakoviny žaludku HSC39 a 40A“. J. Hum. Genet. 46 (1): 21–5. doi:10,1007 / s100380170119. PMID 11289714.
- Nabeshima K, Shimao Y, Inoue T, Koono M (2002). „Imunohistochemická analýza exprese IQGAP1 v lidských kolorektálních karcinomech: její nadměrná exprese v karcinomech a souvislost s frontami invaze“. Cancer Lett. 176 (1): 101–9. doi:10.1016 / S0304-3835 (01) 00742-X. PMID 11790459.
- Mateer SC, McDaniel AE, Nicolas V, Habermacher GM, Lin MJ, Cromer DA, King ME, Bloom GS (2002). „Mechanismus regulace vazebné aktivity F-aktinu IQGAP1 vápníkem / kalmodulinem“. J. Biol. Chem. 277 (14): 12324–33. doi:10,1074 / jbc.M109535200. PMID 11809768.
- Swart-Mataraza JM, Li Z, Sacks DB (2002). „IQGAP1 je součástí signalizace Cdc42 do cytoskeletu“. J. Biol. Chem. 277 (27): 24753–63. doi:10,1074 / jbc.M111165200. PMID 11948177.
- Brandt DT, Marion S, Griffiths G, Watanabe T, Kaibuchi K, Grosse R (červenec 2007). „Dia1 a IQGAP1 interagují při migraci buněk a tvorbě fagocytárního kalíšku“. J. Cell Biol. 178 (2): 193–200. doi:10.1083 / jcb.200612071. PMC 2064439. PMID 17620407.









