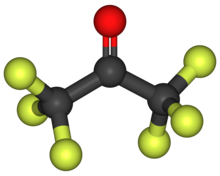
Hexafluoroaceton - Hexafluoroacetone
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC 1,1,1,3,3,3-hexafluor- | |
| Ostatní jména perfluoraceton aceton hexafluorid perfluor-2-propanon | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChemSpider | |
| Informační karta ECHA | 100.010.616 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
| UN číslo | 2420 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C3F6Ó | |
| Molární hmotnost | 166,02 g / mol |
| Vzhled | Bezbarvý plyn |
| Zápach | zatuchlý[1] |
| Hustota | 1,32 g / ml, kapalina |
| Bod tání | -129 ° C (144 K) |
| Bod varu | -28 ° C (245 K) |
| Reaguje s vodou | |
| Tlak páry | 5,8 atm (20 ° C)[1] |
| Nebezpečí | |
| Hlavní nebezpečí | Toxický (T), Žíravý (C) |
| Piktogramy GHS |      |
| Signální slovo GHS | Nebezpečí |
| H280, H301, H310, H311, H314, H315, H318, H330, H360, H370, H372 | |
| P201, P202, P260, P262, P264, P270, P271, P280, P281, P284, P301 + 310, P301 + 330 + 331, P302 + 350, P302 + 352, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P307 + 311, P308 + 313, P310, P312, P314, P320, P321, P322 | |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | Nehořlavé[1] |
| NIOSH (Limity expozice USA pro zdraví): | |
PEL (Dovolený) | žádný[1] |
REL (Doporučeno) | PEL 0,1 ppm (0,7 mg / m3) [kůže][1] |
IDLH (Okamžité nebezpečí) | N.D.[1] |
| Související sloučeniny | |
Příbuzný ketony; organofluoridy | Aceton; Hexafluoro-2-propanol |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Hexafluoroaceton (HFA) je a chemická sloučenina s vzorec (CF3)2CO. Je strukturálně podobný aceton; jeho reaktivita je však výrazně odlišná. Je to bezbarvý, hygroskopický, nehořlavý, vysoce reaktivní plyn charakterizovaný zatuchlým zápachem.[2] Nejběžnější formou této látky je hexafluoraceton seskvihydrát (1.5 H2Ó), což je hemihydrát z hexafluorpropan-2,2-diol (F
3C)
2C (OH)
2, a geminální diol .
Syntéza
Průmyslová cesta k HFA zahrnuje zpracování hexachloraceton s HF:[3]
- (CCl3)2CO + 6 HF → (CF3)2CO + 6 HCl
Hexafluorpropylenoxid přeskupí, aby dal HFA.
V laboratoři lze HFA připravit ve dvou krocích z perfluorpropenu. V prvním kroku KF katalyzuje reakci alkenu s elementární sírou za vzniku 1,3-dithietanu [(CF3)2CS]2. Tento druh je poté oxidován jodičnanem za vzniku (CF3)2CO.[4]
Použití
Hexafluoroaceton se používá při výrobě hexafluoroisopropanol:
- (CF3)2CO + H2 → (CF3)2CHOH
Používá se také jako předchůdce hexafluorisobutylen,[3] monomer používaný v polymerní chemii a jako stavebním kamenem při syntéze midaflur, bisfenol AF, 4,4 '- (hexafluorisopropyliden) anhydrid kyseliny diftalové, a alitame.
Reaktivita
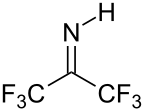
Hexafluoroaceton je elektrofil. Nukleofily zaútočit na karbonyl uhlík. Ve vodě hexafluoraceton existuje převážně jako hydrát. The rovnovážná konstanta (K.ekv) pro vznik tohoto geminální diol je 106 M−1. Analogická rovnováha pro aceton je nepříznivá 10−3 M−1.[5] Hydráty hexafluoracetonu jsou kyselé. Při analogické reakci amoniak přidává k hexafluoracetonu za vzniku hemiaminal (CF3)2C (OH) (NH2), které lze dehydratovat fosforylchlorid dát já těžím (CF3)2CNH.[6]
Viz také
Reference
- ^ A b C d E F NIOSH Kapesní průvodce chemickými nebezpečími. "#0319". Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH).
- ^ Kapesní průvodce chemickými riziky CDC - NIOSH
- ^ A b Günter Siegemund; Werner Schwertfeger; Andrew Feiring; Bruce Smart; Fred Behr; Herward Vogel; Blaine McKusick (2002). "Sloučeniny fluoru, organické". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a11_349.
- ^ Van Der Puy, M .; Anello, L. G. (1990). „Hexafluoraceton“. Organické syntézy.; Kolektivní objem, 7, str. 251
- ^ Lemal, David M. (2004). "Perspektiva na fluorouhlíkové chemii". The Journal of Organic Chemistry. 69 (1): 1–11. doi:10.1021 / jo0302556. PMID 14703372.
- ^ W. J. Middleton; H. D. Carlson (1970). "Hexafluoroaceton imin". Org. Syntézy. 50: 81–3. doi:10.15227 / orgsyn.050.0081..

