Biologické aspekty fluoru - Biological aspects of fluorine
Fluor mohou interagovat s biologickými systémy ve formě sloučenin obsahujících fluor. Ačkoli elementární fluor (F2) je v každodenním životě velmi vzácný, stovky sloučenin obsahujících fluor se přirozeně vyskytují jako minerály, léky, pesticidy a materiály. Přirozeně se vyskytující organofluor sloučeniny jsou extrémně vzácné, přesto jsou běžné fluoridové sloučeniny běžné: například dvacet procent všech komerčně dostupných léčiv obsahuje fluor, včetně Lipitor a Prozac.[1][2] V mnoha kontextech jsou sloučeniny obsahující fluor neškodné nebo dokonce prospěšné pro živé organismy; v jiných jsou toxický.
Kromě jejich použití v medicíně hrály umělé fluorované sloučeniny také roli v několika pozoruhodných ohledech na životní prostředí. Chlorfluoruhlovodíky (CFC), kdysi hlavní složky mnoha komerčních aerosolových produktů, se ukázaly jako škodlivé pro Zemi ozónová vrstva a vyústil v široký dosah Montrealský protokol; ačkoli ve skutečnosti chlór v CFC je destruktivní aktér, fluor je důležitou součástí těchto molekul, protože je činí velmi stabilními a dlouhodobými. Podobně stabilita mnoha organofluorových sloučenin vyvolala problém bioperzistence. Například molekuly s dlouhou životností z hydroizolačních sprejů PFOA a PFOS, se celosvětově vyskytují v tkáních divoké zvěře a lidí, včetně novorozenců.
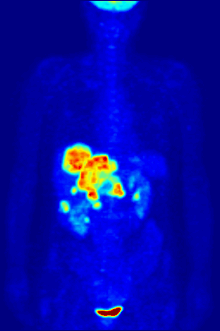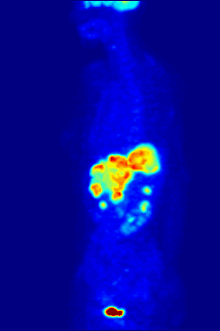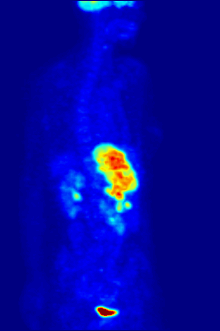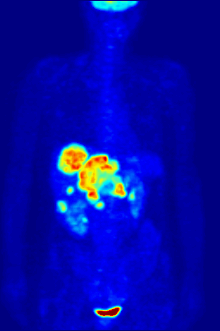
Biologie fluoru je také důležitá pro řadu špičkových technologií. PFC (perfluorované uhlovodíky ) jsou schopny pojmout dostatek kyslíku na podporu člověka tekuté dýchání. Organofluorin ve formě svého radioizotopu 18F je také jádrem moderní lékařské zobrazovací techniky známé jako pozitronová emisní tomografie (PET). PET sken vytváří trojrozměrné barevné obrazy částí těla, které používají velké množství cukru, zejména mozku nebo nádorů.
Péče o zuby
Od poloviny 20. století se podle populačních studií (i když neúplně pochopených) zjistilo, že fluorid redukuje zubní kaz. Vědci původně předpokládali, že fluorid pomáhá při přeměně zubní sklovina z minerálu rozpustnějšího v kyselině hydroxyapatit na minerálně méně rozpustný minerální fluorapatit. Novější studie však neprokázaly žádný rozdíl ve frekvenci kaz (dutiny) mezi zuby, které byly předem fluorovány v různé míře. Současné myšlení je takové, že fluorid předchází dutinám především tím, že pomáhá zubům, které jsou ve velmi raných fázích zubního kazu.[3]
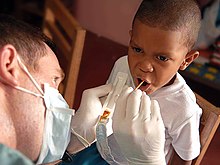
Když se zuby začínají rozpadat z kyseliny produkované bakteriemi konzumujícími cukr, vápník je ztracen (demineralizace). Pokud však rozpad není příliš pokročilý, mají zuby omezenou schopnost zpětného získávání vápníku (remineralizace). Zdá se, že fluorid snižuje demineralizaci a zvyšuje remineralizaci. Existují také důkazy, že fluorid interferuje s bakteriemi, které konzumují cukry v ústech a vytvářejí kyseliny ničící zuby.[3] V každém případě je to pouze fluorid, který je přímo přítomen v ústech (lokální léčba ) který zabraňuje dutinám; fluoridové ionty, které jsou spolknuty, zubům neprospívají.[3]
Fluoridace vody je řízené přidávání fluoridu do a veřejné zásobování vodou ve snaze snížit zubní kaz u lidí, kteří pijí vodu.[4] Jeho používání začalo ve 40. letech 20. století po studiích dětí v oblasti, kde je voda přirozeně fluoridována. Nyní se široce používá ve veřejných vodovodech ve Spojených státech a v některých dalších částech světa, takže asi dvě třetiny obyvatel USA jsou vystaveny dodávkám fluorované vody.[5] a asi 5,7% lidí na celém světě.[6] Ačkoli nejlepší dostupné důkazy neukazují žádnou souvislost s jinými nepříznivými účinky než je fluoróza (zubní a v horších případech kosterní ), z nichž většina je mírná,[7] fluoridace vody byla sporná z etických, bezpečnostních a efektivních důvodů,[6] a opozice vůči fluoridaci vody existuje navzdory široké podpoře ze strany veřejné zdraví organizace.[8] Výhody fluoridace vody se v poslední době zmenšily, pravděpodobně kvůli dostupnosti fluoridů v jiných formách, ale stále jsou měřitelné, zejména pro skupiny s nízkými příjmy.[9] Systematické kontroly v letech 2000 a 2007 vykázaly významnou redukci dutin u dětí vystavených fluoridaci vody.[10]
Fluorid sodný, difluorid cínu a nejčastěji monofluorofosforečnan sodný, se používají v zubní pasta. V roce 1955 byla ve Spojených státech zavedena první fluoridová zubní pasta. Nyní jsou téměř všechny zubní pasty ve vyspělých zemích fluorovány. Například 95% evropské zubní pasty obsahuje fluorid.[9] Gely a pěny se často doporučují zvláštním skupinám pacientů, zejména těm, kteří podstupují radiační terapii hlavy (pacienti s rakovinou). Pacient dostane čtyřminutovou aplikaci vysokého množství fluoridu. Laky, které lze rychleji nanášet, existují a plní podobnou funkci. Fluorid je také často přítomen na lékařský předpis a na lékařský předpis ústní vody a je stopovou složkou potravin vyráběných z dodávek fluoridované vody.[11]
Lékařské aplikace
Léčiva
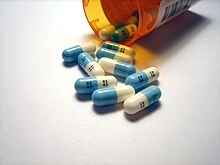
Ze všech komerčně dostupných farmaceutických léků obsahuje dvacet procent fluor, včetně důležitých léků v mnoha různých farmaceutických třídách.[12] Během molekul se do molekul léčiva často přidává fluor design léku, protože i jediný atom může žádoucími způsoby výrazně změnit chemické vlastnosti molekuly.
Kvůli značné stabilitě vazba uhlík-fluor Mnoho léků je fluorováno, aby se oddálilo metabolismus, což je chemický proces, při kterém se z léčiv stanou sloučeniny, které umožňují jejich eliminaci. To prodlužuje jejich poločasy a umožňuje delší dobu mezi dávkováním a aktivací. Například an aromatický kruh může zabránit metabolismu léku, ale to představuje bezpečnostní problém, protože některé aromatické sloučeniny se v těle metabolizují na jedovaté epoxidy původcem organismu enzymy. Substituce fluoru do a odst Tato poloha však chrání aromatický kruh a zabraňuje tvorbě epoxidu.[Citace je zapotřebí ]
Přidání fluoru k biologicky aktivním organickým sloučeninám zvyšuje jejich lipofilita (schopnost rozpouštět se v tucích), protože vazba uhlík-fluor je ještě hydrofobnější než vazba vazba uhlík-vodík. Tento účinek často zvyšuje drogu biologická dostupnost kvůli zvýšené penetraci buněčnou membránou.[13] I když je potenciál uvolňování fluoru ve fluoridu opouštějící skupina závisí na jeho poloze v molekule,[14] organofluoridy jsou obecně velmi stabilní, protože vazba uhlík-fluor je silná.
Fluoriny také nacházejí své společné použití mineralokortikoidy, třída léků, které zvyšují krevní tlak. Přidání fluoru zvyšuje jak jeho lékařskou sílu, tak protizánětlivé účinky.[15] Obsahující fluor fludrokortison je jedním z nejčastějších z těchto léků.[16] Dexamethason a triamcinolon, které patří mezi nejúčinnější příbuzné syntetiky kortikosteroidy třída léků, obsahují také fluor.[16]
Několik generálů se nadechlo anestetikum látky, včetně nejčastěji používaných inhalačních látek, také obsahují fluor. První fluorované anestetikum, halothan Ukázalo se, že je mnohem bezpečnější (ani výbušný, ani hořlavý) a má delší životnost než dříve používané. Moderní fluorovaná anestetika jsou stále déle trvající a téměř nerozpustná v krvi, což urychluje probuzení.[17] Mezi příklady patří sevofluran, desfluran, enfluran, a isofluran, Všechno uhlovodík deriváty.[18]
Před osmdesátými léty antidepresiva změněno nejen serotonin absorpce, ale také absorpce změněných norepinefrin; druhý způsobil většinu vedlejších účinků antidepresiv. První lék, který změnil pouze absorpci serotoninu, byl Prozac; to zrodilo rozsáhlé selektivní inhibitor zpětného vychytávání serotoninu (SSRI) třída antidepresiv a je nejprodávanějším antidepresivem. Mnoho dalších antidepresiv SSRI jsou fluorované organické látky, včetně Celexa, Luvox, a Lexapro.[19] Fluorochinolony jsou běžně používanou rodinou širokospektrální antibiotika.[20]
 |  |  |  |
|---|---|---|---|
| Lipitor (atorvastatin) | 5-FU (fluorouracil) | Florinef (fludrocortisone) | Isofluran |
Snímání

Sloučeniny obsahující fluor-18, radioaktivní izotop, který emituje pozitrony, se často používají v pozitronová emisní tomografie (PET) skenování, protože poločas izotopu asi 110 minut je podle standardů pozitron-emitor užitečně dlouhý. Jeden takový radiofarmaka je 2-deoxy-2- (18F) fluor-D-glukóza (obecně označovaná jako fludeoxyglukóza), běžně zkráceně jako 18F-FDG, nebo jednoduše FDG.[21] V PET zobrazování lze FDG použít pro hodnocení metabolismu glukózy v mozku a pro zobrazování rakovinových nádorů. Po injekci do krve je FDG absorbován tkáněmi „FDG-avid“ s vysokou potřebou glukózy, jako je mozek a většina typů maligních nádorů.[22] Tomografie, často pomocí počítače k vytvoření stroje PET / CT (CT znamená „počítačová tomografie“), lze jej použít k diagnostice nebo sledování léčby rakoviny, zejména Hodgkinův lymfom, rakovina plic a rakovina prsu.[23]
Přírodní fluor je monoisotopický, sestává pouze z fluor-19. Sloučeniny fluoru jsou vysoce přístupné nukleární magnetická rezonance (NMR), protože fluor-19 má a jaderná rotace z1⁄2, výška nukleární magnetický moment a vysoká magnetogyrický poměr. Sloučeniny fluoru mají obvykle rychlou NMR relaxace, což umožňuje použití rychlého průměrování k získání a odstup signálu od šumu podobný vodík-1 NMR spektra.[24] Fluor-19 se běžně používá při NMR studiu metabolismu, proteinových struktur a konformačních změn.[25] Kromě toho mají inertní fluorované plyny potenciál být levným a účinným nástrojem pro zobrazování plicní ventilace.[26]
Výzkum přenosu kyslíku
Kapalné fluorované uhlovodíky mají velmi vysokou kapacitu pro zadržování plynu v roztoku. Mohou pojmout více kyslíku nebo oxidu uhličitého než krev. Z tohoto důvodu přitahovali trvalý zájem týkající se možnosti umělé krve nebo tekutého dýchání.[27]

Krevní náhražky jsou předmětem výzkumu, protože poptávka po krevních transfuzích roste rychleji než dárcovství. V některých případech může být umělá krev pohodlnější nebo bezpečnější. Protože fluorované uhlovodíky se běžně nemísí s vodou, je nutné je použít jako krev, aby byly smíchány do emulzí (malé kapičky perfluorokarbonu suspendované ve vodě).[28][29] Jeden takový produkt, Oxycyt, prošel počátečními klinickými zkouškami.[30][31]
Možná lékařská použití tekutého dýchání (při kterém se používá čistá kapalina s obsahem fluorovaných uhlovodíků, nikoli vodní emulze) zahrnují pomoc předčasně narozeným dětem nebo obětem popálenin (pokud je ohrožena normální funkce plic). Uvažovalo se o částečném i úplném naplnění plic, i když pouze u prvního došlo k významným testům na lidech. Bylo provedeno několik testů na zvířatech a proběhlo několik pokusů s parciální ventilací u lidí.[32] Jedno úsilí společnosti Alliance Pharmaceuticals dosáhlo klinických studií, ale bylo upuštěno kvůli nedostatečné výhodě ve srovnání s jinými terapiemi.[33]
Nanokrystaly představují možnou metodu dodávání léčiv rozpustných ve vodě nebo v tucích v perfluorochemické tekutině. Použití těchto částic se vyvíjí, aby pomohlo léčit děti s poškozenými plícemi.[34]
Perfluorované uhlovodíky mají zakázán sport, kde mohou být použity ke zvýšení spotřeby kyslíku u vytrvalostních sportovců. Jeden cyklista, Mauro Gianetti, byl vyšetřován po téměř smrtelném úrazu, kdy bylo podezření na použití PFC.[35][36] Mezi další předpokládané aplikace patří hlubinné potápění a cestování do vesmíru, aplikace, které vyžadují úplnou, nikoli částečnou ventilaci kapalin.[37][38] Film z roku 1989 Propast líčil fiktivní použití perfluorokarbonu pro lidské potápění, ale také natočil skutečnou krysu, která přežila, když byla ochlazena a ponořena do perfluorokarbonu.[39] (Viz také seznam smyšlených ošetření dýchání perfluorovaných uhlovodíků.)
Agrochemikálie
Odhaduje se, že 30% agrichemické sloučeniny obsahují fluor.[40] Většina z nich se používá jako jedy, ale některé místo toho stimulují růst.

Fluoracetát sodný byl používán jako insekticid, ale je obzvláště účinný proti savčím škůdcům.[41] Název „1080“ odkazuje na katalogové číslo jedu, který se stal jeho značkou.[42] Fluoracetát je podobný octanu, který hraje klíčovou roli v Krebsův cyklus (klíčová součást buněčného metabolismu). Fluoracetát zastaví cyklus a způsobí, že buňky budou zbaveny energie.[42] Několik dalších insekticidů obsahuje fluorid sodný, který je mnohem méně toxický než fluoracetát.[43] Hmyz krmený 29-fluorostigmasterolem se používá k výrobě fluoracetátů. Pokud je fluor přenesen do buňky těla, blokuje metabolismus v obsazené poloze.[44]
Trifluralin byl široce používán ve 20. století, například na více než polovině amerických ploch bavlny v roce 1998.[45]) Vzhledem k jeho podezření na karcinogenní vlastnosti ji některé země severní Evropy v roce 1993 zakázaly.[46] Od roku 2015 to Evropská unie zakázala, ačkoli Dow se v roce 2011 rozhodl zrušit rozhodnutí.[47]
Biochemie

Počet biologicky syntetizovaných organofluorinů je malý, i když některé jsou široce vyráběny.[48][49] Nejběžnějším příkladem je fluoracetát s aktivní molekulou jedu shodnou s komerčním „1080“. Používá se jako obrana proti býložravcům nejméně 40 zelených rostlin v Austrálii, Brazílii a Africe;[42] další biologicky syntetizované organofluoriny zahrnují ω-fluor mastné kyseliny, fluoroaceton a 2-fluorocitrát.[49] V bakteriích je to enzym adenosyl-fluorid syntáza, který vytváří vazbu uhlík-fluor, byl izolován. Objev byl uváděn jako možná vedoucí k biologickým cestám pro syntézu organofluorinu.[50]
Fluorid je považován za polopodstatný prvek pro člověka: není nutný k udržení života, ale přispívá (v úzkých mezích denního příjmu) ke zdraví zubů a pevnosti kostí. Denní potřeba fluoru u lidí se liší podle věku a pohlaví, od 0,01 mg u kojenců do 6 měsíců do 4 mg u dospělých mužů, přičemž horní tolerovatelná hranice je 0,7 mg u kojenců do 10 mg u dospělých mužů a žen.[51][52] Malá množství fluoridu mohou být prospěšná pro pevnost kostí, ale to je problém pouze při formulaci umělých diet.[53] (Viz také nedostatek fluoridů.)
Nebezpečí
| NFPA 704 ohnivý diamant | |
|---|---|
Značka nebezpečí ohnivého diamantu pro elementární fluor.[54] |

Fluorovaný plyn
Elementární fluor je vysoce toxický. Při koncentraci nad 25 ppm způsobuje výrazné podráždění při napadení očí, dýchacích cest a plic a při působení na játra a ledviny. Při koncentraci 100 ppm jsou lidské oči a nosy vážně poškozeny.[56] Lidé mohou být vystaveni fluoru na pracovišti vdechováním, kontaktem s kůží nebo očima. The Správa bezpečnosti a ochrany zdraví při práci (OSHA) stanovila zákonný limit (Přípustný limit expozice ) pro expozici fluoru na pracovišti jako 0,1 ppm (0,2 mg / m.)3) během 8 hodin pracovního dne. The Národní institut pro bezpečnost a ochranu zdraví při práci (NIOSH) nastavil a doporučený expoziční limit (REL) 0,1 ppm (0,2 mg / m.)3) během 8 hodin pracovního dne. Při hladinách 25 ppm je fluor bezprostředně nebezpečné pro život a zdraví.[57]
Kyselina fluorovodíková

Kyselina fluorovodíková, vodný roztok fluorovodíku (HF), je kontaktní jed. I když je to z chemického hlediska relativně slabá kyselina, je mnohem nebezpečnější než konvenční silná minerální kyseliny, jako kyselina dusičná, kyselina sírová nebo kyselina chlorovodíková. Díky své menší chemické disociaci ve vodě (zůstává neutrální molekulou) fluorovodík proniká do tkáně rychleji než typické kyseliny. K otravě může dojít snadno kůží nebo očima nebo při vdechování nebo polknutí. V letech 1984 až 1994 zemřelo ve Spojených státech při nehodách s HF nejméně devět pracovníků.[59]
Jakmile je fluorovodík v krvi, reaguje s vápníkem a hořčíkem, což vede k nerovnováze elektrolytů hypokalcémie. Následný účinek na srdce (srdeční arytmie ) může být fatální.[59] Tvorba nerozpustných látek fluorid vápenatý také způsobuje silnou bolest.[60] Popáleniny o ploše větší než 160 cm2, o velikosti lidské ruky, může způsobit vážnou systémovou toxicitu.[61]
Příznaky expozice kyselině fluorovodíkové nemusí být okamžitě patrné, s osmihodinovým zpožděním pro 50% HF a až 24 hodin pro nižší koncentrace. Fluorovodík narušuje funkci nervů, což znamená, že popáleniny nemusí být zpočátku bolestivé. Pokud bylo popálení zpočátku zaznamenáno, měl by být HF omyt silným proudem vody po dobu deseti až patnácti minut, aby se zabránilo jeho dalšímu pronikání do těla. Nebezpečí může představovat také oděv používaný popálenou osobou.[62] Expozice kyselině fluorovodíkové je často ošetřena glukonát vápenatý, zdroj Ca2+ který se váže na fluoridové ionty. Popáleniny kůže lze ošetřit vodou a 2,5% gelem glukonátu vápenatého[63][64] nebo speciální řešení oplachování.[65] Protože se HF vstřebává, je nutné další lékařské ošetření. Glukonát vápenatý lze injikovat nebo podávat intravenózně. Použití chlorid vápenatý je kontraindikován a může vést k závažným komplikacím. Někdy je nutná chirurgická excize tkáně nebo amputace.[61][66]
Fluoridový ion

Rozpustné fluoridy jsou mírně toxické. Pro fluorid sodný je smrtelná dávka pro dospělé 5–10 g, což odpovídá 32–64 mg elementárního fluoridu na kilogram tělesné hmotnosti.[67] Dávka, která může vést k nepříznivým účinkům na zdraví, je přibližně pětina smrtelné dávky.[68] Chronická nadměrná spotřeba fluoridu může vést k kosterní fluoróza, onemocnění kostí, které postihuje miliony lidí v Asii a Africe.[68][69]
Fluoridový iont je snadno absorbován žaludkem a střevy. Požitý fluorid tvoří v žaludku kyselinu fluorovodíkovou. V této formě fluorid prochází buněčnými membránami a poté se váže na vápník a interferuje s různými enzymy. Fluorid je vylučován močí. Limity expozice fluoridům jsou založeny na testování moči, které se používá k určení schopnosti lidského těla zbavit se fluoridů.[68][70]
Historicky byla většina případů otravy fluoridy způsobena náhodným požitím insekticidů obsahujících anorganický fluorid.[71] Většina volání do středisek pro kontrolu otravy pro možnou otravu fluoridy pochází z požití zubní pasty obsahující fluorid.[68] Několikrát došlo k poruše zařízení na fluorizaci vody, včetně aljašského incidentu, při kterém onemocnělo téměř 300 lidí a jednoho zabil.[72]
Bioperzistence
Kvůli síle vazby uhlík-fluor zůstávají organofluoriny v prostředí. Perfluorované sloučeniny (PFC) přitahovaly zvláštní pozornost jako přetrvávající globální kontaminanty. Tyto sloučeniny mohou vstoupit do životního prostředí z přímého použití při hydroizolačních úpravách a hašení požáru nebo nepřímo z úniků z výroben fluoropolymerů (kde jsou meziprodukty). Kvůli kyselé skupině jsou PFC rozpustné ve vodě v nízkých koncentracích.[73] I když existují další PFAA, lví podíl na výzkumu životního prostředí byl proveden na dvou nejznámějších: kyselina perfluoroktansulfonová (PFOS) a kyselina perfluoroktanová (PFOA). Americká agentura pro ochranu životního prostředí klasifikuje tyto materiály jako „vznikající kontaminanty“ na základě rostoucího, ale stále neúplného pochopení jejich dopadu na životní prostředí.[74][75][76]
Stopové množství PFC bylo zjištěno po celém světě, v organismech od ledních medvědů v Arktidě až po globální lidskou populaci. PFOS i PFOA byly detekovány v mateřském mléce a krvi novorozenců. Přehled z roku 2013 ukázal velmi různá množství PFOS a PFOA v různých půdách a podzemních vodách, aniž by dominoval jasný vzorec jedné chemické látky. Koncentrace PFC byly obecně vyšší v oblastech s více lidskou populací nebo průmyslovou aktivitou a oblasti s více PFOS obecně také měly více PFOA.[77] tyto dvě chemikálie byly nalezeny v různých koncentracích v různých populacích; například jedna studie ukázala u Němců více PFOS než PFOA, zatímco jiná studie ukázala u Američanů opak. PFC se možná začínají snižovat v biosféře: jedna studie naznačila, že hladiny PFOS v divočině v Minnesotě klesaly, pravděpodobně proto, 3M ukončila výrobu.[74][75]
V těle se PFC váží na proteiny, jako jsou sérový albumin. Jejich distribuce v tkáních u lidí není známa, ale studie na potkanech naznačují, že je přítomna většinou v játrech, ledvinách a krvi. Nejsou metabolizovány tělem, ale vylučovány ledvinami. Doba pobytu v těle se velmi liší podle druhu. Hlodavci mají poločasy dnů, zatímco u lidí zůstávají roky. Mnoho zvířat vykazuje sexuální rozdíly ve schopnosti zbavit tělo PFAA, ale bez jasného vzorce. Genderové rozdíly poločasů se liší podle druhů zvířat.[74][75][78]
Potenciální dopad PFC na zdraví je nejasný. Na rozdíl od chlorovaných uhlovodíků PFC nejsou lipofilní (uloženo v tuku), ani genotoxický (škodlivé geny). Jak PFOA, tak PFOS ve vysokých dávkách způsobují u hlodavců rakovinu a smrt novorozenců. Studie na lidech nedokázaly prokázat dopad při současné expozici. Delfíni skákaví nechat si studovat jedny z nejvyšších koncentrací PFOS jakékoli divoké zvěře; jedna studie naznačuje dopad na jejich imunitní systém.[74][75][78]
Biochemické příčiny toxicity jsou také nejasné a mohou se lišit podle molekuly, účinků na zdraví a dokonce i zvířat. PPAR-alfa je protein, který interaguje s PFAA a obvykle se podílí na rakovině hlodavců způsobené znečištěním.[74][75][78]
V prostředí lze také detekovat méně fluorované chemikálie (tj. Ne perfluorované sloučeniny). Protože biologické systémy nemetabolizují snadno fluorované molekuly, lze v upravených městských odpadních vodách a odpadních vodách nalézt fluorovaná léčiva, jako jsou antibiotika a antidepresiva.[79] Agrochemikálie obsahující fluor jsou měřitelné na zemědělské půdě odtok a blízké řeky.[80][úplná citace nutná ]
Viz také
- Datování absorpce fluoru (relativní metoda pro archeologické datování kostí nebo jiných organických látek)
- Nedostatek fluoru
- Toxicita fluoridů
Reference
- ^ G. Siegemund, W. Schwertfeger, A. Feiring, B. Smart, F. Behr, H. Vogel, B. McKusick „Fluorine Compounds, Organic“ v „Ullmann's Encyclopedia of Industrial Chemistry“ 2005, Wiley-VCH, Weinheim. doi:10.1002 / 14356007.a11_349
- ^ Aigueperse, Jean; Mollard, Paul; Devilliers, Didier; Chemla, Marius; Faron, Robert; Romano, Renée; Cuer, Jean Pierre (2005), „Fluorine Compounds, Anorganic“, Ullmann (ed.), Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002 / 14356007.a11_307, ISBN 978-3527306732
- ^ A b C Pizzo G .; Piscopo, M. R.; Pizzo, I .; Giuliana, G. (2007). „Fluoridace vody ve Společenství a prevence zubního kazu: kritický přezkum“ (PDF). Klinické orální vyšetřování. 11 (3): 189–193. doi:10.1007 / s00784-007-0111-6. PMID 17333303.
- ^ Centra pro kontrolu a prevenci nemocí (2001). „Doporučení pro používání fluoridu k prevenci a kontrole zubního kazu ve Spojených státech“. Doporučení a zprávy MMWR. 50 (RR – 14): 1–42. PMID 11521913.
- ^ Ripa, L. W. (1993). „Půlstoletí komunitní fluoridace vody ve Spojených státech: recenze a komentáře“ (PDF). Journal of Public Health Dentistry. 53 (1): 17–44. doi:10.1111 / j.1752-7325.1993.tb02666.x. PMID 8474047. Archivovány od originál (PDF) dne 04.03.2009.
- ^ A b Cheng, K. K .; Chalmers, I .; Sheldon, T. A. (2007). „Přidávání fluoridu do vodních zdrojů“ (PDF). BMJ. 335 (7622): 699–702. doi:10.1136 / bmj.39318.562951.BE. PMC 2001050. PMID 17916854.
- ^ Marya, C. M. (2011). Učebnice stomatologie veřejného zdraví. JP Medical Limited. str. 343. ISBN 9789350252161.
- ^ Armfield, J. M. (2007). „Když veřejná akce podrývá veřejné zdraví: kritické zkoumání antifluoridační literatury“. Zdravotní politika Austrálie a Nového Zélandu. 4 (1): 25. doi:10.1186/1743-8462-4-25. PMC 2222595. PMID 18067684.
- ^ A b Fejerskov, Ole; Kidd, Edwina (2008). Zubní kaz: Nemoc a její klinické zvládání. John Wiley & Sons. str. 518. ISBN 978-1-4051-3889-5.
- ^ Národní rada pro zdraví a lékařský výzkum (Austrálie) (2007). „Systematický přehled o účinnosti a bezpečnosti fluoridace“ (PDF). Archivovány od originál (PDF) dne 13. ledna 2012. Citováno 24. února 2009. Souhrn: Yeung, C. A. (2008). „Systematický přehled o účinnosti a bezpečnosti fluoridace“. Dentologie založená na důkazech. 9 (2): 39–43. doi:10.1038 / sj.ebd.6400578. PMID 18584000.
- ^ Cracher, Connie Myers (2009). „Současné koncepty v preventivní stomatologii“ (PDF). dentalcare.com. str. 12. Archivovány od originál (PDF) dne 14. října 2013. Citováno 20. ledna 2012.
- ^ Emsley, John (2011). Stavební kameny přírody: A – Z průvodce po prvcích (2. vyd.). Oxford University Press. str. 178. ISBN 978-0-19-960563-7.
- ^ Swinson, Joel (2005). „Fluor - důležitý prvek v lékárně“ (PDF). PharmaChem: 26–27. Archivovány od originál (PDF) dne 8. února 2012. Citováno 26. srpna 2010.
- ^ Schubiger, P. A. (2006). Chemie domácích zvířat: Hnací síla v molekulárním zobrazování. Springer. str. 144. ISBN 9783540326236.
- ^ Goulding, Nicolas J .; Květina, Rod J. (2001). Glukokortikoidy. Springer. str. 40. ISBN 9783764360597.
- ^ A b Raj, P. Prithvi; Erdine, Serdar (2012). Postupy ke zmírnění bolesti: Ilustrovaný průvodce. John Wiley & Sons. str. 58. ISBN 9781118300459.
- ^ Bégué, Jean-Pierre; Bonnet-Delpon, Daniele (2008). Bioorganická a léčivá chemie fluoru. John Wiley & Sons. str.335 –336. ISBN 9780470281871.
- ^ Filler, R .; Saha, R. (2009). „Fluor v léčivé chemii: Století pokroku a 60letá retrospektiva vybraných předností“ (PDF). Budoucí léčivá chemie. 1 (5): 777–791. doi:10,4155 / fmc.09,65. PMID 21426080. Archivovány od originál (PDF) dne 22.10.2013.
- ^ Mitchell, E. Siobhan; Triggle, D. J. (2004). Antidepresiva. Publikování na Infobase. 37–39. ISBN 978-1-4381-0192-7.
- ^ Nelson, J. M .; Chiller, T. M .; Powers, J. H .; Angulo, F. J. (2007). „Druhy Campylobacter rezistentní na fluorochinolony a vyřazení fluorochinolonů z používání u drůbeže: příběh úspěchu v oblasti veřejného zdraví“ (PDF). Klinické infekční nemoci. 44 (7): 977–980. doi:10.1086/512369. PMID 17342653.
- ^ Schmitz, A .; Kälicke, T .; Willkomm, P .; Grünwald, F .; Kandyba, J .; Schmitt, O. (2000). „Využití emisní tomografie fluorem-18-fluor-2-deoxy-D-glukózou pozitronovou emisní tomografií při hodnocení procesu tuberkulózní spondylitidy“ (PDF). Journal of Spinal Disorders. 13 (6): 541–544. doi:10.1097/00002517-200012000-00016. PMID 11132989.
- ^ Bustamante, Ernesto; Pedersen, Peter L. (1977). "Vysoká aerobní glykolýza krysích jaterních buněk v kultuře: Role mitochondriální hexokinázy". Sborník Národní akademie věd Spojených států amerických. 74 (9): 3735–3739. Bibcode:1977PNAS ... 74,3735B. doi:10.1073 / pnas.74.9.3735. PMC 431708. PMID 198801.
- ^ Hayat, M. A. (2007). Zobrazování rakoviny: Karcinomy plic a prsu. Akademický tisk. str. 41. ISBN 9780123742124.
- ^ Nelson, J. H. (2003). Spektroskopie nukleární magnetické rezonance. Prentice Hall. str. 129–139. ISBN 978-0-13-033451-0.
- ^ Danielson, Mark A .; Falke, Joseph J. (1996). "Použití 19F NMR ke zkoumání struktury proteinů a konformačních změn ". Roční přehled biofyziky a biomolekulární struktury. 25: 163–195. doi:10.1146 / annurev.bb.25.060196.001115. PMC 2899692. PMID 8800468.
- ^ Kuethe, Dean O .; Caprihan, Arvind; Fukushima, Eiichi; Wagoner, R. Allen (2005). "Zobrazovací plíce pomocí inertních fluorovaných plynů". Magnetická rezonance v medicíně. 39 (1): 85–88. doi:10,1002 / mrm.1910390114. PMID 9438441.
- ^ Gabriel, J.L .; Miller, T. F .; Wolfson, M. R. Jr.; Shaffer, T. H. (1996). „Kvantitativní vztahy mezi strukturou a aktivitou perfluorovaných hetro-uhlovodíků jako potenciálních respiračních médií. Aplikace na rozpustnost kyslíku, rozdělovací koeficient, viskozitu, tlak par a hustotu“. ASAIO Journal. 42 (6): 968–973. doi:10.1097/00002480-199642060-00009. PMID 8959271.
- ^ Sarkar, S. (2008). "Umělá krev". Indian Journal of Critical Care Medicine. 12 (3): 140–144. doi:10.4103/0972-5229.43685. PMC 2738310. PMID 19742251.
- ^ Schimmeyer, S. (2002). „Hledání náhražky krve“. Illumin. 5 (1). Archivovány od originál dne 2. října 2011. Citováno 2. prosince 2010.
- ^ Tasker, Fred (19. 3. 2008). „Miami Herald: Umělá krev jde od science fiction k science science“. Miami Herald (na noblood.org). Archivovány od originál dne 24. července 2008. Citovat deník vyžaduje
| deník =(Pomoc) Alternativní URL - ^ Davis, Nicole (2006). „Lepší než krev“. Populární věda. Archivovány od originál dne 04.06.2011. Citováno 30. září 2012.
- ^ Shaffer, T. H .; Wolfson, M. R.; Clark, L. R. (1992). „Přehled současného stavu techniky: Kapalinová ventilace“. Pediatrická pulmonologie. 14 (102–109): 102–9. doi:10.1002 / ppul.1950140208. PMID 1437347.
- ^ Kacmarek, R. M .; Wiedemann, H. P .; Lavin, P. T .; Wedel, M. K .; Tütüncü, A. S .; Slutsky, A. S. (2006). „Částečná ventilace kapalinou u dospělých pacientů se syndromem akutní respirační tísně“. American Journal of Respiratory and Critical Care Medicine. 173 (8): 882–889. doi:10,1164 / rccm. 200508-1196OC. PMID 16254269.
- ^ Shaffer, Thomas H .; Wolfson, Marla R .; Greenspan, Jay S. (1999). "Kapalinová ventilace: aktuální stav". Pediatrie v přehledu. 20 (12): e134 – e142. doi:10.1542 / pir.20-12-e134. PMID 10587539.
- ^ Gains, Paul (18. října 1998). „Nová hrozba dopingu v krvi“. New York Times.
- ^ "Umírající jezdit". 1999-04-21.
- ^ Kylstra, J. A. (1977). Proveditelnost dýchání kapaliny u člověka. Duke University. Archivovány od originál dne 7. července 2008. Citováno 5. května 2008.
- ^ Globální závazek jednoty. „Tekuté dýchání - vesmírné cestování“. experiencefestival.com. Archivovány od originál dne 17. dubna 2010. Citováno 17. května 2008.
- ^ Aljean Harmetz (1989). „FILM;„ Propast “: vpád do hlubokých vod“. The New York Times. Citováno 2. října 2012.
- ^ „Fluorova pokladnice“. Novinky ICIS. 2006-10-02. Citováno 20. února 2011.
- ^ Eisler, Ronald (1995). Biologická zpráva 27: Monofluoroacetát sodný (1080) Nebezpečí pro ryby, divokou zvěř a bezobratlé: souhrnný přehled (PDF) (Zpráva). Patuxent Environmental Science Center (Americká národní biologická služba). Archivovány od originál (PDF) dne 12. června 2010. Citováno 5. června 2011.
- ^ A b C Proudfoot, A. T .; Bradberry, S. M .; Vale, J. A. (2006). „Otrava fluoracetátem sodným“. Toxikologické recenze. 25 (4): 213–219. doi:10.2165/00139709-200625040-00002. PMID 17288493.
- ^ „Látky poškozující ozonovou vrstvu I. třídy“. Fluorid sodný - pesticidní použití. Scorecard. Citováno 20. února 2011.
- ^ Barnette, William E. (1995). "Fyzikální organické aspekty fluorovaných argichemikálií". Fluor v zemědělství. Nakladatelství Smithers Rapra Publishing. s. 1–19. ISBN 9781859570333.
- ^ "Informační list: Trifluralin". Zprávy o pesticidech. 52: 20–21. 2001.
- ^ Evropská komise (2007). Trifluralin (PDF) (Zpráva).
- ^ Věc T-475/07, Dow AgroSciences Ltd vs. Evropská komise (2011). Tribunál Evropské unie (třetí prohnutí).
- ^ Gribble, Gordon W. (2002). "Přirozeně se vyskytující organofluoriny". Organofluoriny. Příručka chemie životního prostředí. 3N. s. 121–136. doi:10.1007/10721878_5. ISBN 978-3-540-42064-4.
- ^ A b Murphy, C .; Schaffrath, C .; O'Hagan, D. (2003). „Fluorované přírodní produkty: Biosyntéza fluoroacetátu a 4-fluorothreoninu v Streptomyces cattleya". Chemosféra. 52 (2): 455–461. Bibcode:2003Chmsp..52..455M. doi:10.1016 / S0045-6535 (03) 00191-7. PMID 12738270.
- ^ O'Hagan, D .; Schaffrath, C .; Cobb, S.L .; Hamilton, J. T .; Murphy, C. D. (2002). "Biochemistry: Biosyntéza molekuly organofluorinu". Příroda. 416 (6878): 279. Bibcode:2002 Natur.416..279O. doi:10.1038 / 416279a. PMID 11907567.
- ^ Olivares, M .; Uauy, R. (2004). Základní živiny v pitné vodě: tabulky 2,6,7,8. (Návrh) (PDF) (Zpráva). SZO. Archivovány od originál (PDF) dne 19. října 2012. Citováno 30. prosince 2008.
- ^ Rada pro výživu a výživu, Lékařský ústav, Národní akademie. Referenční dietní příjem (DRI): Doporučené dietní dávky a odpovídající příjem, prvky. http://www.nationalacademies.org/hmd/~/media/Files/Activity%20Files/Nutrition/DRI-Tables/2_%20RDA%20and%20AI%20Values_Vitamin%20and%20Elements.pdf?la=cs Archivováno 13.11.2018 na Wayback Machine Přístup k 2. lednu 2019.
- ^ Nielsen, Forrest H. (2009). „Mikroživiny v parenterální výživě: bór, křemík a fluorid“. Gastroenterologie. 137 (5 doplňků): S55 – S60. doi:10.1053 / j.gastro.2009.07.072. PMID 19874950.
- ^ "FLUORINE | CAMEO Chemicals | NOAA".
- ^ NOAA 9Datový list F..
- ^ Keplinger a Suissa 1968.
- ^ „CDC - NIOSH Kapesní průvodce chemickými nebezpečími - fluor“. www.cdc.gov. Citováno 2015-11-03.
- ^ Eaton, Charles. "Obrázek hfl". E-Hand.com: elektronická učebnice chirurgie ruky. Hand Center (dřívější praxe Dr. Eatona). Citováno 28. září 2013.
- ^ A b Blodgett, Suruda & Crouch 2001.
- ^ Hoffman a kol. 2007, str. 1333.
- ^ A b HSM 2006.
- ^ Fischman 2001, str.458–459.
- ^ El Saadi a kol. 1989.
- ^ Roblin a kol. 2006.
- ^ Hultén a kol. 2004.
- ^ Zorich 1991, str.182–3.
- ^ Liteplo a kol. 2002, str. 100.
- ^ A b C d Shin & Silverberg 2013.
- ^ Reddy 2009.
- ^ Baez, Baez a Marthaler 2000.
- ^ Augenstein a kol. 1991.
- ^ Gessner a kol. 1994.
- ^ Giesy, John P .; Kannan, Kurunthachalam (2002). „Peer reviewed: Perfluorochemical Surfactants in the Environment“. Věda o životním prostředí a technologie. 36 (7): 146A – 152A. Bibcode:2002EnST ... 36..146G. doi:10.1021 / es022253t. PMID 11999053.
- ^ A b C d E Steenland K, Fletcher T, Savitz DA (2010). „Epidemiologické důkazy o účincích kyseliny perfluoroktanové (PFOA) na zdraví“. Environ. Perspektiva zdraví. 118 (8): 1100–8. doi:10,1289 / ehp.0901827. PMC 2920088. PMID 20423814.
- ^ A b C d E Betts, Kellyn (listopad 2007). „PFOS a PFOA u lidí: nová studie spojuje prenatální expozici nižší porodní hmotnosti“. Perspektivy zdraví a životního prostředí. 115 (11): A550. doi:10,1289 / ehp.115-a550a. PMC 2072861. PMID 18007977.
- ^ „Informační list o rozvíjejících se kontaminujících látkách - PFOS a PFOA“ (PDF). 2013-04-23. Archivovány od originál (PDF) 29. října 2013. Citováno 1. listopadu 2013.
- ^ P. Zareitalabad, J. Siemens, M. Hamer, W. Amelung Kyselina perfluoroktanová (PFOA) a kyselina perfluoroktansulfonová (PFOS) v povrchových vodách, sedimentech, půdách a odpadních vodách - přehled koncentrací a distribučních koeficientů Archivováno 04.03.2016 na Wayback Machine Chemosphere 91 (2013) 725–732. Posouzení
- ^ A b C Lau C, Anitole K, Hodes C, Lai D, Pfahles-Hutchens A, Seed J (2007). „Perfluoralkylové kyseliny: přehled monitorování a toxikologických nálezů“ (PDF). Toxicol Sci. 99 (2): 366–394. doi:10.1093 / toxsci / kfm128. PMID 17519394.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Lietz & Meyer 2006, s. 7–8.
- ^ Ahrens 2011.
externí odkazy
- Silná kyselina to není, ale smrtící je ... (Podcast o fluoru, všimněte si prvních pár minut diskuse o smrtelném popálení HF.)

