Varianta povrchového glykoproteinu - Variant surface glycoprotein
| Variabilní povrchový glykoprotein | |
|---|---|
| Identifikátory | |
| Organismus | |
| Symbol | Tb927.5.4730 |
| Alt. symboly | Tb05.26C7.380 |
| Entrez | 3657576 |
| Další údaje | |
| Chromozóm | 5: 1,41 - 1,41 Mb |
| Varianta povrchového glykoproteinu MITAT 1.2 | |||||||
|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||
| Organismus | |||||||
| Symbol | N / A | ||||||
| Alt. symboly | VSG 221 | ||||||
| UniProt | P26332 | ||||||
| |||||||
Varianta povrchového glykoproteinu (VSG) je ~ 60 kDa protein, který hustě zabalí povrch buňky z prvoky paraziti patřící do rodu Trypanosoma. Tvoří povrchovou vrstvu 12–15 nm a byly nejprve izolovány z Trypanosoma brucei v roce 1975 George Cross.[1] VSG umožňuje trypanosomatidovým parazitům extenzivně se vyhnout imunitnímu systému savčího hostitele antigenní variace. VSG nemá žádné předepsané biochemické aktivita.

Parazit má velký buněčný repertoár antigenně odlišných VSG (~ 1 500 úplných a částečných (pseudogeny )) nacházející se v telomerní a subtelomerní pole (zapnuto megabáze chromozomy nebo minichromozomy ). VSG jsou exprimovány z místa exprese krevního řečiště (BES, ES) v a polycistron podle RNA polymeráza I (přijato do ribozomálního typu promotér ) s jinými geny asociovanými s ES (ESAG), z nichž receptor transferinu (Tfr: ESAG6, ESAG7) je jeden. Současně je exprimován pouze jeden gen VSG, protože pouze jeden z ~ 15 ES je aktivní v buňce. Výraz VSG je „přepnut“ homologní rekombinace tichého základního kopií genu z pole (řízeného homologií) do aktivního telomericky umístěného expresního místa.[2] Geny mozaikové VSG lze vytvořit homologní rekombinací částečného genu VSG z řady. Tento částečný gen může nahradit jakoukoli část žijícího genu VSG a vytvořit novou mozaiku VSG.
v Trypanosoma brucei
v Trypanosoma brucei, povrch buňky je pokryt hustou vrstvou ~ 5 x 106 VSG dimery,[3] ~ 90% veškerého proteinu buněčného povrchu. Rovněž tvoří ~ 10% celkového buněčného proteinu.
Vlastnosti srsti VSG, které umožňují imunitní únik, jsou:
- Stínění - hustá povaha VSG pláště (proteiny VSG se balí rameno na rameno) brání imunitnímu systému savčího hostitele v přístupu k plazmatická membrána nebo jakýkoli jiný parazitický invariantní povrch epitopy (jako iontové kanály, transportéry, receptory atd.). Srst je jednotná a skládá se z milionů kopií stejné molekuly; proto je VSG jedinou částí trypanosomu, kterou imunitní systém dokáže rozpoznat.[4]
- Periodické antigenní variace - srst VSG prochází častými stochastický genetická modifikace - „přepínání“ - umožňující uniknout variantám vyjadřujícím nový plášť VSG specifická imunitní odpověď zvednutý proti předchozímu kabátu. Tato antigenní variace vytváří cyklické vlny parazitemie charakteristické pro lidskou africkou trypanosomiázu.[5]
- „Čištění“ antigenu a recyklace VSG - VSG se efektivně recykluje prostřednictvím bičíkové kapsy trypanosomu, což umožňuje „očištění“ protilátek z VSG před opětovným začleněním zpět do buněčné membrány. Důležité je, že VSG rozpoznávané a vázané protilátkami jsou selektivně tlačeny směrem k bičíkové kapse rychleji než neidentifikované VSG; v tomto scénáři protilátka funguje jako „plachta“, která zrychluje proces přivádění VSG do oblasti recyklace.[6]
Skupiny VSG z T. brucei jsou připojeny k plazmatické membráně kovalentním připojením ke dvěma glykosyl-fosfatidylinositol (GPI) kotvy (jedna na monomer ),[7] který směruje své dopředné obchodování z ER do bičíkové kapsy pro začlenění do membrány, jak předpovídala hypotéza GPI valence.[8][9]
VSG jsou nahrazeny stejně hustou vrstvou procykliny když se parazit diferencuje do procyklické formy v tsetse létat střední střevo. Existuje velmi rychlá inhibice transkripce genu VSG, ke které dochází, jakmile je teplota snížena.[10]
Výraz
Zdrojem variability VSG během infekce je velký „archiv“ VSG geny přítomné v T. brucei genom. Některé z nich jsou celovečerní, neporušené geny; ostatní jsou pseudogeny (obvykle s mutace posunu snímků, předčasné stop kodony nebo fragmentace).[11] Exprese antigenně odlišného VSG může nastat pouhým přepnutím na jinou plnou délku VSG gen přepínáním Expression Site (přepínání, které ES je aktivní). Navíc, chimérický nebo 'mozaika' VSG geny lze generovat kombinací segmentů z více než jednoho tichého VSG gen. Tvorba mozaiky VSGs umožňuje (částečnou) expresi pseudogenu VSGs, které mohou představovat hlavní část VSG archivovat a může přímo přispívat k antigenní variabilitě, což výrazně zvyšuje kapacitu trypanosomu pro imunitní únik a představuje hlavní problém pro vakcína rozvoj.[12]
VSG geny lze uchovat tichý a zapnuto kdykoli. Vyjádřený VSG je vždy umístěn v Expression Site (ES), což jsou specializované výrazy loci nalezeno na telomery některých velkých a středních chromozomů. Každý ES je polycistronická jednotka, která obsahuje řadu genů asociovaných s expresním místem (ESAG), které jsou všechny exprimovány spolu s aktivním VSG. I když existuje více ES, vždy je aktivní pouze jeden. Zdá se, že do tohoto procesu je zapojena řada mechanismů, ale přesná povaha umlčování je stále nejasná.[13]
Exprimovaný VSG lze přepnout buď aktivací jiného expresního místa (a tím změnou vyjádřit VSG na tomto webu) nebo změnou VSG gen v aktivním místě na jinou variantu. Genom obsahuje mnoho kopií genů VSG, a to jak na minichromozomech, tak v opakovaných řezech uvnitř chromozomů. Tito jsou obecně tichí, obvykle s vynechanými sekcemi nebo předčasnými stop kodony, ale jsou důležití ve vývoji nových genů VSG. Odhaduje se, že až 10% T.brucei genom může být tvořen VSG geny nebo pseudogeny. Kterýkoli z těchto genů lze přesunout na aktivní web pomocí rekombinace pro vyjádření. Přesné mechanismy, které to řídí, jsou opět nejasné, ale zdá se, že tento proces spoléhá Oprava DNA stroje a proces homologní rekombinace.[14]
Expresní místo v krvi (BES) nebo telomerické expresní místo se používá k výměně variantních povrchových glykoproteinů, když jsou v krevním řečišti hostitele k úniku doplňkový systém. BES jsou polymorfní co do velikosti a struktury, ale v kontextu rozsáhlé rekombinace odhalují překvapivě konzervovanou architekturu. Velmi malé BES existují a mnoho fungujících BES neobsahuje úplnou řadu geny spojené s expresním místem (ESAG).[15] Existuje sbírka odhadem 20 - 30 webů, z nichž každý je aktivní najednou.[16] Aktivní VSG expresní weby jsou vyčerpány nukleosomy.[17]
Genové repertoáry v T. brucei se lišily, aby se staly specifické pro kmen.[18]
Varianty povrchových glykoproteinových genů T. brucei byly klasifikovány do dvou skupin v závislosti na tom, zda je pozorována duplikace genů, když jsou exprimovány.[19]

Sekretářské obchodování
Trypanosoma mají jednoduchý, polarizovaný membránový transportní systém skládající se z jednoho ER, lysozom, a Golgiho aparát.
VSG se nejprve přepíše jako polycistron a poté podstoupí specifické pro trypanosomatid polyadenylace a trans-sestřih režie polypyrimidinové trakty. Protože neexistuje žádná transkripční kontrola, VSG 3'UTR je důležitý pro svou stabilitu RNA (nejdůležitější je 8mer a 14mer). VSG je poté transkribován na membránově vázaný polysomy a vzhled N-koncové signální sekvence směruje VSG do ER. VSG je tak rychle translačně transportován do lumenu ER N-glykosylovaný (na stránkách asn-x-ser / thr) a GPI ukotven v místě ω a transaminace reakce (odstranění C-term hydrofobní 17 nebo 23 aa GPI kotvící sekvence). Místo ω je vždy Ser (obvykle v 17 peptidech signální sekvence aa), Asp (obvykle v 23 peptidech signální sekvenci) nebo Asn. Také počet N-glykosylace stránky na VSG se mohou lišit (obvykle 1-3 N-glykany). VSG MITat.1.5 je glykosylován na všech třech potenciálních N-glykosylačních místech.[20]
VSG pak podstoupí kalretikulin /kalnexin skládací cyklus (kalnexin chybí v Trypanosoma brucei), kde je přechodně monoglukosylovaný a deglukosylovaný a interaguje s různými ER chaperonovými proteiny, jako je BiP, aby se správně složil. VSG efektivně složí a dimerizuje (což naznačuje skutečně příznivé složení) a je transportován přes Golgi do bičíkové kapsy pro začlenění do buněčné membrány.
Důležité je, že po začlenění do buněčné membrány může být VSG později recyklován přes bičíkovou kapsu a tříděn zpět na povrch buňky. VSG se neobrací pomocí lysozomálních nebo proteazomálních kanonických degradačních cest,[21] ale místo toho se z buňky ztratí specifickým štěpením jeho GPI kotvy specifickým pro GPI PLC.
Struktura
Geny VSG jsou velmi variabilní sekvence (primární) úroveň, ale varianty se považují za silně konzervované strukturální (terciární) prvky založené na dvou určených trojrozměrných strukturách[22] a zachování dvojrozměrných sekvenčních motivů (sestupné a vzestupné alfa-šroubovice, které tvoří dimerizační rozhraní), což jim umožňuje provádět podobnou stínící funkci.[23] VSG jsou tvořeny N terminál doména kolem 300 - 350 aminokyseliny s nízkou sekvenční homologií (13-30% identita) a konzervativnější C terminál doména ~ 100 aminokyselin. N-koncové domény jsou seskupeny do tříd A-C v závislosti na jejich cysteinových vzorcích. Domény C-term jsou seskupeny sekvenční homologií do tříd I-III, bez zjevného omezení, s jakými třídami N-termů se mohou spárovat, aby vytvořily plnou VSG. Pro dimerizaci tvoří VSG N-koncové domény svazek čtyř alfa helixy řízeno hydrofobními interakcemi, kolem nichž visí menší strukturální prvky (pět menších šroubovic a tři beta-listy).
VSG je ukotven k buněčné membráně pomocí a glykofosfatidylinositol (GPI) kotva —Nekovalentní vazba z C-konce, která směruje její dopředné obchodování z ER na membránu. Tato GPI kotva je specificky štěpena GPI fosfolipázou C, štěpí VSG ve formě membrány a umožňuje, aby se VSG protein a část GPI kotvy ztratila v extracelulárním prostředí jako rozpustný VSG (sVSG, který lze rozpoznat jako zkříženou reakci Determinant nebo CRD), při zachování dvou 1,2-dimyristolglycerolových řetězců v membráně.
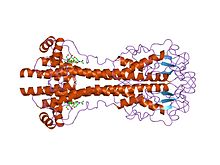
Antigenní variace
VSG je vysoce imunogenní a imunitní odpověď zvýšený proti konkrétnímu VSG plášti rychle zabije trypanosomy exprimující tuto variantu. Protilátka Lze také pozorovat zabíjení trypanosomů zprostředkované in vitro podle a zprostředkovaný doplňkem lýza test. S každým však buněčné dělení existuje možnost, že jeden nebo oba z nich potomstvo přepne výraz a změní VSG, který je vyjádřen. Frekvence přepínání VSG byla naměřena na přibližně 0,1% na divizi,[24] ačkoli míra přepínání se liší v kultuře vs. in vivo. Tak jako T. brucei populace může vyvrcholit velikostí 1011 v hostiteli[25] tato rychlá rychlost přepínání zajišťuje, že populace parazitů je neustále různorodá. Různorodá škála vrstev vyjádřených populací trypanosomu znamená, že imunitní systém je vždy o krok pozadu: trvá několik dní, než se imunitní reakce proti danému VSG vyvine, což dává populaci čas na diverzifikaci, protože jednotlivci procházejí dalšími změnami. Opakování tohoto procesu zabrání vyhynutí infikující populace trypanosomů, což umožní chronickou perzistenci parazitů v hostiteli a zvýší možnosti přenosu. Klinickým účinkem tohoto cyklu jsou postupné „vlny“ parazitémie (trypanosomy v krvi).[3]
V jiných trypanosomech
Variabilní povrchové glykoproteiny se nacházejí také v jiných Trypanosoma druh,
v Trypanosoma equiperdum, parazit způsobující krycí nemoc u koní, Tyto proteiny umožňují parazitovi účinně uniknout imunitnímu systému hostitelského zvířete.[26] Tyto VSG umožňují organismu neustále manipulovat a měnit povrchovou strukturu svých bílkovin, což znamená, že je neustále prezentováno imunitnímu systému jako nový cizí organismus, což brání tělu v nasazení dostatečně velké imunitní odpovědi na vymýcení nemoci.[26] V tomto smyslu, Trypanosoma equiperdum je velmi efektivní organismus; může infikovat méně druhů než jiné nemoci, ale infikuje a přežívá velmi efektivně ve stanovených hostitelích. VSG proteiny v T. equiperdum jsou také fosforylovaný.[27]
Gen VSG z Trypanosoma evansi, parazit, který způsobuje formu surra u zvířat, byl klonován Escherichia coli. Vyjádřený protein je imunoreaktivní se všemi kombinacemi sera. Zvířata imunizovaná lyzátem celých buněk nebo rekombinantním proteinem vykazují podobné protilátkové reakce u zvířat ELISA (Imunoanalýza vázaná na enzym) a CATT (karetní aglutinační test na trypanosomiázu ).[28] Variabilní povrchový glykoprotein RoTat 1.2 PCR lze použít jako specifický diagnostický nástroj pro detekci T. evansi infekce.[29]
Nejmenší VSG protein (velikost 40 kDa) k dnešnímu dni (1996) byl nalezen v Trypanosoma vivax, který nese málo sacharidů.[30]
v Trypanosoma congolense, in vitro analýzy zabudovaných cukrů po hydrolýze glykoproteinu to ukázaly glukosamin a manóza se používají v biosyntéze uhlohydrátové skupiny přímo, zatímco galaktóza se před začleněním do antigenu případně přeměnila na jiné meziprodukty. Neglykosylovaný VSG s molekulovou hmotností 47 kDa zcela ztratil svou heterogenitu velikosti.[31]
Viz také
- Krycí protein (disambiguation)
- Glykokalyx
- Seznam kódů MeSH (D23)
- Seznam kódů MeSH (D12.776.395)
- Seznam kódů MeSH (D12.776.543)
- Amastin, další povrchový (transmembránový) glykoprotein u parazitů trypanosomatidů[32]
Reference
- ^ Cross GA (1975). "Identifikace, čištění a vlastnosti klonově specifických glykoproteinových antigenů tvořících povrchovou vrstvu Trypanosoma brucei". Parazitologie. 71 (3): 393–417. doi:10.1017 / s003118200004717x. PMID 645.
- ^ Buck GA, Jacquemot C, Baltz T, Eisen H (prosinec 1984). "Re-exprese inaktivovaného genu pro variabilní povrchový glykoprotein v Trypanosoma equiperdum". Gen. 32 (3): 329–36. doi:10.1016/0378-1119(84)90008-8. PMID 6530143.
- ^ A b Barry JD, McCulloch R (2001). Antigenní variace v trypanosomech: zvýšená fenotypová variace u eukaryotických parazitů. Pokroky v parazitologii. 49. s. 1–70. doi:10.1016 / S0065-308X (01) 49037-3. ISBN 978-0-12-031749-3. PMID 11461029.
- ^ Overath P, Chaudhri M, Steverding D, Ziegelbauer K (únor 1994). "Invariantní povrchové proteiny ve formách Trypanosoma brucei v krevním řečišti". Parazitologie dnes. 10 (2): 53–8. doi:10.1016 / 0169-4758 (94) 90393-X. PMID 15275499.
- ^ Ross R, Thomson D (červen 1910). „Případ spánkové nemoci s pravidelným periodickým nárůstem počtu parazitů. British Medical Journal. 1 (2582): 1544–5. doi:10.1136 / bmj.1.2582.1544. PMC 2331906. PMID 20765166.
- ^ Rudenko G (2011-10-24). „Africké trypanosomy: genom a adaptace pro imunitní únik“. Eseje v biochemii. 51: 47–62. doi:10.1042 / bse0510047. PMID 22023441.
- ^ Chyť DJ, Verjee Y. "Lokalizace variabilního povrchu glykoproteinu fosfatidylinositol-specifické fosfolipázy-C v Trypanosoma brucei brucei". Úschovna firemních dokumentů FAO. Organizace pro výživu a zemědělství OSN.
- ^ Triggs VP, Bangs JD (únor 2003). „Glykosylfosfatidylinositol-závislý obchod s bílkovinami ve stadiu krevního oběhu Trypanosoma brucei“. Eukaryotická buňka. 2 (1): 76–83. doi:10.1128 / ec.2.1.76-83.2003. PMC 141176. PMID 12582124.
- ^ Schwartz KJ, Peck RF, Tazeh NN, Bangs JD (prosinec 2005). „Valence GPI a osud sekrečních membránových proteinů v afrických trypanosomech“. Journal of Cell Science. 118 (Pt 23): 5499–511. doi:10.1242 / jcs.02667. PMID 16291721.
- ^ Pays E, Coquelet H, Pays A, Tebabi P, Steinert M (září 1989). „Trypanosoma brucei: posttranskripční kontrola expresního místa genu pro variabilní povrchový glykoprotein“. Molekulární a buněčná biologie. 9 (9): 4018–21. doi:10,1128 / mcb.9.9.4018. PMC 362464. PMID 2779574.
- ^ Marcello L, Barry JD (září 2007). „Analýza tichého archivu genu VSG v Trypanosoma brucei odhaluje, že exprese genu mozaiky je prominentní v antigenní variaci a je upřednostňována archivní substrukturou“. Výzkum genomu. 17 (9): 1344–52. doi:10,1101 / gr. 6421207. PMC 1950903. PMID 17652423.
- ^ Barbour AG, Restrepo BI (2000). „Antigenní variace ve vektorech přenášených patogenech“. Vznikající infekční nemoci. 6 (5): 449–57. doi:10,3201 / eid0605,000502. PMC 2627965. PMID 10998374.
- ^ Platí E (listopad 2005). "Regulace genové exprese antigenu v Trypanosoma brucei". Trendy v parazitologii. 21 (11): 517–20. doi:10.1016 / j.pt.2005.08.016. PMID 16126458.
- ^ Morrison LJ, Marcello L, McCulloch R (prosinec 2009). „Antigenní variace v africkém trypanosomu: molekulární mechanismy a fenotypová složitost“ (PDF). Buněčná mikrobiologie. 11 (12): 1724–34. doi:10.1111 / j.1462-5822.2009.01383.x. PMID 19751359.
- ^ Hertz-Fowler C, Figueiredo LM, Quail MA, Becker M, Jackson A, Bason N, Brooks K, Churcher C, Fahkro S, Goodhead I, Heath P, Kartvelishvili M, Mungall K, Harris D, Hauser H, Sanders M, Saunders D, Seeger K, Sharp S, Taylor JE, Walker D, White B, Young R, Cross GA, Rudenko G, Barry JD, Louis EJ, Berriman M (2008). „Telomerní expresní místa jsou u Trypanosoma brucei vysoce konzervovaná“. PLOS One. 3 (10): e3527. Bibcode:2008PLoSO ... 3.3527H. doi:10,1371 / journal.pone.0003527. PMC 2567434. PMID 18953401.
- ^ Vanhamme L, Lecordier L, Pays E (květen 2001). "Kontrola a funkce variantních povrchových glykoproteinových expresních míst v krevním řečišti v Trypanosoma brucei". International Journal for Parasitology. 31 (5–6): 523–31. doi:10.1016 / S0020-7519 (01) 00143-6. PMID 11334937.
- ^ Stanne TM, Rudenko G (leden 2010). „Aktivní místa pro expresi VSG v Trypanosoma brucei jsou ochuzena o nukleosomy“. Eukaryotická buňka. 9 (1): 136–47. doi:10.1128 / EC.00281-09. PMC 2805301. PMID 19915073.
- ^ Hutchinson OC, Picozzi K, Jones NG, Mott H, Sharma R, Welburn SC, Carrington M (červenec 2007). „Varianty povrchových glykoproteinových genových repertoárů v Trypanosoma brucei se lišily, aby se staly specifické pro kmen“. BMC Genomics. 8: 234. doi:10.1186/1471-2164-8-234. PMC 1934917. PMID 17629915.
- ^ Young JR, Turner MJ, Williams RO (1984). „Role duplikace při expresi genu pro variabilní povrchový glykoprotein Trypanosoma brucei“. Journal of Cellular Biochemistry. 24 (3): 287–95. doi:10.1002 / jcb.240240309. PMID 6736139.
- ^ Mehlert A, Bond CS, Ferguson MA (říjen 2002). „Glykoformy variantního povrchového glykoproteinu Trypanosoma brucei a molekulární modelování glykosylovaného povrchového povlaku“. Glykobiologie. 12 (10): 607–12. doi:10.1093 / glycob / cwf079. PMID 12244073.
- ^ Tiengwe C, Muratore KA, Bangs JD (listopad 2016). "Povrchové proteiny, ERAD a antigenní variace v Trypanosoma brucei". Buněčná mikrobiologie. 18 (11): 1673–1688. doi:10.1111 / cmi.12605. PMC 5575760. PMID 27110662.
- ^ Freymann D, Down J, Carrington M, Roditi I, Turner M, Wiley D (1990). „2,9 Á rozlišovací struktura N-terminální domény variantního povrchového glykoproteinu z Trypanosoma brucei“. Journal of Molecular Biology. 216 (1): 141–60. doi:10.1016 / S0022-2836 (05) 80066-X. PMID 2231728.
- ^ Blum ML, Down JA, Gurnett AM, Carrington M, Turner MJ, Wiley DC (duben 1993). "Strukturální motiv ve variantních povrchových glykoproteinech Trypanosoma brucei". Příroda. 362 (6421): 603–9. Bibcode:1993Natur.362..603B. doi:10.1038 / 362603a0. PMID 8464512.
- ^ Turner CM (srpen 1997). "Míra antigenních variací u infekcí Trypanosoma brucei přenášených mouchami a injekčními stříkačkami". Mikrobiologické dopisy FEMS. 153 (1): 227–31. doi:10.1111 / j.1574-6968.1997.tb10486.x. PMID 9252591.
- ^ Barry JD, Hall JP, Plenderleith L (září 2012). „Hyperevoluce genomu a úspěch parazita“. Annals of the New York Academy of Sciences. 1267 (1): 11–7. Bibcode:2012NYASA1267 ... 11B. doi:10.1111 / j.1749-6632.2012.06654.x. PMC 3467770. PMID 22954210.
- ^ A b Raibaud A, Gaillard C, Longacre S, Hibner U, Buck G, Bernardi G, Eisen H (červenec 1983). "Genomické prostředí variantních genů povrchového antigenu Trypanosoma equiperdum". Sborník Národní akademie věd Spojených států amerických. 80 (14): 4306–10. Bibcode:1983PNAS ... 80.4306R. doi:10.1073 / pnas.80.14.4306. PMC 384026. PMID 6308614.
- ^ Baltz T, Giroud C, Baltz D, Duvillier G, Degand P, Demaille J, Pautrizel R (1982). „Variabilní povrchové glykoproteiny Trypanosoma equiperdum jsou fosforylované“. Časopis EMBO. 1 (11): 1393–8. doi:10.1002 / j.1460-2075.1982.tb01328.x. PMC 553222. PMID 6821334.
- ^ Sengupta PP, Balumahendiran M, Balamurugan V, Rudramurthy GR, Prabhudas K (červen 2012). „Exprimovaný zkrácený N-koncový variabilní povrchový glykoprotein (VSG) Trypanosoma evansi v E. coli vykazuje imunoreaktivitu.“ Veterinární parazitologie. 187 (1–2): 1–8. doi:10.1016 / j.vetpar.2012.01.012. PMID 22277627.
- ^ Claes F, Radwanska M, Urakawa T, Majiwa PA, Goddeeris B, Büscher P (září 2004). „Variabilní povrchový glykoprotein RoTat 1.2 PCR jako specifický diagnostický nástroj pro detekci infekcí Trypanosoma evansi“. Kinetoplastidová biologie a nemoci. 3 (1): 3. doi:10.1186/1475-9292-3-3. PMC 521498. PMID 15377385.
- ^ Gardiner PR, Nene V, Barry MM, Thatthi R, Burleigh B, Clarke MW (listopad 1996). "Charakterizace malého variabilního povrchového glykoproteinu z Trypanosoma vivax". Molekulární a biochemická parazitologie. 82 (1): 1–11. doi:10.1016/0166-6851(96)02687-4. PMID 8943146.
- ^ Reinwald E, Heidrich C, Risse HJ (květen 1984). „In vitro studie o biosyntéze povrchového glykoproteinu Trypanosoma congolense“. The Journal of Protozoology. 31 (2): 300–6. doi:10.1111 / j.1550-7408.1984.tb02966.x. PMID 6470988.
- ^ Jackson AP (leden 2010). „Vývoj povrchových glykoproteinů amastinu u parazitů trypanosomatidů“. Molekulární biologie a evoluce. 27 (1): 33–45. doi:10,1093 / molbev / msp214. PMC 2794310. PMID 19748930.
externí odkazy
- Varianty povrchových glykoproteinů, Trypanosoma v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- www.icp.ucl.ac.be
