Redukční dehalogenace halo ketonů - Reductive dehalogenation of halo ketones
v organická chemie, α-halogenketony může být snížena se ztrátou halogen atom k vytvoření enoláty. A-Halogenketony se snadno připravují z ketony různými halogenace ketonu reakce a produkty jsou reaktivní meziprodukty které lze použít pro řadu dalších chemické reakce.
Úvod
Redukce a-halogenketonů generuje řadu produktových struktur, které mohou vykazovat jedinečné substituční vzorce a reaktivitu. Například redukce α, α'-dihalogenketonů vede ke komplexům 2-oxyallylových kovů, které se účastní [4 + 3] a [3 + 2] cykloadice reakce jako 2π složka.[1] Meziprodukty 2-oxyallylového kovu mohou také zachytávat nukleofily v procesu, který zahrnuje umpolung na uhlíku α.[2] Kromě toho, protože redukce monohaloketonů produkuje enoláty místně specifickým způsobem, reakce spojené s enoláty (alkylace, aldol, Michaele ) lze provádět za použití halogenketonových substrátů za redukčních podmínek.
(1)
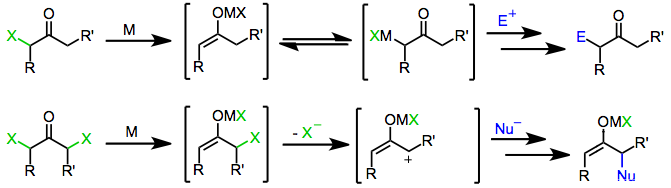
Mechanismus
Mnoho redukčních činidel používaných při tomto typu reakce je komerčně dostupných. Některé vyžadují přípravu a okamžité použití, včetně pár zinek-měď a páry zinek / stříbro.[3][4] a organokupráty[5]
Monohaloketony
Monohalogenonové ketony jsou redukovány jak jednoelektronovými, tak dvouelektronovými redukčními činidly za vzniku původních ketonů, derivátů funkcionalizovaných elektrofily nebo produktů dimerizace. Mechanismus samotné redukce závisí na povaze redukčního činidla.
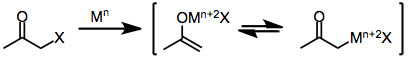
Jednoelektronová redukční činidla, jako např d6 nebo d1 komplexy přechodných kovů, původně darovat jeden elektron k halo ketonu. Fragmentace výsledného radikální anion výtěžek anorganického radikálu a halogenidu. Darování druhého elektronu z a druhý ekvivalent redukčního činidla vede k tvorbě kovového enolátu, ve kterém oxidační stav redukčního činidla se zvýšilo o jednu.[6]
(2)

Činidla redukující dva elektrony, z nichž nejvýznamnější je zinek kov, podstoupit přímo oxidační přísada na monohaloketony za vzniku kovových enolátů, ve kterých se oxidační stav kovu zvýšil o dva. Následující nepřiměřenost s nezreagovaným halogenketonem někdy vede k tvorbě dvou ekvivalentů enolového radikálu, který může následně dimerizovat.[7]
(3)
Ošetření enolátů odvozených buď od jedno- nebo dvouelektronových redukčních činidel elektrofilem poskytuje jako funkční produkt ketony s funkční skupinou a.
α, α-dihaloketony
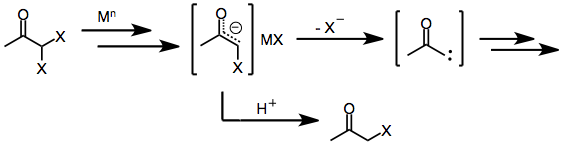
Podobně jako monohaloketony geminal dihalogenketony zpočátku tvoří kovové enoláty po vystavení činidlům redukujícím jeden nebo dva elektrony. V přítomnosti a protické rozpouštědlo redukce se v této fázi zastaví, čímž se získá monohalogenketon (který může být dále redukován na původní keton).[8] Avšak v nepřítomnosti zachycujícího elektrofilního nebo protického rozpouštědla poskytuje ztráta zbývajícího halogenidu z enolátového meziproduktu a-keto karbeny nebo karbenoidy, které procházejí inzercemi CH.[9]
(4)
α, α'-dihaloketony
Počáteční redukce α, α'-dihalogenketonů vede k meziproduktům enolátu kovů. Ztráta zbývajícího halogenidu generuje komplexy 2-oxyallylových kovů, které podstupují [4 + 3] a [3 + 2] cykloadiční reakce v přítomnosti dienes nebo olefiny.[1] Izomerace komplexů 2-oxyallylových kovů s cyklopropanon a oxid hlinitý formy jsou rychlé a reverzibilní; zvýšení kovalentní znak vazby kyslík-kov upřednostňuje 2-oxyallyl izomer.[10]
(5)

Rozsah a omezení
Redukce a-haloketonů mohou poskytnout původní ketony, částečně redukované haloketony nebo produkty vznikající zachycením meziproduktů podél redukční dráhy s nukleofily nebo elektrofily. Získané produkty závisí jak na redukčním činidle, tak na substitučním vzoru halogenketonu.
Monohaloketony
Monohaloketony mohou být redukovány na odpovídající výchozí keton s lithium kov, následovaný protonace enolátu.[11] Další užitečná redukční činidla pro tuto transformaci zahrnují lithium dialkylcupraty[12] a hexakarbonyl-oxid hlinitý molybdenu.[13]
(6)

Alkylace enolátů generovaných redukcí monohaloketonů je omezena na nejreaktivnější alkylhalogenidy.[14] Snížení přítomnosti aldehydu však vede k redukčním aldolovým produktům, analogickým k Reformatského reakce haloesterů. Zinkový prach lze použít samostatně; nebo jako amalgám, v kombinaci s diethylaluminiumchlorid, nebo s katalytické částky bromid měďnatý.[15]
(7)
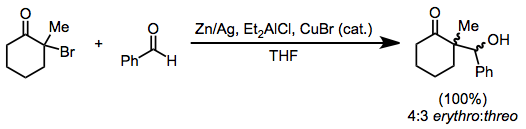
Redukční dimerizace může být výsledkem kombinace dvou meziproduktů a-acylových radikálů nebo nukleofilního napadení kovového enolátu na nezreagovaném halogenketonu. Ačkoli často vznikají složité reakční směsi,[6] v některých případech je možná selektivní dimerizace. V níže uvedeném příkladu je distribuce produktu závislá na rozpouštědle[16]
(8)

α, α-dihaloketony
V závislosti na použitých podmínkách mohou být geminální dihalogenketony redukovány na mateřský keton, monohaloketon nebo funkcionalizovaný monohalogenketon s organokupráty.[17] Oteplování funkcionalizovaných α-halogenketonů produkovaných za těchto podmínek od -40 ° C do teploty místnosti vede k odpovídajícímu α, β-nenasycenému ketonu.
(9)

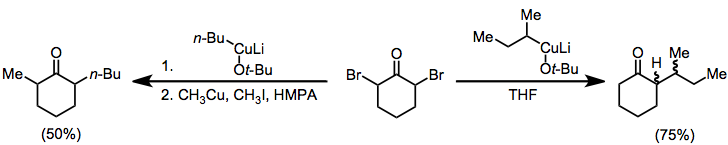
α, α'-dihaloketony
Pro redukci a, a'-dihalogenketonů na alkylované ketony mohou být také použity organokupráty. V nepřítomnosti elektrofilu je monoalkylketon izolován v dobrém výtěžku;[18] když se přidá alkyljodid, dialkylketon se izoluje (geminální alkylace je problematická vedlejší reakce).[19]
(10)
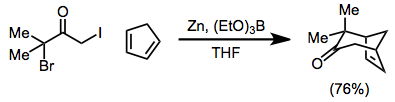
2-oxyallylové kovové meziprodukty generované během redukcí a, a'-dihalogenketonů s komplexy železa (0) se účastní [4 + 3] a [3 + 2] cykloadičních reakcí za vzniku cykloheptenonů a cyklopentanonů. Během [3 + 2] cykloadičních reakcí byl substituent na alken může eliminovat a poskytovat cyklopentenony z alkenů v jednom hrnci.[20]
(11)

Rozsah [4 + 3] cykloadice je široký[1]—Reakce může být použita k vytvoření cykloheptenonů, stejně jako přemostěna[21] nebo kondenzované[22] polycyklické výrobky. Redukci lze provést za přítomnosti 4π složky[23]
(12)
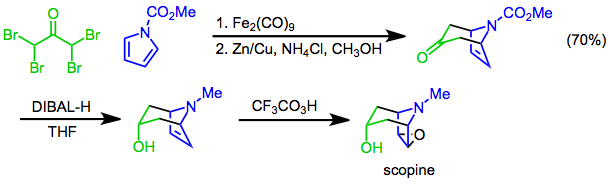
Syntetické aplikace
[4 + 3] cykloadice z pyrroly mohou být použity k vytvoření bicyklické kostry tropanové alkaloidy. Například syntéza skopina používá cykloadici [4 + 3] N-methoxykarbonylpyrol a a, α, α ', α'-tetrabromaceton jako klíčový krok. Diastereoselektivní redukce s diisobutylaluminium hydrid (DIBAL-H) následovaný epoxidace s kyselina trifluoroperoctová[24] poskytuje cíl.
(13)
Reference
- ^ A b C Rigby, J .; Pigge, C. Org. Reagovat. 1997, 51, 351.
- ^ Fry, J.; O'Dea, J. J. Org. Chem. 1975, 40, 3625.
- ^ LeGoff, E. J. Org. Chem. 1964, 29, 2048.
- ^ Denis, M.; Girard, C.; Conia, M. Syntéza, 1972, 549.
- ^ Ho, L.; Olah, A. Syntéza, 1976, 807.
- ^ A b Alper, H .; Keung, E. C. H J. Org. Chem. 1972, 37, 2566.
- ^ Ghera, E.; Perry, H.; Shoua, S. J. Chem. Soc., Chem. Commun., 1973, 858.
- ^ Greene, A.E .; Deprés, J.-P J. Am. Chem. Soc. 1979, 101, 4003.
- ^ Scott, T.; Bavlna, D J. Am. Chem. Soc. 1973, 95, 2708.
- ^ Bingham, C.; Dewar, S.; Lo, H J. Am. Chem. Soc. 1975, 97, 1302.
- ^ Dubois, J.-E .; Fournier, P .; Lion, C. C. R. Acad. Sci., Ser. C 1974, 279, 965 (1974).
- ^ Bull, J. R.; Tuinman, A. Tetrahedron Lett. 1973, 4349.
- ^ Alper H .; Pattee, L. J. Org. Chem. 1979, 44, 2568.
- ^ Dubois, E.; Fournier, P.; Lion, C. C. R. Acad. Sci., Ser. C 1974, 279, 965.
- ^ Maruoka, K.; Hashimoto, S.; Kitagawa, Y.; Yamamoto, H.; Nozaki, H J. Am. Chem. Soc. 1977, 99, 7705.
- ^ Yoshisato, E.; Tsutsumi, S J. Am. Chem. Soc. 1968, 90, 4488.
- ^ Deprés, J.-P .; Greene, A. E. J. Org. Chem. 1980, 45, 2036.
- ^ Posner, H.; Sterling, J. J. Am. Chem. Soc. 1973, 95, 3076.
- ^ Posner, H.; Sterling, J.; Whitten, E.; Lentz, M.; Brunelle, J J. Am. Chem. Soc. 1975, 97, 107.
- ^ Hayakawa, Y .; Yokoyama, K .; Noyori, R. J. Am. Chem. Soc. 1978, 100, 1799.
- ^ Noyori, R .; Nishizawa, M .; Shimizu, F .; Hayakawa, Y .; Maruoka, K .; Hashimoto, S .; Yamamoto, H .; Nozaki, H J. Am. Chem. Soc. 1979, 101, 220.
- ^ Hayakawa, Y.; Yokoyama, K.; Noyori, R. J. Am. Chem. Soc. 1978, 100, 1799.
- ^ Hoffmann, R.; Iqbal, N. Tetrahedron Lett., 1975, 4487.
- ^ Hayakawa, Y .; Baba, Y .; Makino, S .; Noyori, R. J. Am. Chem. Soc. 1978, 100, 1786.
