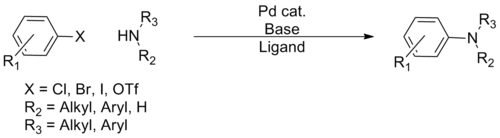Buchwald-Hartwigova aminace - Buchwald–Hartwig amination
tento článek příliš spoléhá na Reference na primární zdroje. (Srpna 2016) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
| Buchwald-Hartwigova aminace | |
|---|---|
| Pojmenoval podle | Stephen L. Buchwald John F. Hartwig |
| Typ reakce | Vazební reakce |
| Identifikátory | |
| Portál organické chemie | buchwald-hartwigova reakce |
| RSC ontologické ID | RXNO: 0000192 |
The Aminace Buchwald-Hartwig je chemická reakce použito v organická chemie pro syntézu vazby uhlík-dusík přes palladiem katalyzované kopulační reakce aminů s arylhalogenidy.[1] Ačkoli spojky C-N katalyzované Pd byly hlášeny již v roce 1983, Stephen L. Buchwald a John F. Hartwig byli připsáni, jejichž publikace mezi 1994 a pozdním 2000s stanovily rozsah transformace. Syntetická užitečnost reakce vychází primárně z nedostatků typických metod (nukleofilní substituce, redukční aminace atd.) pro syntézu aromatických vazeb C – N, přičemž většina metod trpí omezeným rozsahem substrátu a tolerancí funkční skupiny.[2] Vývoj Buchwald-Hartwigovy reakce umožnil snadnou syntézu arylaminů a do jisté míry nahradil tvrdší metody ( Goldbergova reakce, nukleofilní aromatická substituce atd.), přičemž významně rozšiřuje repertoár možné tvorby vazeb C – N.[Citace je zapotřebí ]
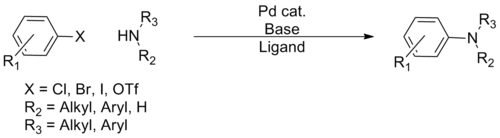
(Rovnice 1)
V průběhu svého vývoje bylo vyvinuto několik „generací“ katalytických systémů, přičemž každý systém umožňoval větší rozsah, pokud jde o vazebné partnery a mírnější podmínky, což umožnilo spojení prakticky jakéhokoli aminu s širokou paletou arylových vazebných partnerů.[Citace je zapotřebí ] Kvůli všudypřítomnosti arylových C-N vazeb ve farmaceutických a přírodní produkty, reakce získala široké použití v syntetické organické chemii, s aplikací v mnoha celkové syntézy a průmyslová příprava mnoha farmaceutik.
Dějiny
První příklad křížové vazebné reakce katalyzované C-N palladiem publikoval v roce 1983 Migita a spolupracovníci a popsal reakci mezi několika arylbromidy a N, N-diethylaminotributylemcín za použití 1 mol% PdCl2[P (o-tolyl)3]2. Ačkoli bylo testováno několik arylbromidů, pouze elektronicky neutrální, stericky nezatížený substráty poskytovaly dobré až vynikající výtěžky.[3]

(Rovnice 2)
V roce 1984 Dale L. Boger a James S.Panek uvedli příklad tvorby C-N vazby zprostředkované Pd (0) v rámci své práce na syntéze lavendamycinu, která využívala stechiometrickou Pd (PPh3)4. Pokusy učinit reakci katalytickou byly neúspěšné.[4]

(Rovnice 3)
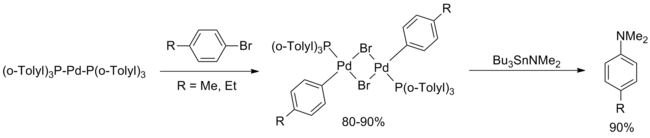
Tyto zprávy byly po desetiletí prakticky necitované. V únoru 1994 uvedla Hartwig systematickou studii sloučenin palladia obsažených v původním dokumentu Migita a dospěla k závěru, že d10 komplex Pd [P (o-tolyl)3]2 byl aktivním katalyzátorem. Navrhován byl katalytický cyklus zahrnující oxidační přísada arylbromidu.[5]
(Rovnice 4)
V květnu 1994 publikoval Buchwald rozšíření příspěvku Migita, které oproti původnímu příspěvku nabízí dvě hlavní vylepšení. První, transaminace Bu3SnNEt2 následován argon očistit, aby se odstranila těkavá látka diethylamin povoleno rozšíření metodiky na různé sekundární aminy (cyklické i acyklické) a primární aniliny. Zadruhé, výtěžek pro areny bohaté na elektrony a na elektrony chudé byl vylepšen drobnými úpravami reakčního postupu (vyšší zatížení katalyzátorem, vyšší teplota, delší reakční doba), i když ne ortho -substituované arylové skupiny byly zahrnuty do této publikace.[6]

(Rovnice 5)
V roce 1995 zpětné studie z každé laboratoře ukázaly, že spojky lze provádět s volnými aminy za přítomnosti objemného základna (NaOtBu v publikaci Buchwald, LiHMDS v publikaci Hartwig), což umožňuje organický cín - volná spojka. Ačkoli tyto zlepšené podmínky probíhaly rychleji, rozsah substrátu byl kvůli konkurenci téměř úplně omezen na sekundární aminy hydrodehalogenace bromoarenů.[7][8] (Vidět Mechanismus níže)

(Rovnice 6)
Tyto výsledky založily takzvanou „první generaci“ katalyzátorových systémů Buchwald – Hartwig. V následujících letech došlo k vývoji sofistikovanějších fosfin ligandy což umožnilo rozšíření na větší škálu aminů a arylových skupin. Aryl jodidy, chloridy, a triflates se nakonec staly vhodnými substráty a byly vyvinuty reakce probíhající se slabšími bázemi při teplotě místnosti. Tyto zálohy jsou podrobně uvedeny v dokumentu Rozsah níže a rozšíření na složitější systémy zůstává aktivní oblastí výzkumu.
Mechanismus
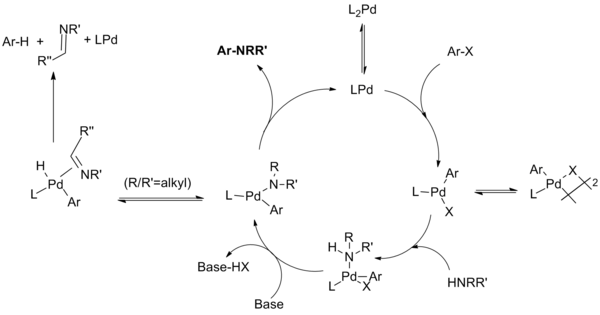
The mechanismus reakce protože bylo prokázáno, že tato reakce probíhá v krocích podobných těm, které jsou známé pro palladiem katalyzované C-C vazebné reakce. Kroky zahrnují oxidativní přidání arylhalogenidu na druh Pd (0), přidání aminu do oxidačního adičního komplexu, deprotonaci následovanou redukční eliminace. Neproduktivní vedlejší reakce může soutěžit s redukční eliminací, kdy amid prochází eliminací beta hydridu za vzniku hydrodehalogenovaného arenu a já těžím produkt.[9]
Během vývoje reakce se skupina snažila identifikovat reakční meziprodukty pomocí základních mechanistických studií. Tyto studie odhalily odlišné reakční dráhy v závislosti na tom, zda monodentate nebo chelátování Při reakci se používají fosfinové ligandy a byla odhalena řada jemných vlivů (zejména pokud jde o dialkylbiaryl fosfinové ligandy vyvinutý Buchwaldem).
Katalytický cyklus probíhá následovně:[10][11][12][13]
(Rovnice 7)
U monodentátních ligandových systémů se předpokládá, že druh monofosfin palladia (0) tvoří druh palladia (II), který je v rovnováha s μ-halogenovým dimerem. Stabilita tohoto dimeru klesá v řádu X = I> Br> Cl a předpokládá se, že je zodpovědný za pomalou reakci aryljodidů s katalyzátorovým systémem první generace. Aminová ligace následovaná deprotonací bází produkuje amid palladia. (Ukázalo se, že chelatační systémy procházejí těmito dvěma kroky v opačném pořadí, přičemž tvorba amidu předchází komplexaci báze.) Tento klíčový meziprodukt redukčně redukuje produkci produktu a regeneraci katalyzátoru. Může však dojít k vedlejší reakci, při které eliminace β-hydridu následovaná redukční eliminací vytvoří hydrodehalogenovaný aren a odpovídající imin. Neznázorněny jsou další rovnováhy, kde se různé meziprodukty koordinují s dalšími fosfinovými ligandy v různých stádiích katalytického cyklu.
U chelatujících ligandů se netvoří monofosfinpalladiové druhy; oxidativní adice, tvorba amidů a redukční eliminace probíhají z L2Pd komplexy. Hartwigova skupina zjistila, že „k redukční eliminaci může dojít buď ze čtyř-souřadnicového bisfosfinu, nebo ze tří-souřadnicového monofosfinového arylpalladia amido komplexu. Eliminace ze tří souřadnicových sloučenin je rychlejší. K eliminaci β-vodíku proto dochází pomalu z arylpalladiových komplexů obsahujících chelatující fosfiny, zatímco u těchto čtyř souřadnicových druhů může stále docházet k redukční eliminaci. “[14]
aplikace
Kvůli všudypřítomnosti arylových C-N vazeb ve farmaceutických a přírodní produkty, reakce získala široké použití v syntetické organické chemii, s aplikací v mnoha celkové syntézy a průmyslová příprava mnoha farmaceutik.[22]Průmyslové aplikace zahrnují a-arylaci karbonylových sloučenin (jako jsou ketony, estery, amidy, aldehydy) a nitrilů.[23]
Rozsah
Ačkoli rozsah aminace Buchwald-Hartwig byl rozšířen tak, aby zahrnoval širokou škálu arylových a aminových vazebných partnerů, podmínky požadované pro konkrétní reaktanty jsou stále do značné míry závislé na substrátu. Byly vyvinuty různé systémy ligandů, každý s různými schopnostmi a omezeními a výběr podmínek vyžaduje zvážení sterických a elektronických vlastností obou partnerů. Níže jsou podrobně uvedeny substráty a podmínky pro hlavní generace ligandových systémů. (Zde nejsou zahrnuty N-heterocyklický karben ligandy a ligandy se širokým úhly skusu jako Xantphos a Spanphos které také byly značně vyvinuty.)[9]
Katalyzátorový systém první generace
První generace (Pd [P (o-Tolyl)3]2) bylo zjištěno, že katalytický systém je účinný pro kondenzaci jak cyklických, tak acyklických sekundárních aminů nesoucích alkylovou i arylovou funkční skupinu (i když ne diarylaminy) s řadou arylbromidů. Obecně tyto podmínky nebyly schopny spojit primární aminy kvůli kompetitivní hydrodehalogenaci arenu.[7][8]
Bylo zjištěno, že aryljodidy jsou vhodnými substráty pro intramolekulární varianta této reakce,[8] a co je důležité, lze je spojit mezimolekulárně pouze v případě, že místo toluenu jako rozpouštědla byl použit dioxan, i když se skromnými výtěžky.[24]

Bidentátní fosfinové ligandy
Vývoj difenylfosfinobinaftyl (BINAP) a difenylfosfinoferrocen (DPPF) jako ligandy pro aminaci Buchwald-Hartwig poskytly první spolehlivé rozšíření primárních aminů a umožnily účinnou vazbu aryljodidů a triflátů. (Předpokládá se, že bidentátní ligandy zabraňují tvorbě dimeru jodidu palladia po oxidačním přidání, což urychluje reakci.) Tyto ligandy obvykle produkují spojené produkty vyšší rychlostí a lepšími výtěžky než katalyzátory první generace. Počáteční zprávy o těchto ligandech jako katalyzátorech byly poněkud neočekávané vzhledem k mechanickým důkazům, že monoligované komplexy slouží jako aktivní katalyzátory v systému první generace. Ve skutečnosti byly první příklady z obou laboratoří publikovány ve stejném čísle JACS.[25][26][27]

(Rovnice 8)
The chelace Předpokládá se, že z těchto ligandů potlačuje eliminaci β-hydridu zabráněním otevřeného místa koordinace. Ve skutečnosti bylo zjištěno, že a-chirální aminy při použití chelatujících ligandů nerememizují, na rozdíl od katalyzátorového systému první generace.[28]

(Rovnice 9)
Stericky bráněné ligandy
Ukázalo se, že objemné tri- a di-alkylfosfinové ligandy jsou pozoruhodně aktivní katalyzátory, které umožňují kondenzaci širokého spektra aminů (primárních, sekundárních, elektrony odloučených, heterocyklických atd.) S arylchloridy, bromidy, jodidy a trifláty . Kromě toho se používají reakce hydroxid, uhličitan, a fosfát místo tradičních alkoxidových a silylamidových bází byly vyvinuty báze. Skupina Buchwald vyvinula širokou škálu dialkylbiaryl fosfinové ligandy, zatímco skupina Hartwig se zaměřila na ferrocen -odvozené a trialkylfosfinové ligandy.[29][30][31][32][33][34]

(Rovnice 10)
Dramatické zvýšení aktivity pozorované u těchto ligandů je přičítáno jejich sklonu ke stérickému upřednostňování monoligovaných druhů palladia ve všech fázích katalytického cyklu, což dramaticky zvyšuje rychlost oxidačního přidávání, tvorby amidů a redukční eliminace. Zdá se, že některé z těchto ligandů zvyšují rychlost redukční eliminace ve srovnání s eliminací β-hydridu prostřednictvím interakce arenu a palladia, která daruje elektrony.[19][20]
Za těchto podmínek lze spojit i aminy a heterocyklické substráty s odběrem elektronů, a to navzdory jejich tendenci deaktivovat palladiový katalyzátor.[35][36]

(Rovnice 11)
Ekvivalenty amoniaku
Amoniak zůstává jedním z nejnáročnějších vazebných partnerů pro aminační reakce Buchwald-Hartwig, což je problém přičítaný jeho těsné vazbě na komplexy palladia. Bylo vyvinuto několik strategií, jak to překonat, na základě činidel, která slouží jako ekvivalenty amoniaku. Použití a benzofenon imin nebo silylamid může překonat toto omezení s následnou hydrolýzou, která poskytne primární anilin.[37][38][39]
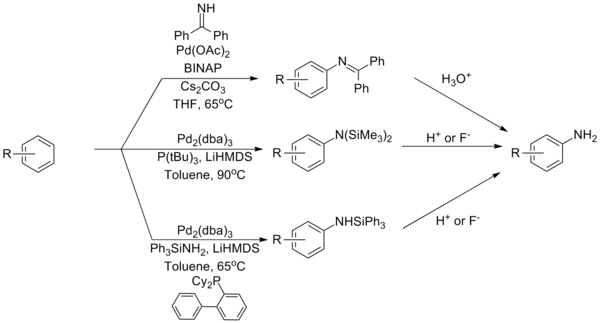
(Rovnice 12)
Katalyzátorový systém, který může přímo spojovat amoniak pomocí ligandu typu Josiphos.[40]
Varianty spojek C-N: spojky C-O, C-S a C-C
Za podobných podmínek jako při aminaci alkoholy a může být spojen s arylhalogenidy za vzniku odpovídajícího arylu ethery. To slouží jako pohodlná náhrada za drsnější analogy tohoto procesu, jako je Ullmannova kondenzace.[41][42]

(Rovnice 13)
Thioly a thiofenoly mohou být kondenzovány s arylhalogenidy za podmínek typu Buchwald-Hartwig za vzniku odpovídajících arylthioetherů. Kromě toho byly jako H použity merkaptoestery2S-ekvivalenty za účelem přípravy thiofenolu z odpovídajícího arylhalogenidu.[43]
Enoláty a další podobné uhlíkové nukleofily lze také spojit za vzniku a-arylketonů, malonátů, nitrilů atd. Rozsah této transformace je podobně závislý na ligandu a byla vyvinuta řada systémů.[44] Pro tento proces bylo vyvinuto několik enantioselektivních metod.[45][46]

(Rovnice 14)
Několik verzí reakce využívající komplexy měď a nikl spíše než palladium byly také vyvinuty.[18]
Reference
- ^ Forero-Cortés, Paola A .; Haydl, Alexander M. (2. července 2019). „25. výročí Aminace Buchwald – Hartwig: vývoj, aplikace a výhled“. Výzkum a vývoj organických procesů. 23 (8): 1478–1483. doi:10.1021 / acs.oprd.9b00161.
- ^ Weygand, Conrad (1972). Hilgetag, G .; Martini, A. (eds.). Weygand / Hilgetag Preparativní organická chemie (4. vydání). New York: John Wiley & Sons, Inc. str. 461. ISBN 0471937495.
- ^ Kosugi, M .; Kameyama, M .; Migita, T. (1983), "Palladium-Catalyzed Aromatic Amination of Aryl Bromides Withn, n-Di-Ethylamino-Tributyltin", Chemické dopisy, 12 (6): 927–928, doi:10.1246 / cl.1983.927
- ^ Boger, D.L .; Panek, J.S. (1984), "Palladium (0) - zprostředkovaná syntéza beta-karbolinu: Příprava kruhového systému CDE lavendamycinu", Čtyřstěn dopisy, 25 (30): 3175–3178, doi:10.1016 / S0040-4039 (01) 91001-9
- ^ Paul, F .; Patt, J .; Hartwig, J.F. (1994), "Palladiem katalyzovaná tvorba vazeb uhlík-dusík. Meziprodukty reakce a zlepšení katalyzátoru při hetero-křížové vazbě arylhalogenidů a amidů cínu", J. Am. Chem. Soc., 116 (13): 5969–5970, doi:10.1021 / ja00092a058
- ^ Guram, A.S .; Buchwald, S.L. (1994), „Palladium-Catalyzed Aromatic Aminations with in situ Generated Aminostannanes“, J. Am. Chem. Soc., 116 (17): 7901–7902, doi:10.1021 / ja00096a059
- ^ A b Louie, J .; Hartwig, J.F. (1995), "Palladiem katalyzovaná syntéza arylaminů z arylhalogenidů. Mechanické studie vedou ke kondenzaci za nepřítomnosti činidel na bázi cínu", Čtyřstěn dopisy, 36 (21): 3609–3612, doi:10.1016 / 0040-4039 (95) 00605-C
- ^ A b C Guram, A.S .; Rennels, R.A .; Buchwald, S.L. (1995), „Jednoduchá katalytická metoda pro přeměnu arylbromidů na arylaminy“, Angewandte Chemie International Edition, 34 (12): 1348–1350, doi:10.1002 / anie.199513481
- ^ A b C Muci, A.R .; Buchwald, S.L. (2002), „Praktické katalyzátory palladia pro tvorbu vazeb C-N a CO“, Témata v Curr. Chem., Témata v současné chemii, 219: 131–209, doi:10.1007 / 3-540-45313-x_5, ISBN 978-3-540-42175-7
- ^ Driver, M.S .; Hartwig, J.F. (1997), „Redukční eliminace arylaminů z fosforečných komplexů palladia (II) na bázi uhlíku a dusíku vytvářejících vazby“, J. Am. Chem. Soc., 119 (35): 8232–8245, doi:10.1021 / ja971057x
- ^ Hartwig, J.F .; Richards, S .; Barañano, D .; Paul, F. (1996), "Vlivy na relativní sazby redukční eliminace C-N vytvářející vazby a eliminace β-vodíku amidů. Případová studie o počátcích konkurenční redukce palladiem katalyzované aminace arylhalogenidů" , J. Am. Chem. Soc., 118 (15): 3626–3633, doi:10.1021 / ja954121o
- ^ Driver, M.S .; Hartwig, J.F. (1995), „Vzácný komplex alkylamido s nízkým obsahem valentinu, komplex difenylamido a jejich redukční eliminace aminů pomocí tří souřadnicových meziproduktů“, J. Am. Chem. Soc., 117 (16): 4708–4709, doi:10.1021 / ja00121a030
- ^ Widenhoefer, R.A .; Buchwald, S.L. (1996), „Vliv halogenidů a aminů na rovnovážnou tvorbu palladiových tris (o-tolyl) fosfinových mono (aminových) komplexů z dimerů palladia arylhalogenidů“, Organometallics, 15 (12): 2755–2763, doi:10.1021 / om9509608
- ^ A b Hartwig, J.F. (1999), "Přístupy k objevu katalyzátoru. Nové formování vazby uhlík-heteroatom a uhlík-uhlík", Pure Appl. Chem., 71 (8): 1416–1423, doi:10.1351 / pac199971081417, S2CID 34700080
- ^ Hartwig, J.F. (1997), „Palladium-Catalyzed Amination of Aryl Halides: Mechanism and Rational Catalyst Design“, Synlett, 1997 (4): 329–340, doi:10.1055 / s-1997-789
- ^ Hartwig, J.F. (1998), „Carbon-Heteroatom Bond-Forming Reductive Eliminations of Amines, Ethers, and Sulfides“, Acc. Chem. Res., 31: 852–860, doi:10,1021 / ar970282g
- ^ Wolfe, J.P .; Wagaw, S .; Marcoux, J.F .; Buchwald, S.L. (1998), "Racionální vývoj praktických katalyzátorů pro tvorbu aromatických vazeb uhlík-dusík", Acc. Chem. Res., 31: 805–818, doi:10.1021 / ar9600650
- ^ A b Hartwig, J.F. (1998), "Transition Metal Catalyzed Synthesis of Arylamines and Aryl Ethers from Aryl Halides and Triflates: Scope and Mechanism", Angew. Chem. Int. Vyd., 37 (15): 2046–2067, doi:10.1002 / (sici) 1521-3773 (19980817) 37:15 <2046 :: aid-anie2046> 3.0.co; 2-l
- ^ A b Hartwig, J.F. (2008), „Evoluce katalyzátoru čtvrté generace pro aminaci a thioetherifikaci arylhalogenidů“, Acc. Chem. Res., 41 (11): 1534–1544, doi:10.1021 / ar800098p, PMC 2819174, PMID 18681463
- ^ A b Surry, D.S .; Buchwald, S.L. (2008), „Biaryl fosfanové ligandy v palladiem katalyzované aminaci“, Angew. Chem. Int. Vyd., 47 (34): 6338–6361, doi:10.1002 / anie.200800497, PMC 3517088, PMID 18663711
- ^ Surry, D.S .; Buchwald, S.L. (2011), „Dialkylbiaryl fosfiny v Pd-katalyzované aminaci: uživatelská příručka“, Chem. Sci., 2 (1): 27–50, doi:10.1039 / c0sc00331j, PMC 3306613, PMID 22432049
- ^ [15][16][14][9][17][18][19][20][21]
- ^ Thomas J. Colacot. Nobelova cena za chemii za rok 2010: křížová vazba katalyzovaná palladiem. Platinum Metals Rev., 2011, 55, (2) doi: 10,1595 / 147106711X558301
- ^ Wolfe, J. P .; Buchwald, S. L. (1996), „Palladium-Catalyzed Amination of Aryl Iodides“, J. Org. Chem., 61 (3): 1133–1135, doi:10.1021 / jo951844h
- ^ Driver, M.S .; Hartwig, J.F. (1996), „Katalyzátor druhé generace pro arylhalogenidovou aminaci: Smíšené sekundární aminy z arylhalogenidů a primární aminy katalyzované (DPPF) PdCl2“, J. Am. Chem. Soc., 118 (30): 7217–7218, doi:10.1021 / ja960937t
- ^ Wolfe, J.P .; Wagaw, S .; Buchwald, S.L. (1996), „Vylepšený katalytický systém pro tvorbu aromatických vazeb uhlík-dusík: možné zapojení komplexů bis (fosfin) palladia jako klíčových meziproduktů“, J. Am. Chem. Soc., 118: 7215–7216, doi:10.1021 / ja9608306
- ^ Louie, J .; Driver, M.S .; Hamann, B.C .; Hartwig, J.F. (1997), „Palladium-Catalyzed Amination of Aryl Triflates and Importance of Triflate Add Rate“, J. Org. Chem., 62 (5): 1268–1273, doi:10.1021 / jo961930x
- ^ Wagaw, S .; Rennels, R.A .; Buchwald, S.L. (1997), „Palladium Catalyzed Coupling of Optically Active Amines with Aryl Bromides“, J. Am. Chem. Soc., 119 (36): 8451–8458, doi:10.1021 / ja971583o
- ^ Old, D.W .; Wolfe, J.P .; Buchwald, S.L. (1998), „Vysoce aktivní katalyzátor pro křížové vazebné reakce katalyzované palladiem: Suzukiho vazby při pokojové teplotě a aminace neaktivních arylchloridů“, J. Am. Chem. Soc., 120: 9722–9723, doi:10.1021 / ja982250 +
- ^ Wolfe, J.P .; Buchwald, S.L. (1999), „Vysoce aktivní katalyzátor pro aminaci při pokojové teplotě a Suzukiho párování arylchloridů“, Angew. Chem. Int. Vyd., 38 (16): 2413–2416, doi:10.1002 / (sici) 1521-3773 (19990816) 38:16 <2413 :: aid-anie2413> 3.0.co; 2-h, PMID 10458806
- ^ Hamann, B.C .; Hartwig, J.F. (1998), „Sterically Binder Chelating Alkyl Phosphines Provide Large Speed Accelerations in Palladium-Catalyzed Amination of Aryl Iodides, Bromides, and Chlorides, and the First Amination of Aryl Tosylates“, J. Am. Chem. Soc., 120 (29): 7369–7370, doi:10.1021 / ja981318i
- ^ Wolfe, J.P .; Tomori, H .; Sadighi, J.P .; Yin, J .; Buchwald, S.L. (2000), „Jednoduchý a efektivní katalyzátorový systém pro palladiem katalyzovanou aminaci chloridů, bromidů a triflátů“ (PDF), J. Org. Chem., 65 (4): 1158–1174, doi:10.1021 / jo991699y, PMID 10814067
- ^ Stambuli, J.P .; Kuwano, R .; Hartwig, J.F. (2002), „Bezkonkurenční sazby pro aktivaci arylchloridů a bromidů: párování s aminy a kyselinami boritými během několika minut při pokojové teplotě“, Angew. Chem. Int. Vyd., 41 (24): 4746–4748, doi:10.1002 / anie.200290036, PMID 12481346
- ^ Huang, X .; Anderson, K.W .; Zim, D .; Jiang, L .; Klapars, A .; Buchwald, S.L. (2003), „Expand Pd-Catalyzed C-N Bond-Forming Processes: The First Amidation of Aryl Sulfonates, Awater Amination, and Complementarity with Cu-Catalyzed Reactions“, J. Am. Chem. Soc., 125 (22): 6653–6655, doi:10.1021 / ja035483w, PMID 12769573
- ^ Anderson, K.W .; Tundel, R.E .; Ikawa, T .; Altman, R.A .; Buchwald, S.L. (2006), „Monodentátové fosfiny poskytují vysoce aktivní katalyzátory pro Pd-katalyzované CN vazebné reakce heteroaromatických halogenidů / aminů a (H) N-heterocyklů“, Angew. Chem. Int. Vyd., 45 (39): 6523–6527, doi:10.1002 / anie.200601612, PMID 16955526
- ^ Ikawa, T .; Barder, T.E .; Biscoe, M.R .; Buchwald, S.L. (2007), „Pd-Catalyzed Amidations of Aryl Chlorides Using Monodentate Biaryl Phosphine Ligands: A Kinetic, Computational, and Synthetic Investigation“, J. Am. Chem. Soc., 129 (43): 13001–13007, doi:10.1021 / ja0717414, PMID 17918833
- ^ Wolfe, J.P .; Ahman, J .; Sadighi, J.P .; Singer, R.A .; Buchwald, S.L. (1997), „Ekvivalent amoniaku pro palladiem katalyzovanou aminaci arylhalogenidů a triflátů“, Tetrahedron Lett., 38 (36): 6367–6370, doi:10.1016 / S0040-4039 (97) 01465-2
- ^ Lee, S .; Jorgensen, M .; Hartwig, J.F. (2001), „Palladiem katalyzovaná syntéza arylaminů z arylhalogenidů a lithiumbis (trimethylsilyl) amidu jako ekvivalentu amoniaku“, Org. Lett., 3 (17): 2729–2732, doi:10.1021 / ol016333y, PMID 11506620
- ^ Huang, X .; Buchwald, S.L. (2001), „New Ammonia Equivalents for the Pd-Catalyzed Amination of Aryl Halides“, Org. Lett., 3 (21): 3417–3419, doi:10.1021 / ol0166808, PMID 11594848
- ^ Vo, G.D .; Hartwig, J.F. (2009), „Palladiem katalyzovaná vazba amoniaku s arylchloridy, bromidy, jodidy a sulfonáty: obecná metoda pro přípravu primárních arylaminů“, J. Am. Chem. Soc., 131 (31): 11049–11061, doi:10.1021 / ja903049z, PMC 2823124, PMID 19591470
- ^ Mann, G .; Incarvito, C .; Rheingold, A.L .; Hartwig, J.F. (1999), „Palladium-Catalyzed C-O Coupling Involving Neactivated Aryl Halides. Sterically Induced Reductive Elimination to Form the CO-Bond in Diaryl Ethers“, J. Am. Chem. Soc., 121: 3224–3225, doi:10.1021 / ja984321a
- ^ Torraca, K.E .; Huang, X .; Parrish, C.A.; Buchwald, S.L. (2001), „Efektivní intermolekulární syntéza arylesterů katalyzovaná palladiem“, J. Am. Chem. Soc., 123 (43): 10770–10771, doi:10.1021 / ja016863p, PMID 11674023
- ^ Heesgaard Jepsen Út (2011). „Syntéza funkcionalizovaných dibenzothiofenů - efektivní tříkrokový přístup založený na Pd-katalyzovaných C-C a C-S vazebných formacích“. European Journal of Organic Chemistry. 2011: 53–57. doi:10.1002 / ejoc.201001393.
- ^ Culkin, D.A .; Hartwig, J.F. (2003), „Palladiem katalyzovaná r-arylace karbonylových sloučenin a nitrilů“, Acc. Chem. Res., 36 (4): 234–245, doi:10.1021 / ar0201106, PMID 12693921
- ^ Hamada, T .; Chieffi, A .; Ahman, J .; Buchwald, S.L. (2002), „Improved Catalyst for the Asymetric Arylation of Ketone Enolates“, J. Am. Chem. Soc., 124 (7): 1261–1268, doi:10.1021 / ja011122 +, PMID 11841295
- ^ Liao, X .; Weng, Z .; Hartwig, J.F. (2008), „Enantioselektivní r-arylace ketonů s aryl trifláty katalyzovanými difluorfosovými komplexy palladia a niklu“, J. Am. Chem. Soc., 130 (1): 195–200, doi:10.1021 / ja074453g, PMC 2551326, PMID 18076166
externí odkazy
- Spojení Buchwald – Hartwig - nedávná literatura
- Buchwald-Hartwigova aminace - syntetické protokoly ze stránky organ-reaction.com
- Buchwald – Hartwig Chemistry Setkání skupiny Iana Mangiona MacMillana 30. července 2002 Odkaz
- Buchwald-Hartwigova reakce Katalyzátory drahých kovů od Acros Organics pro vazebné reakce v organické syntéze Odkaz