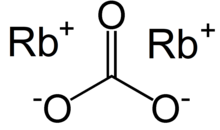
Uhličitan rubidnatý - Rubidium carbonate
 | |
| Jména | |
|---|---|
| Název IUPAC Uhličitan rubidnatý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.008.666 |
PubChem CID | |
| Číslo RTECS |
|
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| Rb2CO3 | |
| Molární hmotnost | 230,945 g / mol |
| Vzhled | Bílý prášek, velmi hygroskopický |
| Bod tání | 837 ° C (1539 ° F; 1110 K)[1] |
| Bod varu | 900 ° C (1650 ° F; 1170 K) (rozkládá se) |
| Velmi rozpustný | |
| −75.4·10−6 cm3/ mol | |
| Nebezpečí | |
| Hlavní nebezpečí | Dráždivý |
| Bod vzplanutí | Nehořlavé |
| Související sloučeniny | |
jiný kationty | Uhličitan lithný Uhličitan sodný Uhličitan draselný Uhličitan česný |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Uhličitan rubidnatý, Rb2CO3, je vhodná sloučenina rubidium; je stabilní, nijak zvlášť reaktivní a snadno rozpustný ve vodě a je formou, ve které se rubidium obvykle prodává.
Příprava
Může být připraven přidáním uhličitan amonný na hydroxid rubidný.[2]
Použití
Používá se při některých druzích výroby skla zvyšováním stability a životnosti a snižováním jeho vodivosti. Používá se také jako součást katalyzátoru pro přípravu alkoholů s krátkým řetězcem ze vstupního plynu.[3]
Reference
- ^ Pradyot Patnaik. Handbook of Anorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ^ Chisholm, Hugh, ed. (1911). . Encyklopedie Britannica. 23 (11. vydání). Cambridge University Press. p. 809.
- ^ Kanadské patenty
| Tento anorganické sloučenina –Příbuzný článek je a pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |
