Pyoverdine - Pyoverdine
 | |
| Jména | |
|---|---|
| Ostatní jména Pyoverdin | |
| Identifikátory | |
3D model (JSmol ) | |
PubChem CID | |
| |
| |
| Vlastnosti | |
| C56H88N18Ó22 | |
| Molární hmotnost | 1365.424 g · mol−1 |
| Vzhled | Pevný |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Pyoverdiny[1] (alternativně a méně často se píše jako pyoverdiny) jsou fluorescenční siderofory produkoval jistý pseudomonády.[2][3] Pyoverdiny jsou důležité faktory virulence, a jsou požadovány pro patogeneze v mnoha biologické modely infekce. Jejich příspěvky k bakteriální patogeneze zahrnovat poskytnutí zásadní živiny (tj. žehlička ), regulace jiných faktory virulence (počítaje v to exotoxin A a proteáza PrpL),[4] podpora vzniku biofilmy,[5] a jsou stále více uznávány za to, že mají toxicita oni sami.[6][7][8]
Pyoverdiny byly také zkoumány jako „Trojský kůň "molekuly pro dodávání antimikrobiální látky jinak rezistentní bakteriální kmeny, tak jako chelátory pro které lze použít bioremediace z těžké kovy, a jako fluorescenční reportéři zkoumali přítomnost železa a potenciálně dalších kovů.[9]
Díky jejich přemostění byly mezery mezi nimi patogenita, metabolismus železa, a fluorescence, pyoverdiny vzbuzují zvědavost vědců po celém světě již více než 100 let.
Biologické funkce
Jako většina siderofory, je syntetizován pyoverdin a vylučováno do prostředí, když mikroorganismus který to produkuje, to detekuje intracelulární žehlička koncentrace klesly pod přednastavenou prahovou hodnotu. Ačkoli žehlička je čtvrtý nejpočetnější prvek v zemské kůře, rozpustnost biologicky relevantní žehlička sloučenin je mimořádně nízká a je obecně nedostatečná pro potřeby většiny (ale ne všech) mikroorganismy. Siderofory, které jsou obvykle docela rozpustné a mají výjimečně vysoké avidita pro železo (III) (dále jen avidita některých siderofory pro žehlička přesahuje 1040 M-1 a mnoho z nejsilnějších avidit, jaké kdy byly pozorovány v přírodě siderofory pro žehlička ), pomůže zvýšit biologická dostupnost z žehlička natažením do vodného roztoku.
Kromě této role má pyoverdin řadu dalších funkcí, včetně regulace virulence,[4][5] omezení růstu jiných bakteriálních druhů (a slouží jako druh antimikrobiálních látek) omezením dostupnosti železa a sekvestrací jiných kovů a prevencí jejich toxicity.
Struktura a vlastnosti
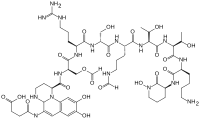
Ačkoli bylo izolováno a studováno mnoho (> 100) forem pyoverdinu, všechny mají určité společné vlastnosti. Každá molekula pyoverdinu má tři části: dihydroxychinolinové jádro, 6-14 aminokyselina peptid to se liší mezi kmeny, a postranní řetězec (obvykle složený ze 4-5 uhlíkových α-ketokyselina z Cyklus Krebs / kyselina citronová ). Jádro pyoverdinu je zodpovědné za několik jeho vlastností, včetně jeho dobře známé nažloutlé barvy a fluorescence.
Struktura
Dihydroxychinolinové jádro se skládá z (lS) -5-amino-2,3-dihydro-8,9-dihydroxy-lH-pyrimido [1,2-a]chinolin -1-karboxylová kyselina. Tato část molekuly je neměnná mezi všemi pozorovanými molekulami pyoverdinu.
Jádro je upraveno přidáním aminokyselinový řetězec pyoverdinu se skládá z 6-14 aminokyseliny. Řetěz aminokyselin je zabudován do chromofor jádro a je syntetizováno prostřednictvím syntéza neribozomálních peptidů.[10][11] Jak je běžné u nerebrososomálně syntetizovaných peptidů, pyoverdin často zahrnuje Aminokyseliny ve formě D a nestandardní aminokyseliny, jako například N-5-formyl-N-5-hydroxyornithin. Peptidový řetězec může být také částečně (nebo úplně) cyklizovaný. Tento peptidový řetězec poskytuje další čtyři aspekty hexadentát interakce, obvykle prostřednictvím hydroxamát a / nebo hydroxykarboxylát skupiny. Tato část molekuly je také zásadní pro interakci s receptorem ferripyoverdinu (FpvA), který umožňuje import ferripyoverdinu do buňky. Peptidový řetězec produkovaný daným kmenem Pseudomonas je v současné době považován za neměnný.
O konkrétní funkci nebo důležitosti postranního řetězce ketokyseliny je známo málo, ale je dobře známo[12] že molekuly pyoverdinu s různými ketokyseliny (kongenery ) koexistovat. Ketokyseliny které byly pozorovány, zahrnují sukcinát /sukcinamid, glutamát, glutarát, malát /malamid, a α-ketoglutarát.
| Druhy Pseudomonad | Kmen | Struktura peptidového řetězce pyoverdinu |
|---|---|---|
| P. aeruginosa | ATCC15692 (PAO1) | Q-DSer-Arg-DSer-FoOHOrn-c (Lys-FoOHOrn-Thr-Thr) |
| P. aeruginosa | ATCC27853 | Q-DSer-FoOHDOrn-Orn-Gly-aDThr-Ser-cOHOrn |
| P. aeruginosa | Pa6 | Q-DSer-Dab-FoOHOrn-Gln-DGln-FoOHDOrn-Gly |
| P. chlororaphi | ATCC9446 | Q-DSer-Lys-Gly-FoOHOrn-c (Lys-FoOHDOrn-Ser) |
| P. fluorescens bv.I | ATCC13525 | Q-DSer-Lys-Gly-FoOHOrn-c (Lys-FoOHDOrn-Ser) |
| P. fluorescens bv.I | 9AW | Q-DSer-Lys-OHHis-aDThr-Ser-cOHOrn |
| P. fluorescens bv.III | ATCC17400 | Q-DAla-DLys-Gly-Gly-OHAsp-DGln / Dab-Ser-DAla-cOHOrn |
| P. fluorescens bv.V | 51 W. | Q-DAla-DLys-Gly-Gly-OHDAsp-DGln-DSer-Ala-Gly-aDThr-cOHOrn |
| P. fluorescens bv.V | 1 W. | Q-DSer-Lys-Gly-FoOHOrn-c (Lys-FoOHDOrn-Ser) |
| P. fluorescens bv.V | 10CW | Q-DSer-Lys-Gly-FoOHOrn-c (Lys-FoOHDOrn-Ser) |
| P. fluorescens bv.VI | PL7 | Q-DSer-AcOHDOrn-Ala-Gly-aDThr-Ala-cOHOrn |
| P. fluorescens bv.VI | PL8 | Q-DLys-AcOHDOrn-Ala-Gly-aDThr-Ser-cOHOrn |
| P. fluorescens | 1.3 | Q-DAla-DLys-Gly-Gly-OHAsp-DGln / Dab-Gly-Ser-cOHOrn |
| P. fluorescens | 18.1 | Q-DSer-Lys-Gly-FoOHOrn-Ser-DS-Gly-c (Lys-FoOHDOrn-Ser) |
| P. fluorescens | CCM 2798 | Q-Ser-Dab-Gly-Ser-OHDAsp-Ala-Gly-DAla-Gly-cOHOrn |
| P. fluorescens | CFBP 2392 | Q-DLys-AcOHDOrn-Gly-aDThr-Thr-Gln-Gly-DSer-cOHOrn |
| P. fluorescens | CHA0 | Q-Asp-FoOHDOrn-Lys-c (Thr-Ala-Ala-FoOHDOrn-Lys) |
| P. putida bv. B | 9BW | Q-DSer-Lys-OHHis-aDThr-Ser-cOHOrn |
| P. putida | CFBP 2461 | Q-Asp-Lys-OHDAsp-Ser-aDThr-Ala-Thr-DLys-cOHOrn |
| P. tolaasii | NCPPB 2192 | Q-DSer-Lys-Ser-DSer-Thr-Ser-AcOHOrn-Thr-DSer-cOHDOrn |
Vlastnosti
Mezi jejich dalšími pozoruhodnými vlastnostmi vykazují pyoverdiny světlé, relativně fotostabilní fluorescence s charakteristikou excitační a emisní spektra které jsou rychlé a silné uhasit při vázání jejich přirozené ligand, žehlička. Vzrušení a molární nasákavost ukázat umírněně pH závislost, ale fluorescence není obecně ovlivněn pH variace. Na rozdíl od fluorescence, spektroskopické absorpce ukazuje málo kalení na vázání železa, což naznačuje, že mechanismus molekulární relaxace je spíše vibrační než přes elektromagnetická radiace.
Pyoverdine souřadnice a hexadentát (tj. šestidílná) chelatace železa, která zahrnuje šest různých atomů kyslíku (2 z jádra dihyodroxychinolinu a 2 z každé ze 2 různých aminokyselin v páteři). Výsledkem je velmi těsná koordinace osmistěn komplex, který účinně brání vniknutí voda nebo jiné materiály, které mohou narušit vazbu. Typicky, železité železo je odstraněn z pyoverdinu pomocí snížení do železný stav, pro který má pyoverdin mnohem nižší hodnotu (tj. 109 M-1) avidita. To umožňuje nedestruktivní odstranění železa z pyoverdinu. Po redukci je železo „předáno“ dalším nosičům, které mají zvýšenou afinitu k železnému železu, zatímco apopyoverdin je znovu exportován pro další použití.
Pyoverdine je strukturálně podobný azobaktin, z Azotobacter vinelandii, až na to, že tento má extra močovinový prstenec.[13]
Syntéza
Biosyntéza
v Pseudomonas aeruginosa PAO1 je jich 14 pvd geny podílející se na biosyntéze pyoverdinu.[14]
Zdá se, že biosyntéza pyoverdinu je do značné míry regulována prostřednictvím činnosti náhradníka faktor sigma PvdS, který je zase regulován jak Furovým systémem, tak intracelulární sekvestrací PvdS na plazmatická membrána a pryč od nukleoid represorem FpvI.
Navzdory významnému výzkumu je o biosyntéze pyoverdinu známo relativně málo. Například zůstává nejasné, zda biosyntéza pyoverdinu probíhá jako jednotlivé složky (tj. Jádro, peptid řetěz a ketokyselina ) nebo pokud jsou jádro a další části kondenzovány jako počáteční molekula (pravděpodobně proteinem PvdL) a poté modifikovány dalšími enzymy. Z důvodů, které zůstávají nejasné, je biosyntéza pyoverdinu silně inhibována protirakovinovým terapeutikem fluorouracil,[15] zejména díky své schopnosti narušit metabolismus RNA.[16] Ačkoli se produkce pyoverdinu liší od kmene k kmeni, bylo prokázáno, že fluorescenční druhy Pseudomonas produkují mezi 200 a 500 mg / l, když jsou pěstovány v podmínkách s nedostatkem železa.[17][18]
Jádro
Existují určité spory o původ fluorescenční chromofor jádro. Původně to bylo široce myšlenka být syntetizován pvcABCD operon, jako vypuštění částí pvcC a pvcD geny narušují produkci pyoverdinu.[19] Stejně jako ostatní aspekty biosyntézy pyoverdinu, regulace pvcABCD je závislá na železa a ztráta aktivity těchto genů vyústila v narušení pyoverdinu.
Navrhuje to samostatná zpráva pvcABCD místo toho může být zodpovědný za syntézu paerukumarinu (molekuly související s pseudoverdinem) a tvrdí, že ztráta aktivity v lokusu nemá žádný vliv na produkci pyoverdinu.[20] Kromě toho některým fluorescenčním pseudomonádám chybí zjevné homology těchto genů, což dále zpochybňuje, zda je to funkce těchto genů.
To je v souladu se zprávami pvdL kombinuje koenzym A do a myristický kyselá skupina, pak přidá a glutamát, D-tyrosin a kyselina L-2,4-diaminomáselná (DAB).[21] To naznačuje alternativní biosyntetická cesta pvdL zahrnuje glutamát Místo toho 2,4,5-trihydroxyfenylalanin a kyselina L-2,4-daminomáselná.[22] Toto je podporováno identifikací začlenění radioaktivně značeného zboží tyrosin do pyoverdinu nebo pseudoverdinu.
Tento rozpor zůstává nevyřešen.
Peptidový řetězec
Několik z geny zodpovědný za biosyntézu pyoverdinu (např. pvdH, pvdA, a pvdF) se podílejí na generování předchůdců a alternativ aminokyseliny nezbytné pro různé části molekuly.[23] Několik dalších (např. pvdI, a pvdJ) jsou přímo zodpovědní za „sešívání“ peptidového řetězce.[23] pvdD ukončí řetězec a uvolní předchůdce do cytoplazma, což je v souladu s identifikací molekul podobných pyoverdinu v cytoplazma s neúplně dospělými chromofory.[23]
Ketokyselina
Nejlepší dostupné důkazy v současné době naznačují, že: ketokyselina je původně připojen k chromofor jádro (jako L-glutamát ) když je syntetizován z D-tyrosin, Kyselina L-2,4-diaminomáselná a L-glutamát. Není jasné, jak se to později změní na druhého příbuzného (tj. a-ketoglutarát, sukcinát /sukcinamid atd.) formuláře.
Zrání a export
Lokalizace některých Pvd proteinů v periplazma a vnější membrána (jako PvdN, PvdO, PvdP a PvdQ) byly interpretovány tak, že naznačují, že na tomto místě dochází k částem zrání pyoverdinu, snad po transportu do periplazma od PvdE, který je homologní s Vývozci typu ABC. Jak zcela vyzrálý pyoverdin je z buňky exportován, zůstává nejasný. Jakmile je zcela zralý, pyoverdin se exportuje z periplazma autor: PvdRT-OpmQ výtok čerpadlo.
Celková chemická syntéza
Kompletní organická syntéza cesta pro pyoverdin produkovaný P. aeruginosa byl hlášen kmen PAO1[24] použitím syntéza peptidů na pevné fázi. Tento protokol poskytl pyoverdin s vysokým výtěžkem (~ 48%) a očekává se, že podstatně zvýší schopnost vědců generovat cílené deriváty na pyoverdinovém lešení a usnadní vytváření siderofory s antimikrobiální hlavice.
Mechanismy virulence
Bylo hlášeno, že je vyžadován pyoverdin virulence v různých modely nemocí, počítaje v to C. elegans a různé modely myší infekce (např. modely pro popáleniny, modely pro zápal plic atd.).[6][15][25]
Jak bylo uvedeno výše, pyoverdin přispívá několika způsoby k obecné virulenci, včetně regulace jeho produkce, exotoxin A (který zastaví překlad) a proteáza PrpL.[4] Existují také důkazy, že ačkoli to není nezbytné pro jeho tvorbu, pyoverdin přispívá k výrobě a rozvoji biofilmy které jsou důležité pro virulenci.[5]
A konečně, pyoverdin je sám o sobě spojen s několika typy toxicity. V roce 2001 uvedli Albesa a kolegové, že pyoverdin byl purifikován z kmene P. fluorescens vystavoval hluboko cytotoxicita savcům makrofágy a že tento účinek byl alespoň částečně závislý na reaktivní formy kyslíku.[26] Kirienko a kolegové později zjistili, že pyoverdin je pro zabíjení nezbytný a dostatečný C. elegans, který vstupuje do hostitelských buněk, destabilizuje mitochondriální dynamika, a indukuje a hypoxická odpověď.[6][7] Expozice spouští reakci, která je v souladu s hypoxie to záleží na HIF-1 protein, což naznačuje, že hostitel vnímá stav, kdy mu chybí molekulární nástroje pro generování ATP (obecně redukční ekvivalenty železa, kyslíku a buněk).[6][7]
Role v mikrobiální spolupráci
Jakmile je pyoverdin vylučován, volně difunduje do životního prostředí. Pyoverdin vázaný na železo (také známý jako ferripyoverdin) může být absorbován jakoukoli bakteriální buňkou receptor, i když se to mezi kmeny liší.[27] Důležité je, že to vytváří společné zboží, které může být zneužito „podvodníky“, kteří si zachovají schopnost používat pyoverdin, ale přestali jej vyrábět. Vzhledem k tomu, že výroba pyoverdinu je energeticky nákladná, může to v buňkách, které ji nesyntetizují, vytvořit fitness výhodu.[28][29][30][31] V důsledku toho se pyoverdin stal modelovým znakem ke studiu mikrobiální spolupráce a vykořisťování.[32][33]
v P. aeruginosa Bylo prokázáno, že „cheat“ bakterie neprodukující pyoverdin i) se snadno vyvíjejí z produkujícího předka;[34] a ii) překonat spolupráci kmeny ve smíšené kultuře způsobem závislým na hustotě a frekvenci.[35][36] Protože použití pyoverdinu se spoléhá na pasivní difúze a produkce pyoverdinu je metabolicky nákladná, je známo, že podmínky prostředí ovlivňují pravděpodobnost úspěšného využití. Ukázalo se, že konkurenční výhoda nevýrobců pyoverdinu oproti producentům ve smíšené kultuře je maximalizována, když jsou prostředí dobře promíchána a molekuly snadno difundují (nízká prostorová struktura) a když jsou náklady a přínosy výroby pyoverdinu vysoké, tj. žehlička je silně omezená.[30][37] Většina studií o spolupráci a podvádění pyoverdinu byla provedena s použitím klinických izolátů, ale siderofor vykořisťování bylo nedávno také prokázáno v přírodních Pseudomonas izoláty z neklinických vzorků.[38][39]
Nomenklatura
V současné době se k rozlišení struktur pyoverdinu nepoužívá žádná rozšířená a systematická nomenklatura. Systém byl navržen v roce 1989,[40] skládající se z pyoverdinu typu I, typu IIa, typu IIb a typu III. V té době bylo známo pouze několik struktur pyoverdinu a předpokládalo se, že dojde k mnohem menším variacím, než jaké byly dosud pozorovány. V důsledku obrovské heterogenity pozorované v EU peptid páteř a pozorování kongenerů (pyoverdiny z jednoho kmene, které se liší pouze svými ketokyselina části), nomenklatura pyoverdinů zůstává poměrně nejasná a žádný jednotný systém nezískal univerzální přijetí.
Dějiny
- 50. léta: Sédillot zaznamenává modrozelený výtok z obvazů na chirurgické rány.
- 1860: Pyoverdine (i když ne tak pojmenovaný) byl extrahován z obvazů na rány Fordos.
- 1862: Lucke spojuje pyoverdin s bacily pozorovanými pod mikroskopem.
- 1882: Pseudomonas aeruginosa vypěstován poprvé v čisté kultuře Carle Gessardovou, uvedenou v „O modré a zelené barvě obvazů“. Gessard pojmenovává organismus Bacillus aeruginosa, po „aerugo“, latinské slovo pro měděnka.
- 1889: Bouchard uvádí, že injekce králíka infikovaného Bacillus anthracis (původce antrax ) s P. aeruginosa zabraňuje tvorbě antraxu.
- 1889: Bouchard objevuje ten pyoverdin fluoreskuje pod ultrafialové světlo.
- 1948, 1952: První pozorování, že koncentrace žehlička a pyoverdin jsou vzájemné.
- 1978: Meyer a kolegové poprvé demonstrovali roli pyoverdinu při získávání železa.
- 80. – 90. Léta 20. století: Byly vypracovány první struktury a regulace proverdinu
- 1999: První stanovení, že fluorescence pyoverdinu je uhasit železnou vazbou.
Jiná použití
Tato část je prázdná. Můžete pomoci přidávat k tomu. (Říjen 2016) |
Pseudoverdin
Sloučenina příbuzná pyoverdinu, nazývaná pseudoverdin (formálně známá jako 3-formylamino-6,7-dihydroxykumarin), je také vyráběna některými fluorescenční Pseudomonády.[41] Předpokládá se, že pseudoverdin a pyoverdin mohou vzniknout ze společného prekurzoru, 2,4,5-trihydroxyfenylalaninu, který může kondenzovat s kyselinou L-2,4-diaminomáselnou, aby zahájil produkci pyoverdinu.[41]
Pseudoverdin je relativně podobný pyoverdinu v jeho fluorescence a další spektroskopické vlastnosti a jeho schopnost chelátovat železitý žehlička, i když mnohem nižší afinita.[41] Na rozdíl od pyoverdinu není schopen přepravující žehlička do buňky, pravděpodobně kvůli absenci peptid řetěz.[41] Další odlišností je, že se zdá, že pseudoverdin není regulované stejnými procesy jako pyoverdin.[41]
Reference
- ^ Pro účely této stránky bude pyoverdin obecně odkazovat (není-li uvedeno jinak) na pyoverdin produkovaný Pseudomonas aeruginosa kmen PAO1. Byl podroben nejrozsáhlejší studii a lze jej považovat za prototyp sideroforu.
- ^ S. Wendenbaum; P. Demange; A. Dell; J. M. Meyer; M. A. Abdallah (1983). "Struktura pyoverdinu Pa, sideroforu Pseudomonas aeruginosa". Čtyřstěn dopisy. 24 (44): 4877–4880. doi:10.1016 / S0040-4039 (00) 94031-0.
- ^ Menhart, N .; Thariath, A .; Viswanatha, T. (1991). "Charakterizace pyoverdinu Azotobacter vinelandii ATCC 12837 s ohledem na heterogenitu". Biologie kovů. 4 (4): 223–32. doi:10.1007 / bf01141185. PMID 1838001. S2CID 8712926.
- ^ A b C Lamont, Iain L .; Beare, Paul A .; Ochsner, Urs; Vasil, Adriana I .; Vasil, Michael L. (2002-05-14). „Signalizace zprostředkovaná sideroforem reguluje produkci faktoru virulence u Pseudomonasaeruginosa“. Sborník Národní akademie věd Spojených států amerických. 99 (10): 7072–7077. Bibcode:2002PNAS ... 99.7072L. doi:10.1073 / pnas.092016999. ISSN 0027-8424. PMC 124530. PMID 11997446.
- ^ A b C Banin, Ehud; Vasil, Michael L .; Greenberg, E. Peter (02.08.2005). „Tvorba biofilmu železa a Pseudomonas aeruginosa“. Sborník Národní akademie věd Spojených států amerických. 102 (31): 11076–11081. Bibcode:2005PNAS..10211076B. doi:10.1073 / pnas.0504266102. ISSN 0027-8424. PMC 1182440. PMID 16043697.
- ^ A b C d Kirienko, Natalia V .; Kirienko, Daniel R .; Larkins-Ford, Jonah; Wählby, Carolina; Ruvkun, Gary; Ausubel, Frederick M. (2013-04-17). „Pseudomonas aeruginosa narušuje homeostázu železa Caenorhabditis elegans a způsobuje hypoxickou reakci a smrt“. Mobilní hostitel a mikrob. 13 (4): 406–416. doi:10.1016 / j.chom.2013.03.003. ISSN 1934-6069. PMC 3641844. PMID 23601103.
- ^ A b C Kirienko, Natalia V .; Ausubel, Frederick M .; Ruvkun, Gary (10.02.2015). „Mitophagy propůjčuje odolnost proti sideroforům zprostředkovanému zabíjení Pseudomonas aeruginosa“. Sborník Národní akademie věd Spojených států amerických. 112 (6): 1821–1826. Bibcode:2015PNAS..112.1821K. doi:10.1073 / pnas.1424954112. ISSN 1091-6490. PMC 4330731. PMID 25624506.
- ^ Minandri, Fabrizia; Imperi, Francesco; Frangipani, Emanuela; Bonchi, Carlo; Visaggio, Daniela; Facchini, Marcella; Pasquali, Paolo; Bragonzi, Alessandra; Visca, Paolo (01.08.2016). „Role systémů pro příjem železa při virulenci Pseudomonas aeruginosa a infekci dýchacích cest“. Infekce a imunita. 84 (8): 2324–2335. doi:10.1128 / IAI.00098-16. ISSN 1098-5522. PMC 4962624. PMID 27271740.
- ^ Yoder, Michael F .; Kisaalita, William S. (01.01.2011). „Specifičnost železa biosenzoru na základě fluorescenčního pyoverdinu imobilizovaného ve sklenici sol-gel. Journal of Biological Engineering. 5: 4. doi:10.1186/1754-1611-5-4. ISSN 1754-1611. PMC 3114707. PMID 21554740.
- ^ Hohlneicher, U .; Schäfer, M .; Fuchs, R .; Budzikiewicz, H. (11. 10. 2016). „Ferribaktiny jako biosyntetické prekurzory Poveromonas siderophores pyoverdins“. Zeitschrift für Naturforschung C. 56 (3–4): 308–310. doi:10.1515 / znc-2001-3-423. ISSN 0939-5075. PMID 11371026.
- ^ Visca, Paolo; Imperi, Francesco; Lamont, Iain L. (01.01.2007). „Pyoverdine siderofory: od biogeneze po biologickou významnost“. Trendy v mikrobiologii. 15 (1): 22–30. doi:10.1016 / j.tim.2006.11.004. ISSN 0966-842X. PMID 17118662.
- ^ Budzikiewicz, H (1997). „Siderofory fluorescenčních pseudomonád“. Zeitschrift für Naturforschung C. 52 (11–12): 713–720. doi:10.1515 / znc-1997-11-1201. PMID 9463934. S2CID 26196277.
- ^ A b Meyer, J. M. (2000). „Pyoverdines: Pigments, siderophores and potential taxonomic markers of fluorescent Pseudomonas species“. Archiv mikrobiologie. 174 (3): 135–142. doi:10,1007 / s002030000188. PMID 11041343. S2CID 13283224.
- ^ Lamont, I.L .; Martin, L. W. (2003). "Identifikace a charakterizace nových genů pro syntézu pyoverdinu v Pseudomonas aeruginosa". Mikrobiologie. 149 (4): 833–842. doi:10,1099 / mic. 0,26085-0. PMID 12686626.
- ^ A b Imperi, Francesco; Massai, Francesco; Facchini, Marcella; Frangipani, Emanuela; Visaggio, Daniela; Leoni, Livia; Bragonzi, Alessandra; Visca, Paolo (2013-04-30). „Opětovné použití antimykotického léčiva flucytosin pro potlačení patogenity Pseudomonas aeruginosa“. Sborník Národní akademie věd Spojených států amerických. 110 (18): 7458–7463. Bibcode:2013PNAS..110.7458I. doi:10.1073 / pnas.1222706110. ISSN 1091-6490. PMC 3645532. PMID 23569238.
- ^ Kirienko, Daniel R .; Revtovich, Alexey V .; Kirienko, Natalia V. (2016-08-01). „Fenotypová obrazovka s vysokým obsahem identifikuje fluorouridin jako inhibitor biosyntézy pyoverdinu a virulence Pseudomonas aeruginosa.“. mSphere. 1 (4): e00217–16. doi:10,1128 / mSphere.00217-16. ISSN 2379-5042. PMC 4999921. PMID 27579370.
- ^ Cornelis, P; Hohnadel, D; Meyer, JM (1989). „Důkazy o různých systémech absorpce železa zprostředkovaných pyoverdinem u kmenů Pseudomonas aeruginosa“. Infect Immun. 57 (11): 3491–3497. doi:10.1128 / IAI.57.11.3491-3497.1989. PMC 259858. PMID 2509364.
- ^ Hohnadel, Dany; Haas, Dieter; Meyer, Jean-Marie (01.09.186). "Mapování mutací ovlivňujících produkci pyoverdinu v Pseudomonas aeruginosa". Mikrobiologické dopisy FEMS. 36 (2–3): 195–199. doi:10.1111 / j.1574-6968.1986.tb01695.x. ISSN 0378-1097.
- ^ Stintzi, A .; Johnson, Z .; Stonehouse, M .; Ochsner, U .; Meyer, J. M .; Vasil, M. L .; Poole, K. (01.07.1999). „Pvc genový klastr Pseudomonas aeruginosa: role v syntéze pyoverdinového chromoforu a regulace pomocí PtxR a PvdS“. Journal of Bacteriology. 181 (13): 4118–4124. doi:10.1128 / JB.181.13.4118-4124.1999. ISSN 0021-9193. PMC 93907. PMID 10383985.
- ^ Clarke-Pearson, Michael F .; Brady, Sean F. (01.10.2008). „Paerucumarin, nový metabolit produkovaný shlukem pvc genů z Pseudomonas aeruginosa“. Journal of Bacteriology. 190 (20): 6927–6930. doi:10.1128 / JB.00801-08. ISSN 1098-5530. PMC 2566218. PMID 18689486.
- ^ Budzikiewicz, H (1993). "Sekundární metabolity z fluorescenčních pseudomonád". FEMS Microbiol Rev. 10 (3–4): 209–228. doi:10.1111 / j.1574-6968.1993.tb05868.x. PMID 8318257.
- ^ Stintzi, A; Cornelis, P; Hohnadel, D; Meyer, JM; Dean, C; Poole, K; Kourambas, S; Krishnapillai, V (1996). "Nový gen (y) biosyntézy pyoverdinu Pseudomonas aeruginosa PAO". Mikrobiologie. 142 (5): 1181–1190. doi:10.1099/13500872-142-5-1181. PMID 8704959.
- ^ A b C Cézard, C .; Farvacques, N .; Sonnet, P. (01.01.2015). "Chemie a biologie pyoverdinů, primární siderofory Pseudomonas". Současná léčivá chemie. 22 (2): 165–186. doi:10.2174/0929867321666141011194624. ISSN 1875-533X. PMID 25312210.
- ^ Mashiach, Roi; Meijler, Michael M. (04.04.2013). "Celková syntéza pyoverdinu D". Organické dopisy. 15 (7): 1702–1705. doi:10.1021 / ol400490s. ISSN 1523-7052. PMID 23530778.
- ^ Takase, H .; Nitanai, H .; Hoshino, K .; Otani, T. (2000-04-01). „Dopad produkce sideroforů na infekce Pseudomonas aeruginosa u myší s potlačenou imunitou“. Infekce a imunita. 68 (4): 1834–1839. doi:10.1128 / iai.68.4.1834-1839.2000. ISSN 0019-9567. PMC 97355. PMID 10722571.
- ^ Becerra, C .; Albesa, I .; Eraso, A. J. (2001-07-13). "Leukotoxicita pyoverdinu, produkce reaktivních druhů kyslíku a účinek UV záření". Sdělení o biochemickém a biofyzikálním výzkumu. 285 (2): 414–418. doi:10.1006 / bbrc.2001.5188. PMID 11444858.
- ^ Bodilis, Josselin; Ghysels, Bart; Osayande, Julie; Matthijs, Sandra; Pirnay, Jean-Paul; Denayer, Sarah; De Vos, Daniel; Cornelis, Pierre (01.08.2009). "Distribuce a vývoj ferripyoverdinových receptorů v Pseudomonas aeruginosa". Mikrobiologie prostředí. 11 (8): 2123–2135. doi:10.1111 / j.1462-2920.2009.01932.x. ISSN 1462-2920. PMID 19397675.
- ^ Weigert, Michael; Kümmerli, Rolf (12.7.2017). „Fyzické hranice spolupráce veřejných statků mezi povrchově vázanými bakteriálními buňkami“. Proc. R. Soc. B. 284 (1858): 20170631. doi:10.1098 / rspb.2017.0631. ISSN 0962-8452. PMC 5524494. PMID 28701557.
- ^ Vzpěr, Angus; Harrison, Freya; Vos, Michiel; Brockhurst, Michael A .; Gardner, Andy; West, Stuart A .; Griffin, Ashleigh (01.11.2007). „Spolupráce a virulence u Pseudomonas aeruginosa zprostředkovaná siderofory“. Ekologie mikrobiologie FEMS. 62 (2): 135–141. doi:10.1111 / j.1574-6941.2007.00388.x. ISSN 0168-6496. PMID 17919300.
- ^ A b Kümmerli, Rolf; Brown, Sam P. (02.11.2010). „Molekulární a regulační vlastnosti veřejného statku utvářejí vývoj spolupráce“. Sborník Národní akademie věd. 107 (44): 18921–18926. Bibcode:2010PNAS..10718921K. doi:10.1073 / pnas.1011154107. ISSN 0027-8424. PMC 2973908. PMID 20944065.
- ^ Griffin, Ashleigh S .; West, Stuart A .; Vzpěr, Angus (2004). „Spolupráce a konkurence v patogenních bakteriích“. Příroda. 430 (7003): 1024–1027. Bibcode:2004 Natur.430.1024G. doi:10.1038 / nature02744. hdl:1842/698. ISSN 1476-4687. PMID 15329720. S2CID 4429250.
- ^ West, Stuart A .; Griffin, Ashleigh S .; Gardner, Andy; Diggle, Stephen P. (2006). "Teorie sociální evoluce pro mikroorganismy". Příroda Recenze Mikrobiologie. 4 (8): 597–607. doi:10.1038 / nrmicro1461. ISSN 1740-1534. PMID 16845430. S2CID 18451640.
- ^ Kümmerli, R .; Santorelli, L. A .; Granato, E. T .; Dumas, Z .; Dobay, A .; Griffin, A. S .; West, S.A. (2015-12-01). „Koevoluční dynamika mezi producenty veřejného dobra a cheaty v bakterii Pseudomonas aeruginosa“ (PDF). Journal of Evolutionary Biology. 28 (12): 2264–2274. doi:10.1111 / jeb.12751. ISSN 1420-9101. PMID 26348785. S2CID 826683.
- ^ Dumas, Z .; Kümmerli, R. (01.03.2012). "Cena pravidel pro spolupráci pro podvádění bakteriálních metapopulací". Journal of Evolutionary Biology. 25 (3): 473–484. doi:10.1111 / j.1420-9101.2011.02437.x. ISSN 1420-9101. PMID 22168669. S2CID 19132153.
- ^ Ross-Gillespie, Adin; Gardner, Andy; West, Stuart A .; Griffin, Ashleigh S. (01.09.2007). „Frekvenční závislost a spolupráce: teorie a test s bakteriemi“. Americký přírodovědec. 170 (3): 331–342. doi:10.1086/519860. ISSN 0003-0147. PMID 17879185. S2CID 14248496.
- ^ Ross-Gillespie, Adin; Gardner, Andy; Vzpěr, Angus; West, Stuart A .; Griffin, Ashleigh S. (2009-09-01). "Závislost na hustotě a spolupráce: teorie a test s bakteriemi". Vývoj. 63 (9): 2315–2325. doi:10.1111 / j.1558-5646.2009.00723.x. ISSN 1558-5646. PMID 19453724. S2CID 5699402.
- ^ Kümmerli, Rolf; Griffin, Ashleigh S .; West, Stuart A .; Vzpěr, Angus; Harrison, Freya (07.10.2009). „Viskózní médium podporuje spolupráci v patogenní bakterii Pseudomonas aeruginosa“. Proceedings of the Royal Society of London B: Biological Sciences. 276 (1672): 3531–3538. doi:10.1098 / rspb.2009.0861. ISSN 0962-8452. PMC 2817189. PMID 19605393.
- ^ Bruce, John B .; Cooper, Guy A .; Chabas, Hélène; West, Stuart A .; Griffin, Ashleigh S. (01.10.2017). "Podvádění a odolnost proti podvádění v přirozených populacích bakterie Pseudomonas fluorescens". Vývoj. 71 (10): 2484–2495. doi:10.1111 / evo.13328. ISSN 1558-5646. PMID 28833073. S2CID 3485902.
- ^ Butaitė, Elena; Baumgartner, Michael; Wyder, Stefan; Kümmerli, Rolf (04.09.2017). „Sideroforové podvádění a odpor vůči podvádění formují soutěž o železo v půdě a sladkovodních komunitách Pseudomonas“. Příroda komunikace. 8 (1): 414. Bibcode:2017NatCo ... 8..414B. doi:10.1038 / s41467-017-00509-4. ISSN 2041-1723. PMC 5583256. PMID 28871205.
- ^ Briskot, G .; Taraz, K .; Budzikiewicz, H. (1989). "Bakteriální složky, XXXVII. Siderofory pyoverdinového typu z Pseudomonas aeruginosa". Liebigs Ann Chem. 1989 (4): 375–384. doi:10,1002 / jlac.198919890164.
- ^ A b C d E Longerich, I; Taraz, K; Budzikiewicz, H; Tsai, L; Meyer, JM (1993). "Pseudoverdin, sloučenina související s pyoverdin chromoforem z kmene Pseudomonas aeruginosa, který není schopen produkovat pyoverdiny". Z Naturforsch C.. 48 (5–6): 425–429. doi:10.1515 / znc-1993-5-605. PMID 8363709. S2CID 29269780.
