Neurotubule - Neurotubule


Neurotubuly jsou mikrotubuly nalezen v neurony v nervových tkáních.[1] Spolu s neurofilamenty a mikrofilamenta, tvoří cytoskelet neuronů. Neurotubuly jsou nerozdělené duté válce, z nichž se skládá tubulin proteinové polymery[2] a pole paralelní s plazmatickou membránou v neuronech.[3] Neurotubuly mají vnější průměr asi 23 nm a vnitřní průměr, také známý jako centrální jádro, asi 12 nm. Stěna neurotubulů je široká asi 5 nm. Neurotubule obklopuje neprůhledná čirá zóna, která má průměr přibližně 40 nm.[3] Stejně jako mikrotubuly jsou neurotubuly velmi dynamické a jejich délku lze upravit pomocí polymerizace a depolymerizace tubulinu.[4]
Navzdory podobným mechanickým vlastnostem jsou neurotubuly odlišné od mikrotubulů nalezených v jiných typech buněk, pokud jde o jejich funkci a intracelulární uspořádání. Většina neurotubulů není ukotvena v organizační centrum mikrotubulů (MTOC) jako běžné mikrotubuly. Místo toho jsou propuštěni k transportu do dendritů a axonů po nich nukleace v centrosome. Proto oba konce neurotubulů končí v cytoplazma namísto.[5]
Neurotubuly jsou u různých klíčové buněčné procesy v neuronech. Dohromady s neurofilamenty, pomáhají udržovat tvar neuronu a poskytují mechanickou podporu. Neurotubuly také pomáhají transportovat organely, vezikuly obsahující neurotransmitery, messager RNA a další intracelulární molekuly uvnitř neuronu.[6]
Struktura a dynamika

Složení
Stejně jako mikrotubuly jsou neurotubuly tvořeny proteinovými polymery z α-tubulin a β-tubulin. α-tubulin a β-tubulin jsou globulární proteiny, které spolu úzce souvisejí. Spojují se dohromady a vytvářejí dimer, tzv tubulin. Neurotubuly jsou obvykle spojeny 13 protofilamenty, které jsou polymerovány z dimerů tubulinu. Protože tubulinový dimer se skládá z jednoho α-tubulinu a jednoho β-tubulinu, jeden konec neurotubulu je vystaven α-tubulinu a druhý konec β-tubulinu, tyto dva konce přispívají k polaritě neurotubulu - plus (+) konec a minus (-) konec. Β-tubulinová podjednotka je vystavena na plusovém (+) konci. Oba konce se liší tempem růstu: plus (+) end je rychle rostoucí konec, zatímco mínus (-) konec je pomalu rostoucí konec. Oba konce mají svoji vlastní rychlost polymerace a depolymerace dimerů tubulinu, síťová polymerace způsobuje seskupení tubulinu, tedy délku neurotubulů.[4]
Dynamická nestabilita
Růst neurotubulů je regulován dynamická nestabilita.[7] Vyznačuje se odlišnými fázemi růstu a rychlým smršťováním. Přechod od růstu k rychlému smršťování se nazývá „katastrofa“. Zadní strana se nazývá „záchranná“.
Polarizovaná pole neurotubulů
Neurony mají polarizovanou neurotubulární síť.[8] Axony většina neuronů obsahuje neurotubuly s plus (+) koncem rovnoměrně směřujícím k axonovému konci a minus (-) koncem orientovaným k tělu buňky, podobně jako obecná orientace mikrotubulů u jiných typů buněk. Na druhou stranu, dendrity obsahují neurotubuly se smíšenou polaritou. Polovina z nich ukazuje svůj plus (+) konec směrem k dendritickému vrcholu a druhá polovina směřuje k tělu buňky, což připomíná antiparalelní pole mikrotubulů mitotické vřeteno.
Síť polarizovaných neurotubulů tvoří základ pro selektivní obchodování s nákladem do axonů a dendritů.[9] Například když dojde k mutacím v dynein, a motorický protein to je rozhodující pro udržení jednotné orientace axonálních neurotubulů, polarita neurotubulů v axonu se smísí.[10] Dendritické proteiny jsou výsledkem nesprávného obchodování s axony.[11]
U nepolarizovaných neuronů obsahují neurity 80% neurotubulů s plus (+) koncem obráceným k terminálu.[Citace je zapotřebí ]
Axonální doprava
Neurotubuly jsou odpovědné za obchodování s intracelulárními materiály. Náklad je transportován motorickými proteiny, které používají neurotubuly jako „stopu“. The axonální transport lze klasifikovat podle rychlosti - rychlé nebo pomalé a podle směru - anterográdní nebo retrográdní.
Rychlá a pomalá axonální doprava
Náklad je přepravován vysokou nebo nízkou rychlostí. Rychlý axonální transport má rychlost 50–500 mm za den, zatímco u pomalého axonálního transportu bylo zjištěno 0,4 mm za den u zlatých rybek, 1–10 mm za den u savčích nervů. Transport nerozpustného proteinu přispívá k rychlému pohybu, zatímco pomalý transport transportuje až 40% - 50% rozpustného proteinu.[12] Rychlost přepravy závisí na typech přepravovaného nákladu. Neurotrofiny, rodina proteinů důležitých pro přežití neuronu, stejně jako organely, jako mitochondrie a endozomy, jsou přepravovány rychlou rychlostí. Naproti tomu strukturní proteiny, jako je tubulin a neurofilamentové podjednotky, jsou transportovány nižší rychlostí. Proteiny, které jsou transportovány z míchy do nohy, mohou trvat cestu až rok.[13]
Anterográdní doprava a retrográdní doprava

Anterográdní doprava označuje přepravu nákladu z minusového (-) konce na plusový (+) konec, zatímco retrográdní doprava je přeprava nákladu v opačném směru. Anterográdní doprava je často doprava z buněčné tělo na periferii neuronu, zatímco retrográdní transport přináší organely a vezikuly pryč od axonového konce do těla buňky.
Anterográdní doprava je regulována kinesiny, třída motorických proteinů. Kinesiny mají dvě domény hlavy, které spolupracují jako nohy - jedna se váže na neurotubuly a další se váže, zatímco první disociuje. Vazba ATP zvyšuje afinitu kinesinů k neurotubulům. Když se ATP váže na jednu hlavovou doménu, bude vyvolána konformační změna v hlavové doméně, což způsobí její těsnou vazbu na neurotubule. Další ATP se poté váže na jinou hlavní doménu, zatímco předchozí ATP je hydrolyzována a hlavní doména je disociována. Proces se opakuje jako cykly, takže kinesiny se pohybují podél neurotubulů společně s organelami a vezikulárními náklady, které nesou.[14]
Retrográdní doprava je regulována dyneiny, také třída motorických proteinů. Sdílí podobné struktury s kinesiny i transportní mechanismus. Transportuje náklad z periferií do těla buňky v neuronech.
Proteiny spojené s neurotubuly

Proteiny spojené s mikrotubuly (MAP) jsou proteiny, které interagují s mikrotubuly vazbou na své tubulinové podjednotky a regulací jejich stability. Tvorba MAP neurotubulů se výrazně liší od mikrotubulů neuronálních buněk.[15] Například MAP typu II se nacházejí výlučně v neuronech a ne v jiných buňkách. Mezi nejvíce studované patří MAP2, a tau.
MAP jsou v neuronální cytoplazmě diferencovaně distribuovány. Jejich distribuce se také liší v různých fázích vývoje neuronu. Juvenilní izoforma MAP2 je přítomna na neurotubulech axonů a dendritů vyvíjejících se neuronů, ale stává se down-regulovaný jak neurony dozrávají. Izoforma MAP2 pro dospělé je obohacena o neurotubuly dendritů a v axonálních neurotubulech prakticky chybí.[16] Naproti tomu tau chybí na neurotubulech dendritů a jeho přítomnost je omezena na axonální neurotubuly. The fosforylace tau na určitých místech je vyžadováno, aby se tau váže na neurotubuly. U zdravého neuronu se tento proces u dendritů významně nevyskytuje, což způsobuje absenci tau na dendritických neurotubulech. Vazba tau různých izoforem a různých úrovní fosforylace reguluje stabilitu neurotubulů. Bylo zjištěno, že neurotubuly neuronů v embryonálním centrálním nervovém systému obsahují více vysoce fosforylovaného tau než u dospělých.[17] Kromě toho je tau odpovědný za svalování neurotubulů.[18]
Mikrotubuly plus proteiny pro sledování konce (+ TIP) jsou MAPy, které se hromadí na plusovém konci mikrotubulů. V neurotubulích + TIP řídí dynamiku neurotubulů, směr růstu a interakci se složkami buněčná kůra. Jsou důležité při rozšiřování neuritů a růst axonů.[19]
Mnoho dalších MAP, které nejsou specifické pro neuron, jako je MAP1B a MAP6, se nacházejí na neurotubulech. Kromě toho interakce mezi aktin a některé MAP poskytují potenciální spojení mezi neurotubuly a aktinová vlákna.[20]
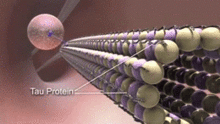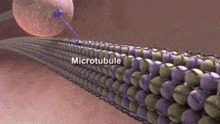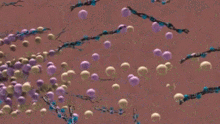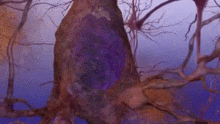
Narušení integrity a dynamiky neurotubulů může interferovat s buněčnými funkcemi, které vykonávají, a způsobit různé neurologické poruchy.
Alzheimerova choroba
v Alzheimerova choroba, hyperfosforylace z tau protein způsobuje disociaci tau z neurotubulů a tau chybné skládání. Agregace nesprávně složených tau forem je nerozpustná neurofibrilární spleti což je charakteristický nález u Alzheimerovy choroby.[21] Tato patologická změna se nazývá tauopatie. Neurotubuly se stanou náchylné k dezintegraci proteiny oddělujícími mikrotubuly, když tau disociuje.[22] Ve výsledku budou narušeny základní procesy v neuronu, jako je axonální transport a nervová komunikace, které tvoří základ neurodegenerace.[23] Předpokládá se, že k rozpadu neurotubulů dochází různými mechanismy v axonech a v dendritech.
Oddělení tau destabilizuje neurotubuly tím, že umožňuje nadměrné odříznutí o katanin, což způsobilo jeho rozpad. Rozpad neurotubulů v axonu narušuje transport mRNA a signálních molekul k terminálu axonu.[22] U dendritů nové důkazy naznačují, že abnormální invaze tau do dendritů způsobuje zvýšenou hladinu dendritů TTLL6 (Tubulin-Tyrosin-Ligase-Like-6), který zvyšuje hladinu polyglutamylace stav neurotubulů v dendritech.[22] Protože spastin vykazuje silnou preferenci pro polyglutamylovaný mikrotubul, dendritické neurotubuly se stávají náchylnými k dezintegraci vyvolané spastinem.[22] Ztráta sítí neurotubulů v dendritech a axonech spolu s tvorbou neurofibrilárních spleti vede ke zhoršení obchodu s důležitými náklady přes buňku, což může nakonec vést k apoptóza.[24]
Lissencephaly

Lissencephaly je vzácný vrozený stav, při kterém mozek ztrácí své záhyby (gyri ) a drážky (sulci ), takže povrch mozku vypadá hladce. Je to způsobeno vadným migrace neuronů.[25] Selhání postmitotických neuronů v dosažení jejich správných pozic vede k tvorbě dezorganizovaného a zesíleného čtyřvrstvého neokortexu místo normálního šestivrstvý neokortex. Závažnost lissencefalie se pohybuje od úplné ztráty mozkových záhybů (agyrie ) k obecnému snížení záhybů kortikolu (pachygyria ).
Neurotubule je ústředním prvkem migračního mechanismu neuronů. Defektní nervová migrace u jedinců postižených lissencefálií je způsobena mutace spojené s geny souvisejícími s neurotubuly, jako je např LIS1 a DCX.[26] LIS1 kóduje adaptorový protein Lis1, který je zodpovědný za stabilizaci neurotubulů během migrace neuronů minimalizací neurotubulární katastrofy. Reguluje také motorický protein dynein, který je zásadní pro translokaci jádra podél neurotubulů. Tato akce pohání soma neuronu dopředu, což je zásadní krok v neuronální migraci.[27] Kromě toho mutace v LIS1 bylo zjištěno, že narušuje jednotnou plus-end-distální polaritu v axonech na zvířecích modelech, což způsobuje chybné frafování dendritických proteinů do axonů.[11] Na druhou stranu, DCX kóduje protein doublecortin který interaguje s Lis1 nad podporou 13 protofilamentové struktury neurotubule.
Periferní neuropatie vyvolaná chemoterapií
Periferní neuropatie vyvolaná chemoterapií je patologická změna v neuronech způsobené narušením dynamiky neurotubulů chemoterapií, projevující se bolestí, necitlivostí, pocitem brnění a svalová slabost v končetinách. Jedná se o nevratný stav, který postihuje přibližně jednu třetinu pacientů s chemoterapií.[28] Inhibitory tubulinu inhibují mitózu v rakovinných buňkách ovlivněním stability a dynamiky mikrotubulů, které tvoří mitotické vřeteno zodpovědný za segregace chromozomů během mitózy potlačování růst nádoru.
Stejné léky však také ovlivňují neurotubuly v neuronech. Vinblastin váže se na volný tubulin a snižuje jejich polymerační kapacitu, čímž podporuje depolymerizaci neurotubulů. Na druhou stranu, paclitaxel váže se na víčko neurotubulů, což brání přeměně tubulinem vázaného GTP na GDP, což je proces, který podporuje depolymerizaci neurotubulů. Pro in vitro neuronů léčených paclitaxelem je narušena polarita neurotubulů, což může způsobit dlouhodobé poškození neuronů. Nadměrná stabilizace neurotubulů navíc narušuje jejich schopnost vykonávat základní buněčné funkce v neuronech.[29]
Viz také
Reference
- ^ „Lékařská definice NEUROTUBULE“. www.merriam-webster.com. Citováno 2019-03-25.
- ^ Lidský nervový systém: struktura a funkce. Noback, Charles R. (Charles Robert), 1916-2009. (6. vydání). Totowa, N.J .: Humana Press. 2005. ISBN 1588290395. OCLC 222291397.CS1 maint: ostatní (odkaz)
- ^ A b Lane NJ, Treherne JE (červenec 1970). "Lanthanové barvení neurotubulů v axonech z ganglií švábů". Journal of Cell Science. 7 (1): 217–31. PMID 4097712.
- ^ A b Neuronová specificita, plasticita a vzory. Moscona, A. A. (Aron Arthur), 1922-2009, Monroy, Alberto, Hunt, R. Kevin. New York: Academic Press. 1982. ISBN 9780080584409. OCLC 276661314.CS1 maint: ostatní (odkaz)
- ^ Cooper, Geoffrey M. (2000). "Mikrotubuly". Buňka: Molekulární přístup. 2. vydání.
- ^ Bear MF, Connors BW, Paradso MA. Neurovědy: zkoumání mozku (3. vyd.). Lippincott Williams & Wilkins. str. 41.
- ^ Marc Kirschner; Mitchison, Tim (listopad 1984). "Dynamická nestabilita růstu mikrotubulů". Příroda. 312 (5991): 237–242. Bibcode:1984 Natur.312..237M. doi:10.1038 / 312237a0. ISSN 1476-4687. PMID 6504138.
- ^ Kwan AC, Dombeck DA, Webb WW (srpen 2008). „Polarizovaná pole mikrotubulů v apikálních dendritech a axonech“. Sborník Národní akademie věd Spojených států amerických. 105 (32): 11370–5. Bibcode:2008PNAS..10511370K. doi:10.1073 / pnas.0805199105. PMC 2496886. PMID 18682556.
- ^ van Beuningen SF, Hoogenraad CC (srpen 2016). "Neuronální polarita: předělávání organizace mikrotubulů". Aktuální názor v neurobiologii. 39: 1–7. doi:10.1016 / j.conb.2016.02.003. PMID 26945466.
- ^ Conde C, Cáceres A (květen 2009). "Sestava, organizace a dynamika mikrotubulů v axonech a dendritech". Recenze přírody. Neurovědy. 10 (5): 319–32. doi:10.1038 / nrn2631. PMID 19377501.
- ^ A b Dubey J, Ratnakaran N, Koushika SP (2015). „Neurodegenerace a dynamika mikrotubulů: smrt tisíckrát. Hranice v buněčné neurovědě. 9: 343. doi:10.3389 / fncel.2015.00343. PMC 4563776. PMID 26441521.
- ^ Grafstein B, McEwen BS, Shelanski ML (červenec 1970). "Axonální transport neurotubulárního proteinu". Příroda. 227 (5255): 289–90. Bibcode:1970Natur.227..289G. doi:10.1038 / 227289a0. PMID 4193613.
- ^ „Jsou mikrotubuly mozkem neuronu“. Jon Lieff, M.D.. 2015-11-29. Citováno 2019-04-10.
- ^ 1958-, Berg, Jeremy M. (Jeremy Mark) (2002). Biochemie. Tymoczko, John L., 1948-, Stryer, Lubert., Stryer, Lubert. (5. vydání). New York: W.H. Freemane. ISBN 0716730510. OCLC 48055706.CS1 maint: číselné názvy: seznam autorů (odkaz)
- ^ Al-Bassam J, Ozer RS, Safer D, Halpain S, Milligan RA (červen 2002). „MAP2 a tau se podélně vážou podél vnějších hřebenů protilátek mikrotubulů“. J. Cell Biol. 157 (7): 1187–96. doi: 10.1083 / jcb.200201048. PMC 2173547. PMID 12082079.
- ^ Dehmelt L, Halpain S (2005). "Rodina MAP2 / Tau proteinů asociovaných s mikrotubuly". Genome Biology. 6 (1): 204. doi:10.1186 / gb-2004-6-1-204. PMC 549057. PMID 15642108.
- ^ Kanemaru K, Takio K, Miura R, Titani K, Ihara Y (květen 1992). „Fosforylace tau typu plodu ve spárovaných spirálovitých vláknech“. Journal of Neurochemistry. 58 (5): 1667–75. doi: 10.1111 / j.1471-4159.1992.tb10039.x. PMID 1560225.
- ^ Mandelkow E, Mandelkow EM (únor 1995). "Mikrotubuly a proteiny spojené s mikrotubuly". Curr. Opin. Cell Biol. 7 (1): 72–81. doi:10.1016/0955-0674(95)80047-6. PMID 7755992.
- ^ Akhmanova A, Hoogenraad CC (únor 2005). "Microtubule plus-end-tracking proteiny: mechanismy a funkce". Současný názor na buněčnou biologii. 17 (1): 47–54. doi:10.1016 / j.ceb.2004.11.001. PMID 15661518.
- ^ Myers, Kenneth A .; Baas, Peter W. (2011), Gallo, Gianluca; Lanier, Lorene M. (eds.), „Interakce mikrotubulů a aktinů během vývoje neuronů“, Neurobiologie aktinu: Od neurulace k synaptické funkci, Advances in Neurobiology, Springer New York, str. 73–96, doi:10.1007/978-1-4419-7368-9_5, ISBN 9781441973689
- ^ Iqbal K, Liu F, Gong CX, Grundke-Iqbal I (prosinec 2010). „Tau u Alzheimerovy choroby a souvisejících tauopatií“. Současný výzkum Alzheimerovy choroby. 7 (8): 656–64. doi:10.2174/156720510793611592. PMC 3090074. PMID 20678074.
- ^ A b C d Jean DC, Baas PW (listopad 2013). „Řeže to dvěma způsoby: ztráta mikrotubulů během Alzheimerovy choroby“. Časopis EMBO. 32 (22): 2900–2. doi:10.1038 / emboj.2013.219. PMC 3831311. PMID 24076651.
- ^ Wang Y, Mandelkow E (leden 2016). "Tau ve fyziologii a patologii". Recenze přírody. Neurovědy. 17 (1): 5–21. doi:10.1038 / nrn.2015.1. PMID 26631930.
- ^ Mudher A, Lovestone S (leden 2002). „Alzheimerova choroba - dělají si tauisté a baptisté konečně ruce?“. Trendy v neurovědách. 25 (1): 22–6. doi:10.1016 / S0166-2236 (00) 02031-2. PMID 11801334.
- ^ Dobyns WB (1987). "Vývojové aspekty lissencefalie a syndromů lissencefalie". Vrozené vady Originální série článků. 23 (1): 225–41. PMID 3472611.
- ^ Mochida GH (září 2009). "Genetika a biologie mikrocefalie a lissencefalie". Semináře z dětské neurologie. 16 (3): 120–6. doi:10.1016 / j.spen.2009.07.001. PMC 3565221. PMID 19778709.
- ^ Tanaka T, Serneo FF, Higgins C, Gambello MJ, Wynshaw-Boris A, Gleeson JG (červen 2004). „Lis1 a funkce dvojitého kortinu s dyneinem zprostředkovávají spojení jádra s centrosomem při migraci neuronů“. The Journal of Cell Biology. 165 (5): 709–21. doi:10.1083 / jcb.200309025. PMC 2172383. PMID 15173193.
- ^ Brown TJ, Sedhom R, Gupta A (únor 2019). „Periferní neuropatie vyvolaná chemoterapií“. JAMA Onkologie. 5 (5): 750. doi:10.1001 / jamaoncol.2018.6771. PMID 30816956.
- ^ Baas PW, Ahmad FJ (říjen 2013). „Beyond taxol: microtubule-based treatment of disease and poran of the nervous system“. Mozek. 136 (Pt 10): 2937–51. doi:10.1093 / brain / awt153. PMC 3784279. PMID 23811322.

