Vřetenové zařízení - Spindle apparatus

v buněčná biologie, vřetenové zařízení (nebo mitotické vřeteno) Odkazuje na cytoskeletální struktura eukaryotické buňky který se tvoří během buněčné dělení oddělit sesterské chromatidy mezi dcerou buňky. To je označováno jako mitotické vřeteno během mitóza, proces, který produkuje geneticky identické dceřiné buňky nebo meiotické vřeteno během redukční dělení buněk, proces, který produkuje gamety s polovičním počtem chromozomy rodičovské buňky.
Kromě chromozomů se vřetenový aparát skládá ze stovek bílkoviny.[1][2] Mikrotubuly tvoří nejhojnější součásti strojního zařízení.
Struktura vřetena

Připevnění mikrotubulů k chromozomům je zprostředkováno kinetochory, které aktivně sledují tvorba vřetena a zabránit předčasnému anafáze počátek. Mikrotubulová polymerace a depolymerace, dynamika hnacího chromozomu. Depolymerizace mikrotubulů generuje napětí v kinetochorech;[3] bipolární připojení sesterských kinetochorů k mikrotubulům vycházejícím z protilehlých pólů buněk spojuje protichůdné síly napětí, srovnávají chromozomy na buněčném rovníku a připravují je pro segregaci na dceřiné buňky. Jakmile je každý chromozom bi-orientovaný, začíná anafáze a kohesin, které páry sesterské chromatidy, je oddělena a umožňuje tranzit přes sesterské chromatidy na opačné póly.
Buněčné vřetenové zařízení zahrnuje vřeteno mikrotubuly, asociované proteiny, které zahrnují kinesin a dynein molekulární motory, kondenzované chromozomy a další centrosomy nebo astry které mohou být přítomny na pólech vřetena v závislosti na typu článku.[4] Vřetenové zařízení je nejasné elipsoid v průřezu a na koncích se zužuje. V široké střední části, známé jako středová zóna vřetena, antiparalelní mikrotubuly jsou spojeny pomocí kinesiny. Na špičatých koncích, známých jako vřetenové póly, jsou mikrotubuly nukleovány centrosomy ve většině zvířecích buněk. Acentrosomální nebo anastrální vřetenům chybí centrosomy nebo astry na pólech vřetena a vyskytují se například během samičí meiózy u většiny zvířat.[5] V tomto případě je Ran GTP gradient hlavním regulátorem organizace a montáže vřetenových mikrotubulů. v houby, mezi nimi se tvoří vřetena těla vřetenových pólů vložený do jaderný obal, který se během mitózy nerozkládá.
Proteiny asociované s mikrotubuly a dynamika vřetena
Dynamické prodlužování a zkracování vřetenových mikrotubulů procesem známým jako dynamická nestabilita Určuje do značné míry tvar mitotického vřetena a podporuje správné zarovnání chromozomů ve středové zóně vřetena. Proteiny spojené s mikrotubuly (MAP) se spojují s mikrotubuly ve střední zóně a vřetenových pólech, aby regulovaly jejich dynamiku. γ-tubulin je specialista tubulin varianta, která se sestavuje do kruhového komplexu zvaného γ-TuRC který nukleaty polymerace α / β tubulinu heterodimery do mikrotubulů. Nábor γ-TuRC do pericentrosomální oblasti stabilizuje minotvorce mikrotubulů a ukotví je poblíž centrum organizující mikrotubuly. Protein Augmin spojený s mikrotubuly působí ve spojení s γ-TURC k nukleaci nových mikrotubulů z existujících mikrotubulů.[6]
Rostoucí konce mikrotubulů jsou chráněny proti katastrofě působením proteinů sledujících plus-endové mikrotubuly (+ TIP), aby se podpořila jejich asociace s kinetochory v střední zóně. CLIP170 Bylo prokázáno, že lokalizuje blízko plusových konců mikrotubulů v buňkách HeLa [7] a akumulovat se v kinetochorech během prometafáze.[8] Ačkoli způsob, jakým CLIP170 rozpoznává kladné konce, zůstává nejasný, ukázalo se, že jeho homology chrání před katastrofou a podporují záchranu,[9][10] navrhování role CLIP170 při stabilizaci kladných konců a případně zprostředkování jejich přímého připojení ke kinetochorům.[11] CLIP asociované proteiny jako CLASP1 Bylo také prokázáno, že u lidí se lokalizuje na plus-konce a vnější kinetochore a také moduluje dynamiku kinetochoreových mikrotubulů (Maiato 2003). Homlogy CLASP v Drosophila, Xenopus, a droždí jsou vyžadovány pro správnou montáž vřetena; u savců CLASP1 a CLASP2 přispívají ke správnému sestavení vřetena a dynamice mikrotubulů v anafázi.[12] Plus-end polymerace může být dále moderována proteinem EB1, který přímo váže rostoucí konce mikrotubulů a koordinuje vazbu dalších + TIP.[13][14]
Proti působení těchto proteinů stabilizujících mikrotubuly se staví řada faktorů depolymerizujících mikrotubuly, které umožňují dynamickou remodelaci mitotického vřeténka na podporu kongresu chromozomů a dosažení bipolarita. The kinesin -13 nadrodina MAP obsahuje třídu motoricky orientovaných plus-endových proteinů s přidruženou aktivitou depolymerace mikrotubulů, včetně dobře prostudovaného savčího MCAK a Xenopus XKCM1. MCAK se lokalizuje na rostoucí špičky mikrotubulů na kinetochorech, kde může vyvolat katastrofu v přímé konkurenci se stabilizační + TIP aktivitou.[15] Tyto proteiny využívají energii Hydrolýza ATP vyvolat destabilizující konformační změny ve struktuře protofilamentů, které způsobují uvolňování kinesinu a depolymeraci mikrotubulů.[16] Ztráta jejich aktivity má za následek četné mitotické vady.[15] Mezi další proteiny destabilizující mikrotubuly patří Op18 /stathmin a katanin které mají roli v remodelaci mitotického vřetene a v podpoře segregace chromozomů během anafáze.[17]
Činnosti těchto MAP jsou pečlivě regulovány, aby se během montáže vřetena udržovala správná dynamika mikrotubulů, přičemž mnoho z těchto proteinů slouží jako Aurora a Kináza podobná pólu substráty.[17][18]
Organizace vřetenového aparátu
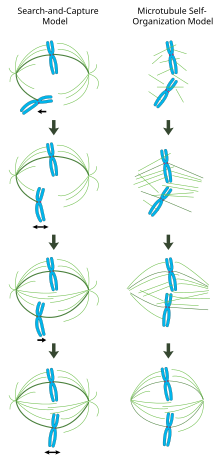
Ve správně vytvořeném mitotickém vřetenu jsou bi-orientované chromozomy zarovnány podél rovníku buňky s vřetenovými mikrotubuly orientovanými zhruba kolmo na chromozomy, jejichž plusové konce jsou uloženy v kinetochorech a jejich minusové konce zakotveny u pólů buňky. Přesná orientace tohoto komplexu je nutná pro zajištění přesné segregace chromozomů a pro určení roviny dělení buněk. Zůstává však nejasné, jak je vřeteno organizováno. Pole převládají dva modely, které jsou synergické a nevylučují se. V model vyhledávání a snímání, je vřeteno převážně organizováno pólovou separací centrozomálních mikrotubulárních organizačních center (MTOC). Vřetenové mikrotubuly vycházejí z centrosomů a „vyhledávají“ kinetochory; když se vážou na kinetochore, stabilizují se a vyvíjejí napětí na chromozomy. Alternativně vlastní montáž model, mikrotubuly procházejí acentrosomální nukleací mezi kondenzovanými chromozomy. Omezeni buněčnými rozměry, postranními asociacemi s antiparalelními mikrotubuly prostřednictvím motorických proteinů a koncovými vazbami na kinetochory, mikrotubuly přirozeně přijímají strukturu podobnou vřetenu s chromozomy zarovnanými podél buněčného rovníku.
Model „hledání a zachycení“ zprostředkovaný centrosomem
V tomto modelu jsou mikrotubuly nukleovány v organizačních centrech mikrotubulů a procházejí rychlým růstem a katastrofou, aby „prohledaly“ cytoplazmu kinetochory. Jakmile naváží kinetochor, stabilizují se a sníží se jejich dynamika. Nově monoorientovaný chromozom osciluje v prostoru poblíž pólu, ke kterému je připojen, dokud mikrotubul z opačného pólu neváže sesterský kinetochor. Toto druhé připojení dále stabilizuje připojení kinetochore k mitotickému vřetenu. Postupně je bi-orientovaný chromozom tažen směrem ke středu buňky, dokud není napětí mikrotubulů vyváženo na obou stranách centroméra; kongresovaný chromozom pak osciluje na metafázové desce, dokud anafázový nástup neuvolní soudržnost sesterských chromatidů.
V tomto modelu jsou centra pro organizaci mikrotubulů lokalizována na póly buněk, jejich separace je řízena polymerací mikrotubulů a „klouzáním“ antiparalelních vřetenových mikrotubulů vůči sobě navzájem na středové zóně vřetena zprostředkovanou bipolárními, na konec zaměřenými kinesiny.[19][20] Tyto klouzavé síly mohou odpovídat nejen za oddělení pólů vřetena na počátku mitózy, ale také k prodloužení vřetene během pozdní anafáze.
Chromatinem zprostředkovaná samoorganizace mitotického vřetena
Na rozdíl od mechanismu hledání a zachycení, ve kterém centrosomy do značné míry diktují organizaci mitotického vřetene, tento model navrhuje, aby mikrotubuly byly nukleotizovány acentrosomálně blízko chromozomů a spontánně se shromažďovaly do antiparalelních svazků a přijaly strukturu podobnou vřetenu.[21] Klasické experimenty od Healda a Karsentiho ukazují, že kolem mitochondrií potažených DNA inkubovaných v DNA se tvoří funkční mitotická vřetena a jádra. Xenopus vaječné extrakty a že bipolární pole mikrotubulů se tvoří v nepřítomnosti centrosomů a kinetochorů.[22] Bylo také prokázáno, že laserová ablace centrosomů v buňkách obratlovců neinhibuje ani vřetenovou sestavu, ani segregaci chromozomů.[23] V tomto schématu jsou tvar a velikost mitotického vřetene funkcí biofyzikálních vlastností zesíťujících motorových proteinů.[24]
Nukleace mikrotubulů zprostředkovaná chromatiny pomocí gradientu Ran GTP
Guaninový nukleotidový výměnný faktor pro malou GTPázu Běžel (Regulátor kondenzace chromozomů 1 nebo RCC1 ) je připojen k nukleosomům prostřednictvím jádrových histonů H2A a H2B.[25] Tedy, gradient GTP-vázaného Ran je generován kolem okolí mitotického chromatinu. Skleněné kuličky potažené RCC1 indukují nukleaci mikrotubulů a tvorbu bipolárního vřetene Xenopus extrakty z vajec, což ukazuje, že samotný gradient Ran GTP je dostatečný pro sestavení vřetena.[26] Gradient spouští uvolňování vřetenových montážních faktorů (SAF) z inhibičních interakcí prostřednictvím transportních proteinů importin β / α. Nenavázané SAF pak podporují mikrotubulární nukleaci a stabilizaci kolem mitotického chromatinu a vřetenová bipolarita je organizována mikrotubulovými motorickými proteiny.[27]
Regulace montáže vřetena
Sestavení vřetena je do značné míry regulováno fosforylačními událostmi katalyzovanými mitotickými kinázami. Komplexy kináz závislých na cyklinu (CDK) jsou aktivovány mitotickými cykliny, jejichž translace se během mitózy zvyšuje. CDK1 (také nazývaný CDC2) je považován za hlavní mitotickou kinázu v savčích buňkách a je aktivován cyklinem B1. Aurora kinázy jsou vyžadovány pro správné sestavení a oddělení vřetena.[28] Aurora A asociuje s centrosomy a předpokládá se, že reguluje mitotický vstup. Aurora B. je členem komplexu chromozomálních cestujících a zprostředkovává připojení chromozomů a mikrotubulů a soudržnost sesterských chromatid. Zvláště kináza podobná pólu, známá také jako PLK PLK1 hraje důležitou roli v údržbě vřetene regulací dynamiky mikrotubulů.[29]
Struktura mitotických chromozomů
Na konci replikace DNA sesterské chromatidy jsou spojeny dohromady v amorfní hmotě zamotané DNA a proteinu, které by bylo prakticky nemožné rozdělit do každé dceřiné buňky. Aby se zabránilo tomuto problému, mitotický vstup spouští dramatickou reorganizaci duplikovaného genomu. Sesterské chromatidy jsou odděleny a rozděleny jeden od druhého. Chromozomy se také zkracují na délku, až 10 000krát v živočišných buňkách,[30] v procesu zvaném kondenzace. Kondenzace začíná v profázi a chromozomy jsou maximálně zhutněny do tyčkovitých struktur v době, kdy jsou vyrovnány uprostřed vřetena v metafázi. To dává mitotickým chromozomům klasický tvar „X“ viděný v karyotypy, s každou kondenzovanou sesterskou chromatidou spojenou podél jejich délky pomocí kohesin bílkoviny a spojené, často blízko centra, na centroméra.[30][31][32]
Zatímco tato dynamická přeskupení jsou životně důležitá pro zajištění přesné a vysoce věrné segregace genomu, naše chápání struktury mitotických chromozomů zůstává do značné míry neúplné. Bylo identifikováno několik konkrétních molekulárních hráčů: Topoizomeráza II používá hydrolýzu ATP k katalyzování dekantace spletenců DNA, což podporuje rozlišení sesterských chromatid.[33] Kondenziny jsou komplexy s 5 podjednotkami, které také používají hydrolýzu ATP k podpoře kondenzace chromozomů.[34] Experimenty v Xenopus vaječné extrakty také implikovaly linker Histon H1 jako důležitý regulátor zhutňování mitotických chromozomů.[35]
Kontrolní bod montáže mitotického vřetena
Dokončení formování vřetena je zásadním přechodovým bodem v buněčném cyklu zvaném kontrolní bod sestavy vřetena. Pokud chromozomy nejsou řádně připojeny k mitotickému vřetenu v době tohoto kontrolního bodu, nástup anafáze bude zpožděn.[36] Může dojít k selhání tohoto kontrolního bodu sestavy vřetena aneuploidie a může se podílet na stárnutí a tvorbě rakoviny.[37]
Orientace vřetenového zařízení

Orientace buněčného dělení má zásadní význam pro tkáňovou architekturu, buněčné osudy a morfogenezi. Buňky mají tendenci se dělit podél své dlouhé osy podle tzv Hertwigovo pravidlo. Osa buněčného dělení je určena orientací vřetenového zařízení. Buňky se dělí podél linie spojující dva centrosomy vřetenového aparátu. Po vytvoření prochází vřetenové zařízení uvnitř buňky rotací. Astrální mikrotubuly pocházející z centrosomů dosáhnou buněčné membrány, kde jsou přitahovány ke konkrétním kortikálním vodítkům. In vitro, je distribuce kortikálních stop nastavena lepicím vzorem.[38] In vivo narážky polarity jsou určeny lokalizací Tricelulární spojení lokalizován na vrcholech buněk.[39] Prostorové rozdělení kortikálních stop vede k silovému poli, které určuje konečnou orientaci vřetenového aparátu a následnou orientaci buněčného dělení.
Viz také
Reference
- ^ C. E. Walczak; R. Heald (2008). "Mechanismy montáže a funkce mitotického vřetena". International Review of Cytology. 265: 111–158. doi:10.1016 / s0074-7696 (07) 65003-7. ISBN 9780123743329. PMID 18275887.
- ^ Helmke KJ, Heald R, Wilbur JD (2013). "Souhra mezi architekturou vřetena a funkcí" (PDF). Int. Rev. Cell Mol. Biol. International Review of Cell and Molecular Biology. 306: 83–125. doi:10.1016 / B978-0-12-407694-5.00003-1. ISBN 9780124076945. PMID 24016524.
- ^ E. Nogales; V. H. Ramey (1. listopadu 2009). „Strukturně-funkční vhledy do kvasinkového komplexu Dam1 kinetochore“. J Cell Sci. 122 (21): 3831–3836. doi:10.1242 / jcs.004689. PMC 2773187. PMID 19889968.
- ^ Campbell, Neil A .; Jane B. Reece (2005). Biology, 7. vydání. San Francisco: Benjamin Cummings. str. 221–224. ISBN 0-8053-7171-0.
- ^ Manandhar Gf; Schatten H; Sutovsky P (2005). "Redukce centrozomu během gametogeneze a její význam". Biol. Reprod. 72 (1): 2–13. doi:10.1095 / biolreprod.104.031245. PMID 15385423. S2CID 37305534.
- ^ Petry S a kol. (2013). „Rozvětvená mikrotubulová nukleace ve vaječných extraktech Xenopus zprostředkovaná augminem a TPX2“. Buňka. 152 (4): 768–777. doi:10.1016 / j.cell.2012.12.044. PMC 3680348. PMID 23415226.
- ^ J.E. Rickard; T.E. Kreis (1990). „Identifikace nového proteinu vázajícího mikrotubuly vázaného na nukleotidy v buňkách HeLa“. J Cell Biol. 110 (5): 1623–1633. doi:10.1083 / jcb.110.5.1623. PMC 2200191. PMID 1970824.
- ^ D. Dujardin; U.I. Wacker; A. Moreau; T.A. Schroer; J.E. Rickard; J.R. DeMey (1998). „Důkazy o roli CLIP-170 při zavádění srovnávání chromosomů metafáze“. J Cell Biol. 141 (4): 849–862. doi:10.1083 / jcb.141.4.849. PMC 2132766. PMID 9585405.
- ^ D. Brunner; P. Nurse (2000). „Tip1p typu CLIP-170 prostorově organizuje mikrotubulární dynamiku ve štěpných kvasnicích“. Buňka. 102 (5): 695–704. doi:10.1016 / S0092-8674 (00) 00091-X. PMID 11007487. S2CID 11948950.
- ^ Y.A. Komarova; TAK JAKO. Kojima; et al. (2002). „Cytoplazmatické linkerové proteiny podporují záchranu mikrotubulů in vivo“. J Cell Biol. 159 (4): 589–599. doi:10.1083 / jcb.200208058. PMC 2173097. PMID 12446741.
- ^ S. Goldstone; C. Reyes; G. Gay; T. Courthéoux; M. Dubarry; et al. (2010). „Tip1 / CLIP-170 protein je vyžadován pro správný pohyb chromozomu pólem ve štěpných kvasnicích“. PLOS ONE. 5 (5): e10634. doi:10.1371 / journal.pone.0010634. PMC 2869355. PMID 20498706.
- ^ A.L. Pereira; AJ. Pereira; A.R.R. Maia; et al. (1. října 2006). „Savčí CLASP1 a CLASP2 spolupracují na zajištění mitotické věrnosti regulací funkce vřetena a kinetochoru“. Mol Biol Cell. 17 (10): 4526–4542. doi:10,1091 / mbc.E06-07-0579. PMC 1635371. PMID 16914514.
- ^ A. Achmanová; M.O. Steinmetz (duben 2008). „Sledování konců: dynamická proteinová síť řídí osud špiček mikrotubulů“. Nat Rev Mol Cell Biol. 9 (4): 309–322. doi:10.1038 / nrm2369. PMID 18322465. S2CID 24977579.
- ^ J.S. Tirnauer; S. Grego; E.D. Losos; T.J. Mitchison (1. října 2002). „Interakce EB1-mikrotubulů ve výtažcích z vajec Xenopus: Role EB1 ve stabilizaci mikrotubulů a mechanismy cílení na mikrotubuly“. Mol Biol Cell. 13 (10): 3614–3626. doi:10.1091 / mbc.02-04-0210. PMC 129970. PMID 12388761.
- ^ A b ME Tanenbaum; R.H. Medema; A. Achmanová (2011). "Regulace lokalizace a aktivity mikrotubulové depolymerázy MCAK". Bioarchitektura. 1 (2): 80–87. doi:10,4161 / bioa.1.2.15807. PMC 3158623. PMID 21866268.
- ^ H. Niederstrasser; H. Salehi-Had; E.C. Gan; C. Walczak; E. Nogales (2002). „XKCM1 působí na jediné protofilamenty a vyžaduje C-konec tubulinu“. J Mol Biol. 316 (3): 817–828. doi:10.1006 / jmbi.2001.5360. PMID 11866534.
- ^ A b H. Maiato; P Sampaio; C.E. Sunkel (2004). "Proteiny asociované s mikrotubuly a jejich základní role během mitózy". Int Rev Cytol. International Review of Cytology. 241: 53–153. doi:10.1016 / S0074-7696 (04) 41002-X. hdl:10216/53621. ISBN 9780123646453. PMID 15548419.
- ^ R. Tournebize; A. Popov; K. Kinoshita; AJ. Ashford; et al. (2000). „Řízení dynamiky mikrotubulů antagonistickými aktivitami XMAP215 a XKCM1 ve vaječných extraktech Xenopus“. Nat Cell Biol. 2 (1): 13–19. doi:10.1038/71330. PMID 10620801. S2CID 10732643.
- ^ J. McIntosh; SC Landis (1971). "Distribuce vřetenových mikrotubulů během mitózy v kultivovaných lidských buňkách". J Cell Biol. 49 (2): 468–497. doi:10.1083 / jcb.49.2.468. PMC 2108320. PMID 19866774.
- ^ D.J. Ostrý; K.L. McDonald; H.M. Hnědý; et al. (1999). „Bipolární kinesin, CLP61F, zesíťuje mikrotubuly ve svazcích interpolárních mikrotubulů embryonálních mitotických vřeten Drosophila“. J Cell Biol. 144 (1): 125–138. doi:10.1083 / jcb.144.1.125. PMC 2148119. PMID 9885249.
- ^ Hall A.; S.A. Endow (2009). „Sestava analogového vřetena: matematický model“. Biophys J.. 97 (8): 2191–2201. doi:10.1016 / j.bpj.2009.08.008. PMC 2764103. PMID 19843451.
- ^ R. Heald; R. Tournebize; et al. (1996). „Samoorganizace mikrotubulů do bipolárních vřeten kolem umělých chromozomů ve výtažcích z vajec Xenopus“. Příroda. 382 (6590): 420–425. doi:10.1038 / 382420a0. PMID 8684481. S2CID 4238425.
- ^ A. Khodjakov; R.W.Cole; B.R. Oakley; C.L. Rieder (2000). "Tvorba mitotického vřetena u obratlovců nezávislá na centrozomu". Curr Biol. 10 (2): 59–67. doi:10.1016 / S0960-9822 (99) 00276-6. PMID 10662665. S2CID 9976687.
- ^ K.S. Burbank; T.J. Mitchison; DS Fisher (2007). "Modely s posuvem a klastrem pro montáž vřetena". Curr Biol. 17 (16): 1373–1383. doi:10.1016 / j.cub.2007.07.058. PMID 17702580.
- ^ Makde R, England J, Yennawar H, Tan S (2010). "Struktura RCC1 chromatinového faktoru navázaného na jádrovou částici nukleosomu". Příroda. 467 (7315): 562–566. doi:10.1038 / nature09321. PMC 3168546. PMID 20739938.
- ^ Halpin D, Kalab P, Wang J, Weis K, Heald R (2011). "Mitotická sestava vřetena kolem korálků potažených RCC1 ve vaječných extraktech Xenopus". PLOS Biol. 9 (12): e1001225. doi:10.1371 / journal.pbio.1001225. PMC 3246454. PMID 22215983.
- ^ Fu J, Jiang Q, Zhang C (2010). "Koordinace událostí buněčného cyklu spuštěnou GTPázou". Přírodní výchova. 3 (9): 32.
- ^ A.R. Barr; F. Gergely (2007). „Aurora A: Tvůrce a rozbíječ tyčí vřetena“. J Cell Sci. 120 (17): 2987–2996. doi:10.1242 / jcs.013136. PMID 17715155.
- ^ Peters, U., J. Cherian; et al. (2006). „Sondování prostoru fenotypového dělení buněk a funkce kinázy podobné pólu pomocí malých molekul“. Nat Chem Biol. 2 (11): 618–26. doi:10.1038 / nchembio826. PMID 17028580. S2CID 22213611.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ A b Morgan DO: The Cell Cycle: Principles of Control (Primers inBiology) London: New Science Press Ltd; 2007: 297. ISBN 978-0-9539181-2-6
- ^ Belmont AS (2010). „Organizace velkého rozsahu chromatinu: dobrá, překvapivá a stále matoucí“. Curr Opin Cell Biol. 26: 69–78. doi:10.1016 / j.ceb.2013.10.002. PMC 3927141. PMID 24529248.
- ^ Marko, JF. Mitotický chromozom: struktura a mechanika. 2012. Organizace a funkce genomu v buněčném jádru. Wiley-VCH, Ch. 18, 449-485. doi:10.1002 / 9783527639991.ch18
- ^ Champoux JJ (2001). „DNA TOPOISOMERASES: Structure, Function, and Mechanism“. Annu Rev Biochem. 70 (1): 369–413. doi:10,1146 / annurev.biochem.70.1.369. PMID 11395412.
- ^ Hirano T (2012). "Kondenziny: univerzální organizátory chromozomů s různými funkcemi". Genes Dev. 26 (15): 1659–1678. doi:10.1101 / gad.194746.112. PMC 3418584. PMID 22855829.
- ^ Maresca TJ, Freedman BS, Heald R (2005). „Histon H1 je nezbytný pro architekturu a segregaci mitotických chromozomů ve vaječných extraktech z Xenopus laevis“. J. Cell Biol. 169 (6): 859–69. doi:10.1083 / jcb.200503031. PMC 2171634. PMID 15967810.
- ^ Raven, Peter H .; Ray F. Evert; Susan E. Eichhorn (2005). Biology of Plants, 7. vydání. New York: W.H. Freeman and Company Publishers. p. 59. ISBN 0-7167-1007-2.
- ^ Baker DJ, Chen J, van Deursen JM (2005). „Mitotický kontrolní bod v rakovině a stárnutí: co nás myši naučily?“. Curr. Opin. Cell Biol. 17 (6): 583–9. doi:10.1016 / j.ceb.2005.09.011. PMID 16226453.
- ^ Thery M, Jimenez-Dalmaroni A, Racine V, Bornens M, Julicher F (2007). "Experimentální a teoretické studium orientace mitotického vřetena". Příroda. 447 (7143): 493–6. doi:10.1038 / nature05786. PMID 17495931. S2CID 4391685.
- ^ Bosveld F, Markova O, Guirao B, Martin C, Wang Z, Pierre A, Balakireva M, Gaugue I, Ainslie A, Christophorou N, Lubensky DK, Minc N, Bellaïche Y (2016). „Epiteliální tricelulární křižovatky fungují jako senzory mezifázového tvaru buněk k orientaci mitózy“. Příroda. 530 (7591): 496–8. doi:10.1038 / příroda16970. PMC 5450930. PMID 26886796.
externí odkazy
 Média související s Vřetenové zařízení na Wikimedia Commons
Média související s Vřetenové zařízení na Wikimedia Commons
