Kyselina meldrumsová - Meldrums acid - Wikipedia
 | |
| Jména | |
|---|---|
| Název IUPAC 2,2-dimethyl-1,3-dioxan-4,6-dion | |
| Ostatní jména Isopropylidenmalonát | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.016.358 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C6H8Ó4 | |
| Molární hmotnost | 144.126 g · mol−1 |
| Bod tání | 94 až 95 ° C (201 až 203 ° F; 367 až 368 K) (rozkládá se)[1] |
| Kyselost (strK.A) | 4.97 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
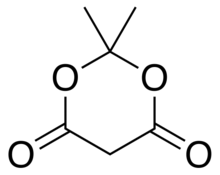
Meldrumova kyselina nebo 2,2-dimethyl-1,3-dioxan-4,6-dion je organická sloučenina se vzorcem C
6H
8Ó
4. Své molekula má heterocyklický jádro se čtyřmi uhlík a dva kyslík atomy; vzorec lze také zapsat jako [−O− (C (CH
3)
2) −O− (C = O) - (CH
2) - (C = O) -].
Je to krystalická bezbarvá pevná látka, těžce rozpustná ve vodě. Rozkládá se při zahřívání s uvolňováním oxid uhličitý a aceton.[2][3]
Vlastnosti
Kyselost
Sloučenina může snadno ztratit vodíkový iont z methylen živel CH
2 v kruhu (uhlík 5); který vytváří dvojnou vazbu mezi ním a jedním ze sousedních uhlíků (číslo 4 nebo 6) a záporný náboj v odpovídajícím kyslíku. Výsledný anion [C
6H
7Ó
4]− je stabilizován rezonance mezi těmito dvěma alternativami, takže dvojná vazba je přemístěn a každý kyslík v karbonyly má formální náboj −1/2.

The ionizační konstanta pK.A je 4,97; díky čemuž se chová jako monobázická kyselina i když obsahuje ne karboxylová kyselina skupiny.[2] V této a dalších vlastnostech se sloučenina podobá dimedone a kyselina barbiturová. Přestože dimedon existuje v roztoku převážně jako mono-enol tautomer, Meldrumova kyselina je téměř úplně jako diketon formulář.[2]
Neobvykle vysoká kyselost této sloučeniny byla dlouho považována za anomální - je o 8 řádů kyselější než blízce příbuzná sloučenina dimethyl malonát. V roce 2004 Ohwada a spolupracovníci zjistili, že konformační struktura sloučeniny minimalizující energii umisťuje alfa proton σCH okružní ve správné geometrii zarovnat s π*CO, takže základní stav představuje neobvykle silnou destabilizaci vazby CH.[4]
Příprava
Originální syntéza
Sloučenina byla nejprve vyrobena Meldrum a kondenzační reakce acetonu s kyselina mallonová v anhydrid kyseliny octové a kyselina sírová.[3]

Alternativní syntézy
Jako alternativu k původní přípravě lze Meldrumovu kyselinu syntetizovat z kyseliny malonové, isopropenylacetát (an enol derivát acetonu) a katalytická kyselina sírová.
Třetí cestou je reakce suboxid uhlíku C
3Ó
2 s acetonem v přítomnosti kyselina šťavelová.[2]
Použití
Jako kyselina mallonová a jeho esterové deriváty a další 1,3-dikarbonylové sloučeniny „Meldrumova kyselina může sloužit jako reaktant pro různé látky nukleofilní reakce.
Alkylace a acylace
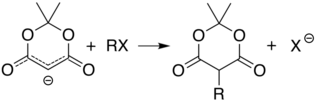
Kyselost uhlíku 5 (mezi dvěma karbonylovými skupinami) umožňuje jednoduchou alkylace a acylace Meldrumovy kyseliny v této poloze. Například, deprotonace a reakce s jednoduchým alkylhalogenid (R-Cl) připojuje alkylovou skupinu (R−) na této pozici:
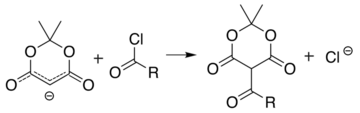
Analogická reakce s acylchlorid (R− (C = O) -Cl) připojuje acyl (R− (C = O) -) namísto:
Tyto dvě reakce umožňují, aby Meldrumova kyselina sloužila jako výchozí lešení pro syntézu mnoha různých struktur s různými funkčními skupinami. S alkylovanými produkty lze dále manipulovat za vzniku různých amidových a esterových sloučenin. Zahřívání acylového produktu v přítomnosti alkoholu vede k výměně esteru a dekarboxylace v procesu podobném syntéza mallonového esteru. Reaktivní povaha cyklického diesteru umožňuje dobrou reaktivitu i pro tak omezené alkoholy t-butanol.[5] Ketoestery tohoto typu jsou užitečné v Knorrova syntéza pyrrolu.
Syntéza ketenů
Při teplotách vyšších než 200 ° C[6] Meldrumova kyselina prochází a pericyklický reakce, která se uvolní aceton a oxid uhličitý a produkuje vysoce reaktivní keten sloučenina:[7]

Tyto keteny lze izolovat za použití blesková vakuová pyrolýza (FVP). Keteny jsou vysoce elektrofilní a mohou podléhat adiční reakce s jinými chemikáliemi. S tímto přístupem je možné vytvářet nové vazby, kruhy, amidy, estery a kyseliny:
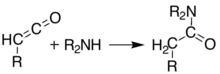
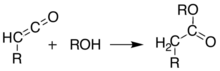

Alternativně lze pyrolýzu provádět v roztoku, aby se získaly stejné výsledky bez izolace ketenu, v a reakce v jedné nádobě. Díky schopnosti vytvářet takové rozmanité produkty je Meldrumova kyselina velmi užitečným činidlem pro syntetické chemiky.[8][9][10]
Dějiny

Sloučenina je pojmenována po Andrew Norman Meldrum který ohlásil jeho syntézu v roce 1908.[3] Chybně identifikoval její strukturu jako β-lakton z Kyselina β-hydroxyizopropylmalonová; správná struktura, bislakton z 1,3-dioxan bylo hlášeno v roce 1948.[11]
Reference
- ^ „Meldrumova kyselina“. Index Merck. 14. edice. Výzkumné laboratoře Merck. 2006. s. 1005. ISBN 978-0-911910-00-1.
- ^ A b C d McNab, Hamish (1978). „Meldrumova kyselina“. Recenze chemické společnosti. 7: 345–358. doi:10.1039 / CS9780700345.
- ^ A b C Norman Meldrum, Andrew (1908). „Kyselina β-laktonová z acetonu a kyseliny malonové“. Journal of the Chemical Society, Transactions. 93: 598–601. doi:10.1039 / CT9089300598.
- ^ Nakamura, satoshi; Hirao, Hajime; Ohwada, Tomohiko (2004). „Odůvodnění kyselosti Meldrumovy kyseliny. Konzistentní vztah kyselin C-H k vlastnostem lokalizovaného reaktivního orbitálu“. J. Org. Chem. 69 (13): 4309–4316. doi:10.1021 / jo049456f. PMID 15202884.
- ^ Oikawa, Yuji; Sugano, Kiyoshi; Yonemitsu, Osamu (1978). „Meldrumova kyselina v organické syntéze. 2. Obecná a všestranná syntéza β-ketoesterů“. J. Org. Chem. 43 (10): 2087–2088. doi:10.1021 / jo00404a066.
- ^ Gaber, Abd El-Aal M .; McNab, Hamish (2001). „Syntetické aplikace pyrolýzy derivátů kyseliny Meldrumové“. Syntéza. 2001 (14): 2059–2074. doi:10.1055 / s-2001-18057.
- ^ Dumas, Aaron M .; Fillion, Eric (2009). „Meldrum's Acids and 5-Alkylidene Meldrum's Acids in Catalytic Carbon-Carbon Bond-Forming Processes“. Acc. Chem. Res. 43 (3): 440–454. doi:10.1021 / ar900229z.
- ^ Oikawa, Yuji; Hirasawa, Hitoshi; Yonemitsu, Osamu (1978). „Meldrumova kyselina v organické syntéze. 1. Praktická syntéza ethyl indolepropionátů v jedné nádobě“. Čtyřstěn dopisy. 19 (20): 1759–1762. doi:10.1016/0040-4039(78)80037-9.
- ^ Lipson, Victoria V .; Gorobets, Nikolay Yu. (2009). „Sto let Meldrumovy kyseliny: Pokroky v syntéze pyridinu a derivátů pyrimidinu“. Mol. Potápěči. 13 (4): 399–419. doi:10.1007 / s11030-009-9136-x. PMID 19381852.
- ^ Bonifácio, Vasco D. B. (2004). „Meldrumova kyselina“. Synlett. 2004 (9): 1649–1650. doi:10.1055 / s-2004-829539.
- ^ Davidson, David; Bernhard, Sidney A. (1948). "Struktura předpokládané Meldrumovy kyseliny β-laktonové". Journal of the American Chemical Society. 70 (10): 3426–3428. doi:10.1021 / ja01190a060. PMID 18891879.
Další čtení
- Gerencsér, János; Dormán, György; Darvas, Ferenc (2006). „Kyselina Meldrumova ve vícesložkových reakcích: aplikace na kombinatorickou a diverzitně orientovanou syntézu“. QSAR a kombinatorická věda. 25 (5–6): 439–448. doi:10.1002 / qsar.200540212.
- Ivanov, Andrey S. (2008). „Kyselina Meldrumova a příbuzné sloučeniny při syntéze přírodních produktů a analogů“. Chem. Soc. Rev. 37 (4): 789–811. doi:10.1039 / B716020H.
- Kidd, Hamish (29. října 2008). „Meldrumova kyselina“. Chemický svět: 35–36.
