Hydrogenuhličitan hořečnatý - Magnesium bicarbonate - Wikipedia
 | |
| Jména | |
|---|---|
| Název IUPAC Hydrogenuhličitan hořečnatý | |
| Ostatní jména Hydrogenuhličitan hořečnatý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.016.582 |
| Číslo E. | E504 (ii) (regulátory kyselosti, ...) |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| Vlastnosti | |
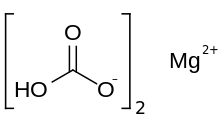
| Mg (HCO3)2 | |
| Molární hmotnost | 146,34 g / mol |
| 0,077 g / (100 ml) | |
| Související sloučeniny | |
jiný kationty | Hydrogenuhličitan vápenatý |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Hydrogenuhličitan hořečnatý nebo hydrogenuhličitan hořečnatý, Mg (HCO3 )2, je hydrogenuhličitan sůl hořčík. Může být vytvořen reakcí zředěných roztoků kyselina uhličitá (jako seltzer voda ) a hydroxid hořečnatý (magnéziové mléko).
Může být připraven syntézou Octan hořečnatý a Hydrogenuhličitan sodný Mg (CH3COO) 2 + 2NaHCO3 = Mg (HCO3) 2 + 2CH3COONa
Hydrogenuhličitan hořečnatý existuje pouze ve vodném roztoku. Hořčík netvoří pevný hydrogenuhličitan jako lithium. K jeho výrobě se suspenze hydroxidu hořečnatého zpracuje tlakem oxid uhličitý, který vyrábí roztok hydrogenuhličitanu hořečnatého:[1]
- Mg (OH)2 + 2 CO2 → Mg (HCO3)2
Sušení výsledného roztoku způsobí hydrogenuhličitan hořečnatý rozložit, poddajný uhličitan hořečnatý, oxid uhličitý a voda:
- Mg2+ + 2 HCO3− → MgCO3 + CO2 + H2Ó
Reference
- ^ Margarete Seeger; Walter Otto; Wilhelm Flick; Friedrich Bickelhaupt; Otto S. Akkerman. "Sloučeniny hořčíku". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a15_595.pub2.
