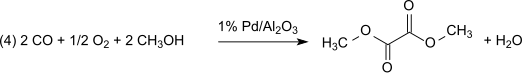Dimethyloxalát - Dimethyl oxalate
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Dimethyloxalát | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.008.231 |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C4H6Ó4 | |
| Molární hmotnost | 118.088 g · mol−1 |
| Vzhled | Bílé krystaly |
| Bod tání | 53 až 55 ° C (326 až 328 K)[1] |
| Bod varu | 166 až 167 ° C (331 až 333 ° F; 439 až 440 K)[1] |
| -55.7·10−6 cm3/ mol | |
| Související sloučeniny | |
Související sloučeniny | Difenyloxalát |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Dimethyloxalát je organická sloučenina se vzorcem (CO2CH3)2. To je dimethyl ester z kyselina šťavelová. Dimethyloxalát je bezbarvá nebo bílá pevná látka, která je rozpustná ve vodě.
Výroba
Dimethyloxalát lze získat esterifikace kyseliny šťavelové s methanolu použitím kyselina sírová jako katalyzátor:[2]
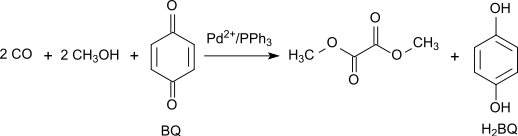
Cesta oxidační karbonylace
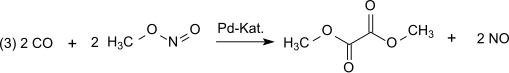
Příprava oxidační karbonylace přitahoval zájem, protože to vyžaduje pouze Prekurzory C1:[3]
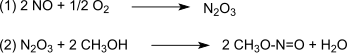
Reakce je katalyzována Pd2+.[4][5] Syntetický plyn se většinou získává z uhlí nebo biomasa. Oxidace probíhá prostřednictvím oxid dusný, který je vytvořen podle (1) z oxid uhelnatý a kyslík a poté reaguje podle bodu (2) s tvorbou methanolu methylnitrit:[6]
V dalším kroku dikarbonylace (3) kysličník uhelnatý reaguje s methylnitritem na dimethyloxalát v plynné fázi při atmosférickém tlaku a teplotách 80-120 ° C po palladium katalyzátor:
Součtová rovnice:
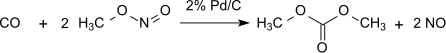
Tato metoda je bezztrátová, pokud jde o methylnitrit, který působí prakticky jako nosič oxidačních ekvivalentů. Vytvořená voda však musí být odstraněna, aby se zabránilo hydrolýze dimethyloxalátového produktu. S 1% Pd / α-Al2Ó3 dimethyloxalát se vyrábí selektivně v dikarbonylační reakci, za stejných podmínek se 2% Pd / C dimetylkarbonát vyrábí monokarbonylací:
Alternativně může být oxidativní karbonylace methanolu provedena s vysokým výtěžkem a selektivitou s 1,4-benzochinon jako oxidant v systému Pd (OAc)2 /PPh3 / benzochinon s hmotnostním poměrem 1/3/100 při 65 ° C a 70 atm CO:[5]
Reakce
Dimethyloxalát (a související diethylester) se používá v různých formách kondenzační reakce.[7] Například diethyloxalát kondenzuje s cyklohexanon za vzniku diketo-esteru, předchůdce]] pimelové kyseliny.[8] S diaminy kondenzují diestery kyseliny šťavelové za vzniku cyklických diaamidů. Chinoxalindion se vyrábí kondenzací dimethyloxalátu a o-fenylendiamin:
- C2Ó2(OMe)2 + C.6H4(NH2)2 → C.6H4(NHCO)2 + 2 MeOH
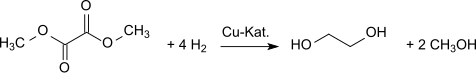
Hydrogenace dává ethylenglykol.[9] Dimethyloxalát lze převést na ethylenglykol ve vysokých výtěžcích (94,7%[10][11]
Vytvořený methanol se recykluje v procesu oxidační karbonylace.[12] Plánovány jsou další závody s celkovou roční kapacitou více než 1 milion tun ethylenglykolu ročně.
Dekarbonylace dává dimethylkarbonát.[13]
Difenyloxalát se získá transesterifikace s fenol v přítomnosti titanových katalyzátorů,[14] který je opět dekarbonylován na difenylkarbonát v kapalné nebo plynné fázi.
Reference
- ^ A b P. P. T. Sah a S-L. Chien, Journal of the American Chemical Society, 1931, 53, 3901-3903.
- ^ Everett Bowden (1930). "Methyloxalát". Organické syntézy. 10: 78. doi:10.15227 / orgsyn.010.0078.
- ^ Hans-Jürgen Arpe: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte, S. 168; ISBN 978-3-527-31540-6.
- ^ USA 4467109 „Susumu Tahara a kol.,„ Proces kontinuální přípravy diesteru kyseliny šťavelové “, vydaný 1983-05-19, přidělený Ube Industries a EP 108359 K. Masunaga a kol., "Způsob přípravy diesteru kyseliny šťavelové", přidělen k Ube IndustriesEP 425197, K. Nishihira & K. Mizutare, „Proces přípravy diesteru kyseliny uhličité“, publikovaný 1991-05-2, přidělený společnosti Ube IndustriesUSA 4451666, J.A. Sofranko, A.M. Gaffney, „Syntéza oxalátových esterů oxidační karbonylací alkoholů“, publikovaná 29. 5. 1984, přidělená společnosti Atlantic Richfield Co.
- ^ A b E. Amadio: Oxidační karbonylace alkanolů katalyzovaných komplexy Pd (II) -fosfin, PhD Thesis, Ca’Foscari University Venice, 2009.
- ^ X.-Z. Jiang, Katalyzátory podporované palladiem v reakcích CO + RONO, Platinum Metals Rev., 1990, 34, (4), 178–180
- ^ Bergman, Jan; Norrby, Per-Ola; Sand, Peter (1990). "Alkylace s oxalickými estery. Rozsah a mechanismus". Čtyřstěn. 46 (17): 6113–6124. doi:10.1016 / S0040-4020 (01) 87933-3.
- ^ H. R. Snyder, L. A. Brooks, S. H. Shapiro, A. Müller (1931). "Kyselina pimelová". Organické syntézy. 11: 42. doi:10.15227 / orgsyn.011.0042.CS1 maint: používá parametr autoři (odkaz)
- ^ Nexant / Chemsystems, "Uhlí na MEG, změna pravidel hry" (PDF). Archivovány od originálu dne 14. července 2011. Citováno 2016-08-08.CS1 maint: BOT: stav původní adresy URL neznámý (odkaz) (PDF; 5,4 MB), Prospekt 2011
- ^ 983 EP 046 983 S. Tahara a kol., „Proces kontinuální přípravy ethylenglykolu“, přidělený společnosti Ube Industries a H. T. Teunissen a C. J. Elsevier, Rutheniem katalyzovaná hydrogenace dimethyloxalátu na ethylenglykolJ. Chem. Soc., Chem. Commun., 1997, 667-668), DOI: 10.1039 / A700862G.
- ^ S. Zhang a kol., Vysoce disperzní katalyzátory na bázi mědi z prekurzoru dvojitého hydroxidu vrstveného na bázi Cu – Zn – Al pro hydrogenaci dimethyloxalátu na ethylenglykol v plynné fázi, Catalysis Letters, září 2012, 142 (9), 1121–1127, DOI: 10,1007 / s10562-012-0871-8.
- ^ http://www.icis.com/resources/news/2012/01/30/9527520/china-s-coal-based-chemicals-are-a-trade-off/
- ^ USA 4544507, P. Foley, „Výroba uhličitanových diesterů z oxalátových diesterů“, přidělen společnosti Celanese Corp
- ^ USA 5834614, K. Nishihira a kol., „Proces výroby diarylkarbonátu“, přidělený společnosti Ube Industries, Ltd. a X.B. Ma et al., Příprava difenyloxalátu z transesterifikace dimethyloxalátu s fenolem na katalyzátoru TS-1, Chinese Chem. Lett., 14 (5), 461–464 (2003), DOI: 10.1016 / s0378-3820 (03) 00075-4.