Hypermethylace ostrova CpG - CpG island hypermethylation
tento článek může být pro většinu čtenářů příliš technická na to, aby tomu rozuměli. Prosím pomozte to vylepšit na aby to bylo srozumitelné pro neodborníky, aniž by byly odstraněny technické podrobnosti. (Dubna 2017) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
Hypermethylace ostrova CpG je epigenetický kontrolní aberace, která je důležitá pro genová inaktivace v rakovina buňky. Hypermethylace z CpG ostrovy byl popsán téměř u všech typů nádor. Mnoho důležitých buněčné dráhy, jako Oprava DNA (hMLH1, například), buněčný cyklus (p14ARF ), apoptóza (DAPK ), buněčná adherence (CDH1, CDH13 ), jsou inaktivovány touto epigenetickou lézí.[1] Hypermethylace je spojena s proteiny vázající methyl, DNA methyltransferázy a histon deacetyláza, ale míra, do jaké tento proces selektivně umlčí geny potlačující nádory zůstává živým studijním oborem. Seznam hypermethylovaných genů roste a provádějí se funkční a genetické studie k určení, které hypermethylační události jsou relevantní pro tumorigeneze. Základní i translační výzkum k pochopení mechanismů a rolí hypermethylace ostrova CpG u rakoviny.
Dějiny
První objev methylace v a CpG ostrov u člověka supresorový gen nádoru byl gen Retinoblastom (Rb) gen v roce 1989.[2] Bylo to jen několik let po první onkogen mutace byla objevena v lidském primárním nádoru. Objev inaktivace methylace spojené s Gen Von Hippel-Lindau (VHL) oživil myšlenku hypermethylace CpG ostrov promotor je mechanismus k inaktivaci genů u rakoviny.[3] Rakovina epigenetické umlčení ve svém současném stavu se narodil v laboratořích Baylina a Jonese,[3] kde bylo prokázáno, že hypermethylace ostrova CpG byla běžným inaktivačním mechanismem tumor supresorového genu p16INK4a. Zavedení methylačně specifická PCR a hydrogensiřičitan sodný modifikace přidala nástroje k pásu výzkumu epigenetiky rakoviny,[3][4] a seznam kandidátských genů s aberantní methylací jejich CpG ostrovů od té doby roste.[5] Zpočátku byla přítomnost změn v profilu methylace DNA u rakoviny považována za globální hypomethylaci genomu, která by vedla k masivní nadměrné expresi onkogenů s normálně hypermethylovaným CpG ostrovem.[6] V poslední době je to považováno za neúplný scénář, navzdory myšlence, že genom rakovinné buňky prochází snížením 5-methylcytosin obsah ve srovnání se správností nadřazené normální buňky.[5] V normálních tkáních je velká většina ostrovů CpG až na některé výjimky zcela nemetylovaná.[1] Asociace transkripčního umlčování tumor supresorových genů s hypermethylací je základem, na kterém tato podskupina epigenetiky rakoviny stojí.
Struktura
V normální buňce CpG ostrov je hypomethylovaný,[7] a zbytek genomu je methylován. Je zřejmé, že hypomethylace ostrova CpG v normálních buňkách neposkytuje žádné další sterická překážka do budoucí vazby. Většina CpG páry u savců jsou chemicky modifikovány kovalentní připevnění a methyl skupina do C5 poloha cytosin prsten.[8] Tato modifikace je distribuována po celém genomu a potlačuje transkripci. Ostrov CpG je Cytosin a Guanine propojeno a fosfát v opakované sekvenci. Tyto jsou genetický hotspoty, protože jsou weby aktivních methylace. Výraz a gen je tkáň specifické, což vede ke změnám ve funkci tkáně. Methylace genu zabraňuje expresi genu určitým způsobem.
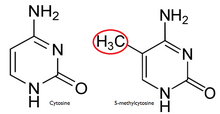
Důvod methylace je téměř výlučný pro CpG dinukleotidy je symetrie dinukleotidu. To umožňuje uchování během buněčné dělení a je charakteristickým znakem epigenetických modifikací.

Role v rakovině
Abychom pochopili roli CpG ostrov hypermethylace u rakoviny je užitečné uvažovat o konkrétním typu nádoru, tzv Prototyp ostrovního methylátoru CpG nebo CIMP. Vyšší úrovně hypermethylace ostrovů CpG lze nalézt v CIMP. Častý výskyt hypermethylace byl poprvé popsán v kolorektální karcinom a později pro gliom. Více nedávno to bylo studováno pro neuroblastomy. Častá hypermethylace CpG ostrovů v těchto nádorech, stejně jako jejich nepravidelnost, jsou způsoby, jak určit, že hypermethylované CpG se liší podle typu nádoru. To by znamenalo, že kolorektální karcinom nebude nutně mít stejnou sadu hypermethylovaných CpG ostrovů jako v gliomu. Tuto klinickou odlišnost nádorů mohou lékaři interpretovat. Pro další přiblížení se zaměřme na kolorektální CIMP, protože to byl jeden z prvních svého druhu, který byl popsán. Pacienti v této kategorii rakoviny bývají starší a ženy a mají vady MLH1 funkce. Nádory jsou obvykle ve vzestupném tračníku. Mají také dobrý prognostický výsledek, takže pokud by pacientovi byla diagnostikována tato paleta CIMP, je pravděpodobné, že bude mít dobrý výsledek. Tyto klinicky odlišné fenotypy CIMP také naznačují, že existuje potenciál pro epigenetická terapie. Ostrovy CpG, které jsou hypermethylované, mohou hrát při rakovině tři role: v diagnóza, prognóza a v monitorování. V diagnostice lze identifikovat typ nádoru a podtyp nádoru, stejně jako jeho primární nádor, pokud to není známo. Hypermethylace se zvyšuje s tumorigenicita, což je ukazatel prognózy rakoviny. Například vysoká methylace je markerem špatné prognózy rakoviny plic. Hypermethylace ostrovů CpG je velmi slibná molekulární monitorování pacientů s rakovinou. Je to také potenciální cíl pro terapeutické použití.

Aberace v epigenetický kontroly, které se vyskytují u rakoviny Methylace DNA, což může být buď místo - specifická hypermethylace DNA nebo genom hypomethylace DNA. Pod lokusově specifickou DNA dochází k hypermethylaci CpG ostrov hypermethylace. Methylace DNA působí jako alternativa k genetická mutace. Podle Knudsonova hypotéza, rakovina je výsledkem více zásahů do DNA a Methylace DNA může být jedním z takových zásahů. Epigenetické mutace, jako je methylace DNA, jsou mitoticky dědičné, ale také reverzibilní, na rozdíl od genových mutací. Identita hypermethylovaných ostrovů CpG se liší podle typu nádoru. Některé příklady jednotlivých genů zahrnují MLH1 v kolorektální karcinom a BRCA1 v rakovina prsu. Hypermethylované ostrovy CpG také fungují jako biomarkery, protože mohou pomoci rozlišit rakovinu od normálních buněk ve stejném vzorku. Mohou také pomoci identifikovat určité specifické rysy rakoviny a jejich detekce je citlivější. Hypermethylace ostrova CpG prokázala slib pro molekulární monitorování pacientů s rakovinou a je potenciálním cílem pro terapeutické použití.
Reference
- ^ A b Esteller M (12. srpna 2002). „Hypermethylace ostrovů CpG a geny potlačující nádory: vzkvétající současnost, světlejší budoucnost“. Onkogen. 21 (35): 5427–40. doi:10.1038 / sj.onc.1205600. PMID 12154405. ProQuest 227311892.
- ^ Greger V, Passarge E, Höpping W, Messmer E, Horsthemke B (1. září 1989). „Epigenetické změny mohou přispět k tvorbě a spontánní regresi retinoblastomu“. Genetika člověka. 83 (2): 155–8. doi:10.1007 / BF00286709. PMID 2550354.
- ^ A b C Herman JG Latif F, Weng Y, Lerman MI, Zbar B, Liu S, Samid D, Duan DS, Gnarra JR, Linehan WM (11. října 1994). „Ztlumení genu potlačujícího nádor VHL metylací DNA v renálním karcinomu“. Sborník Národní akademie věd. 91 (21): 9700–4. doi:10.1073 / pnas.91.21.9700. PMC 44884. PMID 7937876.
- ^ Clark J, Rocques PJ, Crew AJ, Gill S, Shipley J, Chan AM, Gusterson BA, Cooper CS (1. srpna 1994). „Identifikace nových genů, SYT a SSX, podílejících se na translokaci t (X; 18) (str. 11; q11. 2) nalezené v lidském synoviálním sarkomu“. Genetika přírody. 7 (4): 502–8. doi:10.1038 / ng0894-502. PMID 7951320.
- ^ A b Esteller M, kukuřice PG, Baylin SB, Herman JG (15. dubna 2001). „Genový hypermethylační profil lidské rakoviny“. Výzkum rakoviny. 61 (8): 3225–9. PMID 11309270.
- ^ Feinberg AP, Vogelstein B (1. července 1983). "Technika pro radioaktivní značení fragmentů restrikční endonukleázy DNA na vysokou specifickou aktivitu". Analytická biochemie. 132 (1): 6–13. doi:10.1016/0003-2697(83)90418-9. PMID 6312838.
- ^ University of Melbourne, Coursera
- ^ Illingworth RS, Bird AP (5. června 2009). „Ostrovy CpG - hrubý průvodce'". FEBS Dopisy. 583 (11): 1713–20. doi:10.1016 / j.febslet.2009.04.012. PMID 19376112.
