Azomethinylid - Azomethine ylide

Azomethinylidy jsou na bázi dusíku 1,3-dipóly, skládající se z iminium iont vedle a karbanion. Používají se v 1,3-dipolární cykloadice reakce za vzniku pětičlenného heterocykly, počítaje v to pyrrolidiny a pyrroliny.[1][2][3] Tyto reakce jsou vysoce stereo- a regioselektivní, a mají potenciál vytvořit čtyři nová sousedící stereocentra. Azomethine ylidy tedy mají vysokou užitečnost v celková syntéza a vznik chirální ligandy a léčiva. Azomethinylidy mohou být generovány z mnoha zdrojů, včetně aziridinů, iminů a iminií. Často se generují in situa okamžitě reagoval s dipolarofily.
Struktura
The rezonanční struktury níže ukazují 1,3-dipól příspěvek, ve kterém dva atomy uhlíku sousedící s dusíkem mají záporný nebo kladný náboj.[1] Nejběžnějším zastoupením azomethinylidů je zastoupení, ve kterém je dusík kladně nabitý a záporný náboj je sdílen mezi dvěma atomy uhlíku. Relativní příspěvky různých rezonančních struktur závisí na substituentech na každém atomu. Obsahující uhlík výběr elektronů substituenty budou mít více částečný záporný náboj, kvůli schopnosti blízké skupiny přitahující elektrony stabilizovat záporný náboj.

Jsou možné tři různé tvary ylidů, z nichž každý vede k odlišné stereochemii v produktech 1,3-dipolární cykloadice reakce. Možné jsou ylidy ve tvaru W, U a S.[1] Výsledkem jsou ylidy ve tvaru W a U, ve kterých jsou substituenty R na stejné straně syn cykloadiční produkty, zatímco výsledkem jsou ylidy ve tvaru S proti produkty. V příkladech níže, kde R3 substituent končí v produktu závisí na sterické a elektronické povaze substituentu (viz regioselektivita 1,3 dipolárních cykloadic ). Stereochemie R.1 a R.2 v cykloadičním produktu je odvozen od dipólu. Stereochemie R.3 je odvozen od dipolarofilu - pokud je dipolarofil více než monosubstituovaný (a prochirál ), výsledkem mohou být až čtyři nová stereocentra.

Generace
Z aziridinů
Azomethinylidy mohou být generovány z otevření kruhu aziridiny.[4][5] V souladu s Woodward – Hoffmann vládne, otevření tepelného čtyř elektronového kruhu probíhá prostřednictvím a zdrcující proces, zatímco fotochemická reakce je disrotační.

V této reakci na otevření kruhu je problém torquoselectivity. Elektronegativní substituenty dávají přednost rotaci směrem ven, na stejnou stranu jako substituent R na dusíku, zatímco elektropozitivní substituenty dávají přednost rotaci směrem dovnitř.[6]
U aziridinů může dojít k otevření kruhu jiný 1,3-dipól, ve kterém se rozbije vazba C – N (spíše než vazba C – C).[7]
Kondenzací aldehydu s aminem

Jednou z nejjednodušších metod tvorby azomethinových ylidů je kondenzace an aldehyd s amin. Pokud amin obsahuje skupinu vázající elektrony na alfa uhlíku, například ester, deprotonace dochází snadno. Možnou nevýhodou použití této metody je, že ester končí v cykloadičním produktu. Alternativou je použití a karboxylová kyselina, které lze během procesu cykloadice snadno odstranit pomocí dekarboxylace.[8]
Z iminů a iminií

Azomethinylidy mohou být také vytvořeny přímo deprotonací iminia.
Podle N-metalizace
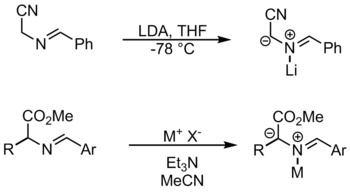
Mezi kovová činidla použitá v této reakci patří bromid lithný a octan stříbrný.[1] V této metodě se kov koordinuje s nitogenem za účelem aktivace substrátu pro deprotonaci. Dalším způsobem, jak vytvořit azomethinylidy z iminů, je prototropie a tím alkylace.
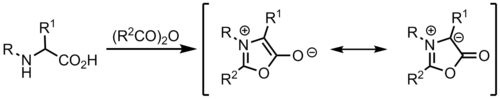
Z münchnones
Ylidy mohou být vytvořeny z münchnones, což jsou mezoionický heterocykly a působí jako cyklické azomethinylidy.[9]
1,3-dipolární cykloadiční reakce

Stejně jako u jiných cykloadičních reakcí a 1,3-dipól se systémem π, 1,3-dipolární cykloadice použití azomethinylidu je šest elektronový proces. Podle Woodward – Hoffmann vládne, tento doplněk je nadprofesionální s ohledem na dipól i dipolarofil. Na reakci se obecně pohlíží jako koordinovaně, ve kterém se dvě vazby uhlík-uhlík vytvářejí současně, ale asynchronně. V závislosti na povaze dipólu a dipolarofilu však diradical nebo zwitterionický meziprodukty jsou možné.[10] The endo produkt je obecně upřednostňován, jako v isoelektronice Diels-Alderova reakce. V těchto reakcích je azomethinylid obvykle HOMO a elektronově deficitní dipolarofil LUMO, i když je známo, že dochází k cykloadičním reakcím s neaktivovanými π-systémy, zejména když je cyklizace intramolekulární.[11] Diskuse o hraniční molekulární orbitální teorii 1,3-dipolárních cykloadic viz 1,3-dipolární cykloadice # Hraniční molekulární orbitální teorie.
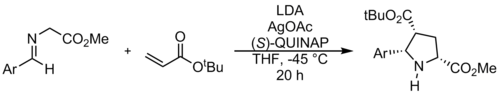
1,3-Dipolární cykloadiční reakce azomethinylidů se běžně používají alkeny nebo alkyny jako dipolarofily, aby se vytvořily pyrrolidiny nebo pyrroliny, resp. Reakce azomethinylidu s alkenem je uvedena výše a vede k pyrrolidinu.[12]. Tento druh reakcí lze použít k syntéze Ullazin[13]. Zatímco dipolarofily jsou obvykle a, p-nenasycený karbonyl sloučenin, došlo v poslední době k mnoha pokrokům ve vývoji nových typů dipolarofilů.[14]
Pokud jsou dipól a dipolarofil součástí stejné molekuly, an intramolekulární cyklizační reakce může vést k polycyklickému produktu se značnou složitostí.[1] Pokud je dipolarofil vázán na uhlík dipólu, vytvoří se kondenzované kolo. Pokud je vázán na dusík, vznikne přemostěná struktura. Intramolekulární povaha reakce může být také užitečná v tom, že je často omezena regioselektivita. Další výhodou intramolekulárních reakcí je, že dipolarofil nemusí být elektronově deficitní - bylo popsáno mnoho příkladů cyklických reakcí s elektrony bohatými, alkylem substituovanými dipolarofily, včetně syntézy kyseliny martinellové uvedené níže.
Stereoselektivita cykloadic
Na rozdíl od většiny 1,3-dipolárních cykloadičních reakcí, při kterých je stereochemie dipólu ztracena nebo neexistuje, si azomethinylidy mohou svoji stereochemii udržet. To se obvykle provádí otevřením kruhu aziridinu a následným zachycením dipolarofilem, než se stereochemie může vyškrábat.
Stejně jako ostatní 1,3-dipolární cykloadiční reakce mohou azomethinylidové cykloadice tvořit endo nebo exo produkty. Tuto selektivitu lze vyladit pomocí katalýzy kovů.[15][16]
Enantioselektivní syntéza
Enantioselektivní cykloadice azomethinylidů pomocí chirálních katalyzátorů byla poprvé popsána v klíčové práci Allway a Grigg v roce 1991.[17] Tuto mocnou metodu dále rozvinuli Jørgensen a Zhang. Tyto reakce se obecně používají zinek, stříbrný, měď, nikl, a vápník komplexy.
Pomocí chirál fosfinové katalyzátory mohou být syntetizovány enantiomerně čisté spiroindolinony. Metoda popsaná Gongem a kol. vede k neočekávanému regiochemickému výsledku, který nenasleduje elektronické účinky. To je přičítáno příznivé skládání pí s katalyzátorem.[18]
Další reakce
Elektrocyklizace
Konjugované azomethinylidy jsou schopné [1,5] - a [1,7] -elektrocyklizace.[19] Níže je uveden příklad [1,7] -elektrocyklizace difenylethenylem substituovaného azomethinylylidu. Tento zdrcující po uzavření kruhu následuje a nadprofesionální Posun [1,5] -hydridu, který poskytuje rearomatizovaný produkt. Při úspěšnosti reakce hraje hlavní roli sterika a geometrie reagujícího fenylového kruhu.[20]

Sloučeniny vzniklé tímto typem elektrocyklizace byly použity jako dienes v Diels – Alderovy reakce připojit sloučeniny k fullereny.[21]
Použití při syntéze
Celková syntéza kyseliny martinelinové

K úplné syntéze byla použita cykloadice azomethinylylidu s neaktivovaným alkenem kyselina martinellová. Krok cykloadice vytvořil dva kruhy, včetně a pyrrolidin a dvě stereocentra.[22]
Celková syntéza spirotryprostatinu A

Při syntéze spirotryprostatin A, azomethinylid vzniká kondenzací aminu s aldehyd. Ylid potom reaguje s elektronem deficitním alkenem na indolinon, což má za následek vznik a spirocyklický pyrrolidin a čtyři sousedící stereocentra.[23]
Syntéza benzodiazepinonů
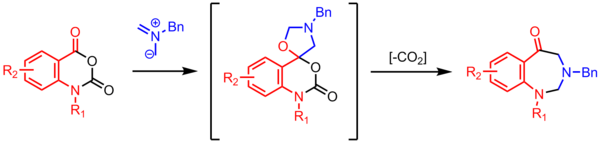
Cyklizací azomethinylidu s karbonylem se získá spirocyklikum oxazolidin, který ztrácí CO2 k vytvoření sedmičlenného kruhu. Tyto vysoce užitečné dekarboxylativní vícestupňové reakce jsou běžné v chemii azomethinylidů.[24]
Reference
- ^ A b C d E Coldham, Iain; Hufton, Richard (2005). „Intramolekulární dipolární cykloadiční reakce azomethin-ylidů“. Chemické recenze. 105 (7): 2765–2809. doi:10.1021 / cr040004c. PMID 16011324.
- ^ Padwa, Albert; Pearson, William H .; Harwood, L. M .; Vickers, R. J. (2003). „Kapitola 3. Azomethin Ylides“. Syntetické aplikace chemie 1,3-dipolární cykloadice směrem k heterocyklům a přírodním produktům. Chemistry of Heterocyclic Compounds: A Series of Monographs. 59. 169–252. doi:10.1002 / 0471221902.ch3. ISBN 9780471387268.
- ^ Adrio, Javier; Carretero, Juan C. (2011). „Nové dipolarofily a dipóly v kovem katalyzované enantioselektivní 1,3-dipolární cykloadici azomethinylidů“. Chemická komunikace. 47 (24): 6784–6794. doi:10.1039 / c1cc10779h. PMID 21472157.
- ^ Dauban, Philippe; Guillaume, Malik (2009). „Maskovaný 1,3-dipol odhalený aziridiny“. Angewandte Chemie International Edition. 48 (48): 9026–9029. doi:10.1002 / anie.200904941. PMID 19882612.
- ^ Huisgen, Rolf; Scheer, Wolfgang; Huber, Helmut (1967). "Stereospecifická přeměna cis-trans izomerních aziridinů na azomethin ylidy s otevřeným řetězcem". Journal of the American Chemical Society. 89 (7): 1753–1755. doi:10.1021 / ja00983a052.
- ^ Banks, Harold D. (2010). „Torquoselectivity Studies in the Generation of Azomethine Ylides from Substitution Aziridines“. Journal of Organic Chemistry. 75 (8): 2510–2517. doi:10.1021 / jo902600y. PMID 20329779.
- ^ Cardoso, Ana L .; Pinho e Melo, Teresa M. V. D. (2012). „Aziridiny ve formálních [3 + 2] cykloadicích: Syntéza pětičlenných heterocyklů“. European Journal of Organic Chemistry (33): 6479–6501. doi:10.1002 / ejoc.201200406.
- ^ Huie, Edward (1983). „Intramolekulární [3 + 2] cykloadiční cesty k dibenzocykloheptanům a dibenzazepinům přemostěným uhlíkem“. Journal of Organic Chemistry. 48 (18): 2994–2997. doi:10.1021 / jo00166a011.
- ^ Padwa, Albert; Gingrich, Henry L .; Lim, Richard (1982). „Regiochemie intramolekulárních cykloadic munchnonu: preparativní a mechanické důsledky“. Journal of Organic Chemistry. 47 (12): 2447–2456. doi:10.1021 / jo00133a041.
- ^ Li, Yi; Houk, Kendall N .; González, Javier (1995). "Stavy přechodu na pericyklickou reakci". Účty chemického výzkumu. 20 (2): 81–90. doi:10.1021 / ar00050a004.
- ^ Heathcock, Clayton H .; Henke, Brad R .; Kouklis, Andrew J. (1992). „Intramolekulární 1,3-dipolární cykloadice stabilizovaných azomethin Ylidů na neaktivované dipolarofily“. Journal of Organic Chemistry. 57 (56): 7056–7066. doi:10.1021 / jo00052a015.
- ^ Streiber, S.L. (2003). „Katalytická asymetrická [3 + 2] cykloadice azomethinylidů. Vývoj univerzální postupné, třísložkové reakce pro syntézu zaměřenou na rozmanitost“. Journal of the American Chemical Society. 125 (34): 10174–10175. doi:10.1021 / ja036558z. PMID 12926931.
- ^ R. Berger, M. Wagner, X. Feng, K. Müllen. „Polycyklické aromatické azomethinylylidy: jedinečný vstup do rozšířené polycyklické heteroaromatiky“. 2014. 436–441.doi: 10,1039 / C4SC02793K
- ^ Adrio, Javier; Carreter, Juan C. (2011). „Nové dipolarofily a dipóly v kovem katalyzované enantioselektivní 1,3-dipolární cykloadici azomethinylidů“. Chemická komunikace. 47 (24): 6784–6794. doi:10.1039 / c1cc10779h. PMID 21472157.
- ^ Zhang, Xumu; Raghunath, Malati; Gao, Wenzhong (2005). „Cu (I) -katalyzovaný, vysoce exo-selektivní a enantioselektivní [3 + 2] cykloadice azomethin-ylidů s akryláty“. Organické dopisy. 7 (19): 4241–4244. doi:10.1021 / ol0516925. PMID 16146397.
- ^ Fukuzawa, Shin-ichi; Oura, Ichiro; Shimizu, Kenta; Ogata, Kenichi (2010). "Vysoce Endo- Selektivní a enantioselektivní 1,3-dipolární cykloadice azomethin-ylidu s α-enony katalyzovaná komplexem stříbro (I) / ThioClickFerrophos “. Organické dopisy. 12 (8): 1752–1755. doi:10,1021 / ol100336q. PMID 20232852.
- ^ Allway, Philip; Grigg, Ronald (1991). „Chirální kobalt (II) a mangan (II) katalyzátory pro 1,3-dipolární cykloadiční reakce azomethinylidů odvozených od arylidenových iminů glycinu“. Čtyřstěn dopisy. 32 (41): 5817–5820. doi:10.1016 / S0040-4039 (00) 93563-9.
- ^ Gong, Liu-Zhu; Chen, Xiao-Hua; Wei, Qiang; Luo, Shi-Wei; Xiao, Han (2009). „Organocatalytic Synthesis of Spiro [pyrrolidin-3,3′-oxindoles] with High Enantiopurity and Structural Diversity“. Journal of the American Chemical Society. 131 (38): 13819–13825. doi:10.1021 / ja905302f. PMID 19736987.
- ^ Nedolya, N. A .; Trofimov, B. A. (2013). „[1,7] -Elektrocyklizační reakce při syntéze azepinových derivátů“. Chemistry of Heterocyclic Compounds. 49 (1): 152–176. doi:10.1007 / s10593-013-1236-r.
- ^ Nyerges, Miklós (2006). „1,7-Elektrocyklizační reakce stabilizovaných α, β: γ, δ-nenasycených azomethinylidů“. Čtyřstěn. 16 (24): 5725–5735. doi:10.1016 / j.tet.2006.03.088.
- ^ Nierengarten, Jean-François (2002). „Nečekaná reakce Diels – Alder na jádro fullerenu, spíše než očekávaná 1,3-dipolární cykloadice.“ Chem. Commun. 0 (7): 712–713. doi:10.1039 / B201122K.
- ^ Snider, B. B .; Ahn, Y .; O'Hare, S. M. (2001). "Celková syntéza kyseliny (±) -martinelinové". Organické dopisy. 3 (26): 4217–4220. doi:10.1021 / ol016884o.
- ^ Williams, Robert (2003). „Stručná, asymetrická celková syntéza spirotryprostatinu A“. Organické dopisy. 5 (17): 3135–3137. doi:10.1021 / ol0351910. PMID 12917000.
- ^ Ryan, John H. (2011). „1,3-Dipolární cykloadiční-dekarboxylační reakce azomethinylylidu s anhydridy kyseliny isatoové: tvorba nových benzodiazepinonů“. Organické dopisy. 13 (3): 486–489. doi:10.1021 / ol102824k. PMID 21175141.
