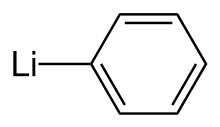
Fenyllithium - Phenyllithium
 | |
| Jména | |
|---|---|
| Systematický název IUPAC Fenyllithium[1] | |
| Ostatní jména Fenyl lithium[Citace je zapotřebí ] | |
| Identifikátory | |
3D model (JSmol ) | |
| Zkratky | LiPh, PhLi |
| 506502 | |
| ChEBI | |
| ChemSpider | |
| Informační karta ECHA | 100.008.838 |
| Číslo ES |
|
| 2849 | |
| Pletivo | fenyllithium |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| LiC 6H 5 | |
| Molární hmotnost | 84,045 g mol−1 |
| Vzhled | Bezbarvé krystaly |
| Hustota | 828 mg cm−3 |
| Bod varu | 140 až 143 ° C (284 až 289 ° F; 413 až 416 K) |
| Reaguje | |
| Termochemie | |
Std entalpie of formace (ΔFH⦵298) | 48,3-52,5 kJ mol−1 |
| Nebezpečí | |
| Bezpečnostní list | Externí bezpečnostní list |
| R-věty (zastaralý) | R14, R17, R23 / 24/25, R48 |
| S-věty (zastaralý) | (S1 / 2), S8, S9, S16, S26, S30, S46, S36 / 37/39, S45 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Fenyllithium nebo lithobenzen je organokovový prostředek s empirickým vzorcem C6H5Li. Nejčastěji se používá jako metalační činidlo v organických syntézách a jako náhrada za Grignardova činidla pro zavedení fenylových skupin do organických syntéz.[2] Krystalické fenyllithium je bezbarvé; roztoky fenyllithia jsou však různé odstíny hnědé nebo červené v závislosti na použitém rozpouštědle a nečistotách přítomných v rozpuštěné látce.[3]
Struktura a vlastnosti
Fenyllithium je organolithium sloučenina, která tvoří monoklinické krystaly. Pevné fenyllithium lze popsat tak, že sestává z dimerního Li2Ph2 podjednotky. Atomy Li a ipso uhlíky fenylových kruhů tvoří rovinný čtyřčlenný kruh. Rovina fenylových skupin je kolmá k rovině této Li2C2 prsten. Mezi těmito fenyllithiovými dimery a n-elektrony fenylových skupin v sousedních dimerech dochází k další silné intermolekulární vazbě, což vede k nekonečné polymerní struktuře žebříku.[4]
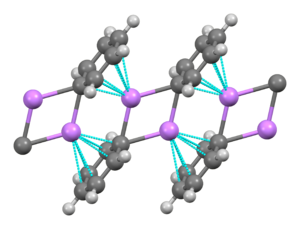
V roztoku vyžaduje různé struktury závislé na organickém rozpouštědle. v tetrahydrofuran, ekvilibruje mezi monomerními a dimerními stavy. V etheru, jak se běžně prodává, existuje fenyllithium jako tetramer. Čtyři atomy Li a čtyři uhlíkové centra ipso zabírají střídavé vrcholy zkreslené krychle. Fenylové skupiny jsou na čelách čtyřstěnu a váží se na tři nejbližší atomy Li.
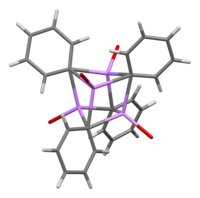
Délka vazby C – Li je v průměru 2,33 Å. Molekula etheru se váže na každé z míst Li prostřednictvím svého atomu kyslíku. V přítomnosti LiBr, vedlejšího produktu přímé reakce lithia s fenylhalogenidem, [(PhLi • Et2Ó)4] se místo toho stává [(PhLi • Et2Ó)3• LiBr). Atom Li LiBr zaujímá jedno z lithiových míst v shluk kubánského typu a atom Br sedí v sousedním uhlíkovém místě.[5]
Příprava
Fenyllithium bylo nejprve vyrobeno reakcí kovového lithia s difenyl rtuť:[6]
- (C6Η5)2Ηg + 2Li → 2C6Η5Li + Ηg
Reakcí fenylhalogenidu s kovovým lithiem vzniká fenyllithium:
- X-Ph + 2Li → Ph-Li + LiX
Fenyllithium lze také syntetizovat výměnnou reakcí kov-halogen:
- n-BuLi + X-Ph → n-BuX + Ph-Li
Dnes převládající metodou výroby fenyllithia jsou poslední dvě syntézy.
Reakce
Primárním použitím PhLi je usnadnění tvorby vazeb uhlík-uhlík pomocí nukleofilních adičních a substitučních reakcí:
- PhLi + R2C = O → PhR2COLI
2-fenylpyridin se připravuje reakcí fenyl lithia s pyridinem, což je proces, který zahrnuje adiční a eliminační cestu:[7]
- C6H5Li + C.5H5N → C6H5-C5H4N + LiH
Reference
- ^ „fenyllithium (CHEBI: 51470)“. Chemické entity biologického zájmu (ChEBI). Cambridge, Velká Británie: Evropský bioinformatický institut. 2009-01-22. Hlavní. Citováno 2013-06-01.
- ^ Wietelmann, U .; Bauer, R. J. „Lithium and Lithium Compounds“. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a15_393.
- ^ Gilman, H .; Zoellner, E. A .; Selby, W. M. (1932). „Vylepšený postup pro přípravu organolithných sloučenin“. Journal of the American Chemical Society. 54 (5): 1957–1962. doi:10.1021 / ja01344a033.
- ^ Dinnebier, R.E .; Behrens, U .; Olbrich, F. (1998). „Lewisovo báze bez fenyllithia: Stanovení struktury v pevné fázi synchrotronovou práškovou difrakcí“. Journal of the American Chemical Society. 120 (7): 1430–1433. doi:10.1021 / ja972816e.
- ^ Hope, H .; Power, P. P. (1983). „Izolační a krystalová struktura komplexů fenyllithia etherátu bez halogenidů a bohatých na halogenidy [(PhLi • Et2Ó)4] a [(PhLi • Et2Ó)3• LiBr] ". Journal of the American Chemical Society. 105 (16): 5320–5324. doi:10.1021 / ja00354a022.
- ^ Green, D. P .; Zuev, D. (2008). "Fenyllithium". Encyklopedie činidel pro organickou syntézu. Wiley and Sons. doi:10.1002 / 047084289X.rp076.pub2. ISBN 978-0471936237.
- ^ Evans, J. C. W .; Allen, C. F. H. "2-Fenylpyridin" Organic Syntheses (1938), sv. 18, s. 70. doi:10.15227 / orgsyn.018.0070
