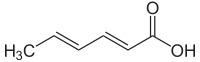
Kyselina sorbová - Sorbic acid
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC (2E,4Ekyselina) -hexa-2,4-dienová | |
| Identifikátory | |
3D model (JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.003.427 |
| Číslo E. | E200 (konzervační látky) |
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C6H8Ó2 | |
| Molární hmotnost | 112.128 g · mol−1 |
| Hustota | 1,204 g / cm3 |
| Bod tání | 135 ° C (275 ° F; 408 K) |
| Bod varu | 228 ° C (442 ° F; 501 K) |
| 1,6 g / l při 20 ° C | |
| Kyselost (strK.A) | 4,76 při 25 ° C |
| Nebezpečí | |
| NFPA 704 (ohnivý diamant) | |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Kyselina sorbovánebo Kyselina 2,4-hexadienová, je přirozený organická sloučenina používá se jako jídlo konzervační.[1] Má chemický vzorec CH3(CH)4CO2H. Je to bezbarvá pevná látka, která je slabě rozpustná ve vodě a vznešené snadno. Poprvé byl izolován z nezralých bobulí Sorbus aucuparia (jeřáb strom), proto jeho název.
Výroba
Tradiční cesta k kyselině sorbové zahrnuje kondenzaci kyselina mallonová a trans-butenální.[2] Může být také připraven z izomerních hexadienových kyselin, které jsou dostupné niklem katalyzovanou reakcí allylchlorid, acetylén, a kysličník uhelnatý. Trasa používaná komerčně je však z krotonaldehyd a keten.[3] Odhaduje se, že se ročně vyrobí 30 000 tun.[4]
Dějiny
Kyselina sorbová byla izolována v roce 1859 autorem destilace z jeřabina naolejovat A. W. von Hofmann. To dovoluje kyselina parasorbová, lakton kyseliny sorbové, kterou hydrolýzou přeměnil na kyselinu sorbovou. Jeho antimikrobiální aktivity byly objeveny na konci 30. a 40. let 20. století a komerčně dostupné byly na konci 40. a 50. let. Začátkem 80. let byla kyselina sorbová a její soli používány jako inhibitory Clostridium botulinum v masných výrobcích nahradit použití dusitany, které mohou produkovat karcinogenní látky nitrosaminy.[5]
Vlastnosti a použití
S pK.A 4,76 je přibližně stejně kyselý jako kyselina octová.
Kyselina sorbová a její soli, jako např sorban sodný, sorbát draselný, a sorban vápenatý, jsou antimikrobiální látky často používané jako konzervační látky v potravinách a nápojích, aby se zabránilo růstu plíseň, droždí, a houby. Obecně jsou soli upřednostňovány před kyselinou, protože jsou rozpustnější ve vodě, ale aktivní formou je kyselina. Optimální pH pro antimikrobiální aktivitu je pod pH 6,5. Sorbáty se obvykle používají v koncentracích od 0,025% do 0,10%. Přidání solí sorbátu do potravin však mírně zvýší pH potravin, takže může být nutné upravit pH, aby byla zajištěna bezpečnost. Nachází se v potravinách, jako jsou sýry a chleby.
The E čísla jsou:
- E200 Kyselina sorbová
- E201 Sorbát sodný
- E202 Sorbát draselný
- E203 Sorbát vápenatý
Některé formy (zejména některé Trichoderma a plísně Penicillium kmeny ) a droždí jsou schopni detoxikovat sorbáty pomocí dekarboxylace, produkující trans-1,3-pentadien. Pentadien se projevuje jako typický zápach petrolej nebo ropa. Mezi další detoxikační reakce patří redukce na 4 ažhexenol a kyselina 4-hexenová.[6]
Kyselinu sorbovou lze také použít jako přísada pro studená guma, a jako meziprodukt při výrobě některých změkčovadla a maziva.[7]
Bezpečnost
Tato sekce potřebuje další citace pro ověření. (Ledna 2018) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
The LD50 hodnota kyseliny sorbové se odhaduje na 7,4 až 10 g / kg. Kyselina sorbová a sorbáty proto mají velmi nízkou toxicitu pro savce - a proto se široce používají při konzervování potravin a nápojů. Kyselina sorbová se přirozeně vyskytuje v lesních plodech, je relativně nestabilní a rychle se rozkládá v půdě, a proto je považována za šetrnou k životnímu prostředí. V těle je obecně metabolizován stejnou oxidační cestou jako 5-uhlíkatá nasycená mastná kyselina kapronová. Panuje obecná shoda, že kyselina sorbová a sorbáty jsou vnitřně prosté karcinogenní aktivity. Ukázalo se však, že mají potenciál podstoupit přeměnu na potenciální mutageny buď oxidací, nebo chemickou reakcí s dusitany při pH 2 - 4,2 - druhé podmínky jsou podmínky, které napodobují žaludeční prostředí. V živých kvasinkových buňkách kyselina sorbová zvyšuje tvorbu volných radikálů kyslíku mitochondriálním transportním řetězcem elektronů, což vede k poškození mitochondriální DNA.
Viz také
Reference
- ^ Piper JD, Piper PW (2017). „Benzoátové a sorbátové soli: Systematický přehled potenciálních rizik těchto neocenitelných konzervantů a rozšiřující se spektrum klinického využití benzoanu sodného“. Komplexní recenze v potravinářské vědě a bezpečnosti potravin. 16 (5): 868–880. doi:10.1111/1541-4337.12284.
- ^ C. F. H. Allen, J. Van Allan (1944). "Kyselina sorbová". Org. Synth. 24: 92. doi:10.15227 / orgsyn.024.0092.CS1 maint: používá parametr autoři (odkaz)
- ^ Ashfordův slovník průmyslových chemikálií, Třetí vydání, 2011, strana 8482
- ^ Erich Lück, Martin Jager a Nico Raczek "Kyselina sorbová" v Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2000.doi:10.1002 / 14356007.a24_507
- ^ A. S. Naidu, ed. (2000). Přírodní potravinářské antimikrobiální systémy. str. 637. ISBN 0-8493-2047-X.
- ^ Kinderlerer JL, Hatton PV (1990). "Plísňové metabolity kyseliny sorbové". Kontaminace potravin. 7 (5): 657–69. doi:10.1080/02652039009373931. PMID 2253810.
- ^ Bingham E, Cohrssen B (2012). Pattyho toxikologie. John Wiley & Sons. str. 547.

