Proximální tubul - Proximal tubule
| Proximální tubul | |
|---|---|
 Schéma renálního tubulu a jeho vaskulární zásobení. (1. spletitý tubul označený nahoře uprostřed.) | |
| Detaily | |
| Předchůdce | Metanefrická blastema |
| Identifikátory | |
| latinský | tubulus proximalis, pars tubuli proximalis |
| Pletivo | D007687 |
| Anatomická terminologie | |
The proximální tubul je segmentem nefron v ledviny který začíná od ledvinového pólu Bowmanova kapsle na začátek smyčka Henle. Lze jej dále rozdělit na proximální spletitý tubul (PCT) a proximální rovný tubul (PST).
Struktura
Nejvýraznější charakteristikou proximálního tubulu je jeho luminál okraj kartáče.
Kartáčovací hraniční buňka
Světelný povrch epiteliální buňky tohoto segmentu nefronu jsou pokryty hustě zabalené mikrovilli tvoří hranici snadno viditelnou pod světelný mikroskop dávat kartáč hraniční buňka jeho jméno. Mikroklky výrazně zvyšují luminální povrch buněk, pravděpodobně usnadňující jejich reabsorpční funkce i domnělé snímání toku v lumenu.[1]
The cytoplazma buněk je hustě nabitý mitochondrie, které se z velké části nacházejí v bazální oblasti uvnitř výběžků bazální plazmatické membrány. Velké množství mitochondrií dává buňkám acidofilní vzhled. Mitochondrie jsou potřebné k dodávání energie pro aktivní transport sodíkových iontů z buněk k vytvoření koncentračního gradientu, který umožňuje více iontů sodíku vstoupit do buňky z luminální strany. Voda pasivně sleduje sodík z buňky podél jeho koncentračního gradientu.
Kuboidní epiteliální buňky lemující proximální tubul mají rozsáhlé boční interdigitace mezi sousedními buňkami, což při pohledu světelným mikroskopem vyvolává dojem, že nemají žádné diskrétní okraje buněk.
Agonální resorpce proximálního tubulárního obsahu po přerušení oběhu v kapiláry obklopení tubulu často vede k narušení buněčné morfologie buněk proximálního tubulu, včetně vyhození buněčných jader do lumen tubulu.
To vedlo některé pozorovatele k tomu, aby popsali lumen proximálních tubulů jako uzavřený nebo „špinavě vypadající“, na rozdíl od „čistého“ vzhledu distální tubuly, které mají zcela odlišné vlastnosti.
Divize
Proximální tubul jako součást nefronu lze rozdělit na dvě části, pars convoluta a pars recta. Mezi těmito segmenty existují rozdíly v obrysech buněk, a proto pravděpodobně také ve funkci.
Ohledně ultrastruktura, lze jej rozdělit do tří segmentů, oS1, S2 a S3:
| Segment | Hrubé divize | Ultrastrukturní dělení | Popis |
|---|---|---|---|
| Proximální tubul | spletitý | S1[2] | Vyšší složitost buněk[2] |
| S2[2] | |||
| rovný | |||
| S3[2] | Nižší složitost buněk[2] |

Proximální spletitý tubul (pars convoluta)
Pars convoluta (latinsky "spletitá část") je počáteční spletitá část.
Ve vztahu k morfologii ledvin jako celku jsou spletité segmenty proximálních tubulů omezeny výhradně na ledvinová kůra.
Někteří vyšetřovatelé na základě konkrétních funkčních rozdílů rozdělili spletitou část na dva určené segmenty S1 a S2.
Proximální rovný tubul (pars recta)
Pars recta (latinsky „straight part“) je následující rovná (sestupná) část.
Přímé segmenty sestupují do vnějšího dřeň. Končí na pozoruhodně jednotné úrovni a je to jejich linie ukončení, která stanoví hranici mezi vnitřním a vnějším pruhem vnější zóny dřeně ledvin.
Jako logické rozšíření výše popsané nomenklatury je tento segment někdy označován jako S3.
Funkce
Vstřebávání
Proximální tubul účinně reguluje pH filtrátu výměnou vodíkových iontů v intersticiu za bikarbonátové ionty ve filtrátu; je také zodpovědný za vylučování organických kyselin, jako je kreatinin a další zásady, do filtrátu.
Kapalina ve filtrátu vstupující do proximálního stočeného tubulu je reabsorbována do peritubulární kapiláry. To je poháněno transportem sodíku z lumenu do krve pomocí Na+/ K.+ ATPáza v bazolaterální membrána epiteliálních buněk.
Tím je primárně poháněna reabsorpce sodíku ATPáza typu P.. 60-70% přefiltrovaného obsahu sodíku je reabsorbováno v proximálním tubulu aktivním transportem, táhnout rozpouštědlem, a paracelulární elektrodifúze. Aktivní transport je hlavně přes sodík / vodík antiporter NHE3.[3] Paracelulární transport zvyšuje účinnost transportu, jak je určeno kyslíkem spotřebovaným na jednotku Na+ reabsorbován, čímž hraje roli při udržování homeostázy kyslíku v ledvinách.[4]
| Látka | filtrátu reabsorbovaného | Komentáře |
| sůl a voda | přibližně dvě třetiny | Velká část hromadného pohybu vody a rozpuštěných látek probíhá buňkami, pasivně přes bazolaterální membránu transcelulární transport, následovaná aktivní resorpcí přes apikální / luminální membránu pomocí Na / K / ATPáza čerpadlo. Rozpuštěné látky jsou absorbovány izotonicky v tom, že osmotický potenciál tekutiny opouštějící proximální tubul je stejný jako u počátečního glomerulárního filtrátu. |
| organický rozpuštěné látky (především glukóza a aminokyseliny ) | 100% | Glukóza, aminokyseliny, anorganické fosfát a některé další rozpuštěné látky jsou resorbovány sekundárním aktivním transportem skrz co-transportéry poháněné sodíkovým gradientem z nefronu. |
| draslík | přibližně 65% | Většina filtrovaného draslíku je resorbována dvěma paracelulární mechanismy - táhnout rozpouštědlem a jednoduchá difúze.[5] |
| močovina | přibližně 50% | Paracelulární tekutina reabsorpce zametá trochu močoviny s sebou pomocí tažení rozpouštědla. Jak voda opouští lumen, zvyšuje se koncentrace močoviny, což usnadňuje difúzi v pozdním proximálním tubulu.[5][stránka potřebná ] |
| fosfát | přibližně 80% | Parathormon snižuje reabsorpci fosfát v proximálních tubulech, ale proto, že také zvyšuje příjem fosfátu z střevo a kosti do krve se reakce na PTH navzájem ruší a sérová koncentrace fosfátu zůstává přibližně stejná. |
| citrát | 70%–90%[6] | Acidóza zvyšuje vstřebávání. Alkalóza snižuje absorpci. |
Vylučování
Mnoho druhů léky jsou vylučovány v proximálním tubulu. Další čtení: Tabulka léků vylučovaných ledvinami
Většina amonný který se vylučuje močí, se tvoří v proximálním tubulu rozpadem glutamin na alfa-ketoglutarát.[7] K tomu dochází ve dvou krocích, z nichž každý generuje amonný anion: přeměnu glutaminu na glutamát a přeměna glutamátu na alfa-ketoglutarát.[7] Alfa-ketoglutarát generovaný v tomto procesu se poté dále rozloží na dvě hydrogenuhličitan anionty,[7] které se odčerpávají z bazolaterální části buňky tubulu společným transportem s ionty sodíku.
Klinický význam

Proximální tubulární epiteliální buňky (PTEC) mají klíčovou roli při onemocnění ledvin. Dva savci buněčné linie se běžně používají jako modely proximálního tubulu: prasečí LLC-PK1 buňky a vačnatec Dobře buňky.[8]
Rakovina
Většina karcinom ledvin, nejběžnější forma rakovina ledvin, vzniká ze spletitých tubulů.[9]
jiný
Akutní tubulární nekróza nastává, když jsou PTEC přímo poškozeny toxiny, jako jsou antibiotika (např. gentamicin ), pigmenty (např. myoglobin ) a sepse (např. zprostředkovaná lipopolysacharid z gramnegativních bakterií). Tubulární acidóza ledvin (proximální typ) (Fanconiho syndrom) nastává, když PTEC nejsou schopny správně reabsorbovat glomerulární filtrát, takže dochází ke zvýšené ztrátě hydrogenuhličitan, glukóza, aminokyseliny, a fosfát.
PTEC se také podílejí na progresi tubulointersticiálního poškození v důsledku glomerulonefritida, ischemie, intersticiální nefritida, cévní poranění a diabetická nefropatie. V těchto situacích mohou být PTEC přímo ovlivněny proteinem (např. Proteinurií v glomerulonefritida ), glukóza (v diabetes mellitus ) nebo cytokiny (např. interferon-y a faktory nekrózy nádorů ). Existuje několik způsobů, jak mohou PTEC reagovat: výroba cytokiny, chemokiny, a kolagen; podstoupí trans-diferenciaci epiteliálního mezenchymu; nekróza nebo apoptóza.
Viz také
Další obrázky

Distribuce krevních cév v kůře ledvin.
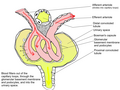
Glomerulus.

TEM negativně obarveného proximálního spletitého tubulu krysy ledviny tkáň při zvětšení ~ 55 000x a 80KV s Těsné spojení.

Ledvinný tělísek

Schéma popisující pohyb iontů v nefronu.
Reference
Tento článek včlení text do veřejná doména z strana 1223 20. vydání Grayova anatomie (1918)
- ^ Wang T (září 2006). "Tokové aktivované dopravní události podél nefronu". Současný názor na nefrologii a hypertenzi. 15 (5): 530–6. doi:10.1097 / 01.mnh.0000242180.46362.c4. PMID 16914967. S2CID 42761720.
- ^ A b C d E Boron WF, Boulpaep EL, eds. (2005). Lékařská fyziologie: buněčný a molekulární přístup. Elsevier / Saunders. p. 743. ISBN 978-1-4160-2328-9.
- ^ Aronson PS (2002). "Iontoměniče zprostředkující transport NaCl v renálním proximálním tubulu". Buněčná biochemie a biofyzika. 36 (2–3): 147–53. doi:10,1385 / CBB: 36: 2-3: 147. PMID 12139400. S2CID 24141102.
- ^ Pei L, Solis G, Nguyen MT, Kamat N, Magenheimer L, Zhuo M, Li J, Curry J, McDonough AA, Fields TA, Welch WJ, Yu AS (červenec 2016). „Paracelulární transport sodíku v epitelu maximalizuje energetickou účinnost v ledvinách“. The Journal of Clinical Investigation. 126 (7): 2509–18. doi:10,1172 / JCI83942. PMC 4922683. PMID 27214555.
- ^ A b Boron WF, Boulpaep EL, eds. (2005). Lékařská fyziologie (Aktualizováno vyd.).[stránka potřebná ]
- ^ Hypocitraturia ~ přehled # aw2aab6b5 na eMedicína
- ^ A b C Rose BD, Rennke HG (1994). Renální patofyziologie: základy. Baltimore: Williams & Wilkins. p.132. ISBN 978-0-683-07354-6.
- ^ Kruidering M, van de Water B, Nagelkerke JF (1996). Metody pro studium renální toxicity. Archivy toxikologie. Doplněk. Archivy toxikologie. 18. str. 173–83. doi:10.1007/978-3-642-61105-6. ISBN 978-3-642-64696-6. PMID 8678793. S2CID 27034550.
- ^ Tomita Y (únor 2006). "Časná rakovina ledvinových buněk". International Journal of Clinical Oncology. 11 (1): 22–7. doi:10.1007 / s10147-005-0551-4. PMID 16508725. S2CID 28183020.
externí odkazy
- Anatomické foto: Močové / savec / kůra1 / kůra6 - Srovnávací organologie na Kalifornské univerzitě v Davisu - „Savec, ledvinová kůra (LM, střední)“
- Nosek, Thomas M. „Sekce 7 / 7ch03 / 7ch03p14“. Základy fyziologie člověka. Archivovány od originál dne 2016-03-24. - "The Nephron: Proximal Tubule, Pars Convoluta & Pars Recta"
- Švýcarská embryologie (z UL, UB, a UF ) turinary / urinhaute02





