Polydnavirus - Polydnavirus
| Polydnavirus | |
|---|---|
 | |
| Elektronová mikrofotografie bracoviru | |
| Klasifikace virů | |
| (bez hodnocení): | Virus |
| Oblast: | incertae sedis |
| Království: | incertae sedis |
| Kmen: | incertae sedis |
| Třída: | incertae sedis |
| Objednat: | incertae sedis |
| Rodina: | Polydnaviridae |
| Rody | |
A polydnavirus /pɒˈlɪdnəprotiaɪrəs/ (PDV) je členem rodina Polydnaviridae z hmyz viry. V současné době existuje 53 druh v této rodině rozdělené na 2 rody. Polydnaviry tvoří a symbiotický vztah s parazitoid vosy (ichnoviry (IV) se vyskytují v ichneumonid vosy druhy a bracoviry (BV) v braconid vosy ), ale na tyto vosy samy parazitují Lepidoptera (můry a motýli).[1][2] Malý nebo žádný sekvenční homologie existuje mezi BV a IV, což naznačuje, že tyto dva rody se dlouho vyvíjely samostatně.
Taxonomie
Skupina: dsDNA
Objednávka: nepřiřazeno
Rodina: Polydnaviridae[2]
- Apanteles crassicornis bracovirus
- Apanteles fumiferanae bracovirus
- Ascogaster argentifrons bracovirus
- Ascogaster quadridentata bracovirus
- Cardiochiles nigriceps bracovirus
- Chelonus altitudinis bracovirus
- Chelonus blackburni bracovirus
- Chelonus inanitus bracovirus
- Chelonus insularis bracovirus
- Chelonus č. curvimaculatus bracovirus
- Chelonus texanus bracovirus
- Cotesia congregata bracovirus
- Cotesia flavipes bracovirus
- Cotesia glomerata bracovirus
- Cotesia hyphantriae bracovirus
- Cotesia kariyai bracovirus
- Cotesia marginiventris bracovirus
- Cotesia melanoscela bracovirus
- Cotesia rubecula bracovirus
- Cotesia schaeferi bracovirus
- Diolcogaster facetosa bracovirus
- Glyptapanteles flavicoxis bracovirus
- Glyptapanteles indiensis bracovirus
- Glyptapanteles liparidis bracovirus
- Hypomicrogaster canadensis bracovirus
- Hypomicrogaster ectdytolophae bracovirus
- Microplitis croceipes bracovirus
- Microplitis demolitor bracovirus
- Phanerotoma flavitestacea bracovirus
- Pholetesor ornigis bracovirus
- Protapanteles paleacritae bracovirus
- Tranosema rostrale bracovirus
- Campoletis aprilis ichnovirus
- Campoletis flavicincta ichnovirus
- Campoletis sonorensis ichnovirus
- Casinaria arjuna ichnovirus
- Casinaria forcipata ichnovirus
- Casinaria infesta ichnovirus
- Diadegma acronyctae ichnovirus
- Ichnovirus Diadegma interruptum
- Diadegma terebrans ichnovirus
- Enytus montanus ichnovirus
- Eriborus terebrans ichnovirus
- Glypta fumiferanae ichnovirus
- Hyposoter annulipes ichnovirus
- Hyposoter exiguae ichnovirus
- Hyposoter fugitivus ichnovirus
- Hyposoter lymantriae ichnovirus
- Hyposoter pilosulus ichnovirus
- Hyposoter rivalis ichnovirus
- Ichnovirus, patron Olesicampe
- Olesicampe geniculatae ichnovirus
- Synetaeris tenuifemur ichnovirus
Struktura
Viry v Polydnaviridae jsou obaleno, s prolovat elipsoid a válcové geometrie. Genomy jsou kruhové a segmentované, složené z více segmentů dvouvláknových, superhelikální DNA zabaleno v kapsid bílkoviny. Jejich délka je kolem 2,0–31 kB.[1]
| Rod | Struktura | Symetrie | Capsid | Genomické uspořádání | Genomická segmentace |
|---|---|---|---|---|---|
| Ichnovirus | Přeložit elipsoid | Obal | Oběžník | Segmentované | |
| Bracovirus | Přeložit elipsoid | Obal | Oběžník | Segmentované |
Životní cyklus
Virová replikace je jaderná. DNA-šablony transkripce je metoda transkripce. Virus opouští hostitelskou buňku exportem jaderných pórů.
Parazitoidní vosy slouží jako hostitelé viru a Lepidoptera jako hostitelé těchto vos. Samice vosy injektuje jedno nebo více vajec do svého hostitele spolu s množstvím viru. Virus a vosa jsou v mutualistic symbiotický vztah: exprese virových genů brání imunitě imunitního systému hostitele vosy zabíjet vajíčko injikované vosy a způsobuje další fyziologické změny, které nakonec způsobí smrt parazitovaného hostitele. Přenosové trasy jsou rodičovské.[1]
| Rod | Podrobnosti o hostiteli | Tkáňový tropismus | Vstupní údaje | Podrobnosti o vydání | Replikační web | Místo montáže | Přenos |
|---|---|---|---|---|---|---|---|
| Ichnovirus | Parazitoidní vosy (Ichneumonidae) | Hemocyty; tlustá těla | Neznámý | Lyza; pučící | Jádro | Jádro | Neznámý |
| Bracovirus | Parazitoidní vosy (Braconidae) | Hemocyty; tlustá těla | Neznámý | Lyza; pučící | Jádro | Jádro | Neznámý |
Biologie
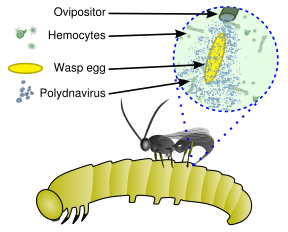
Tyto viry jsou součástí jedinečného biologického systému skládajícího se z endoparazitické vosy (parazitoid ), hostitel (obvykle lepidopteran ) larva a virus. Plný genom viru je endogenní, rozptýlený mezi genomem vosy Virus se replikuje pouze v určité části vaječníku vosků kukly a dospělé samice, nazývané kalich. Virus se vstřikuje spolu s vosím vejcem do tělesné dutiny housenky hostitele lepidopteran a infikuje buňky housenky. Infekce nevede k replikaci nových virů, ale spíše postihuje housenku imunitní systém, protože virion nese virulentní geny místo virových replikačních genů.[3] Mohou být považovány za typ virové vektory.[4]
Bez virové infekce fagocytující hemocyty (krvinky) se zapouzdří a usmrtí vajíčko a larvy vosy, ale imunitní potlačení způsobené virem umožňuje přežití vosího vajíčka a larev, což vede k vylíhnutí a úplnému vývoji nezralé vosy v housence. Navíc geny exprimované z polydnaviru v parazitovaném hostiteli mění vývoj a metabolismus hostitele, aby byly prospěšné pro růst a přežití larvy parazitoidů. Virus a vosa tedy mají symbiotikum (mutualistic ) vztah.[5][6]
Vosí podskupiny nesoucí PDV
Vlastnosti
Oba rody PDV mají určité vlastnosti:
- virové částice každého z nich obsahují více segmentů dsDNA (dvouřetězcová nebo „normální“ DNA, na rozdíl od jednořetězcové DNA nebo RNA s pozitivním nebo negativním smyslem, které se nacházejí v některých jiných virech), přičemž každý segment obsahuje pouze část celý genom (podobně jako chromozomy v eukaryotických organismech)
- genom viru má eukaryotické vlastnosti, jako je přítomnost intronů a nízká hustota kódování
- genom každého viru je integrován do genomu hostitelské vosy
- genom je organizován v několika vícečlenných genových rodinách (které se liší mezi Bracoviry a Ichnoviry)
- virové částice se replikují (produkují) pouze ve specifických typech buněk v reprodukčních orgánech ženské vosy
Avšak morfologie těchto dvou rodů je odlišná, pokud je pozorována elektronovou mikroskopií. Ichnoviry mají tendenci být vejčité (vejčité), zatímco bracoviry jsou krátké tyčinky. Viriony Bracovirů jsou uvolňovány buněčnou lýzou; viriony Ichnovirů se uvolňují pučením.
Vývoj
Nukleová kyselina analýza naznačuje velmi dlouhou asociaci virů s vosy (více než 70 milionů let).
Byly předloženy dva návrhy, jak se vyvinula asociace vosa / virus. První naznačuje, že virus pochází z genů vos. Mnoho parazitoidů, kteří nepoužívají PDV, injektuje proteiny, které poskytují mnoho stejných funkcí, tj. Potlačení imunitní odpovědi na vajíčko parazita. V tomto modelu vosy braconidové a ichneumonidové zabalily geny pro tyto funkce do virů - což v podstatě vytvořilo systém přenosu genů, jehož výsledkem je, že housenka produkuje faktory potlačující imunitu. V tomto scénáři byly strukturní proteiny PDV (kapsidy) pravděpodobně „vypůjčené“ ze stávajících virů.[8]
Alternativní návrh naznačuje, že vosy předků vyvinuly příznivé spojení s existujícím virem, což nakonec vedlo k integraci viru do genomu vosy. Po integraci geny odpovědné za replikaci viru a kapsidy již nebyly (případně) zahrnuty do genomu PDV. Tato hypotéza je podporována zřetelnými morfologickými rozdíly mezi IV a BV, což naznačuje různé viry předků pro tyto dva rody. BV se pravděpodobně vyvinul z a nudivirus ~100 před miliony let.[9] IV má méně jasný původ; ačkoli dřívější zprávy nalezly protein p44 / p53 se strukturálními podobnostmi s askovirus, odkaz nebyl potvrzen v pozdějších studiích.[10] V obou případech byly oba rody vytvořeny prostřednictvím jedné integrační události v příslušných liniích vos.[3]
Tyto dvě skupiny virů v rodině nejsou ve skutečnosti fylogeneticky příbuzné, což naznačuje, že tento taxon může vyžadovat revizi.[11]
Vliv na imunitu hostitele
V hostiteli může být spuštěno několik mechanismů imunitního systému hmyzu, když vosa položí vajíčka a když se vyvíjí parazitická vosa. Když se do těla hmyzu vloží velké tělo (vosí vejce nebo malé částice experimentálně), klasickou imunitní reakcí je zapouzdření hematocyty. Zapouzdřené tělo lze také melanizovat, aby ho zadusilo, a to díky jinému typu hemocytů, který využívá fenoloxidáza cesta k produkci melaninu. Malé částice mohou být fagocytovány a makrofágové buňky pak mohou být také melanizovány v uzlu. A konečně, hmyz může také reagovat produkcí antivirových peptidů.[12]
PolyDNAvirus chrání hymenopteranské larvy před imunitním systémem hostitele a působí na různých úrovních.
- Nejprve mohou deaktivovat nebo zničit hematocyty. PolyDNAvirus spojený s Cotesia rubecula, kód pro protein CrV1, který denaturuje aktinová vlákna v hematocytech, takže tyto buňky jsou méně schopné se pohybovat a ulpívat na larvách.[12] Microplitis demolitor Bracovirus (MdBV) indukuje apoptózu hematocytů díky svému genu PTP-H2.[12] Díky svému genu Glc1.8 také snižuje adhezní kapacitu hematocytů. Gen také inhibuje fagocytózu.[13]
- PolyDNAvirus může také působit na melanizaci, MdBV interferuje s produkcí fenoloxidáza.[14]
- Nakonec polyDNAvirus může také produkovat viry ankyriny, které interferují s produkcí antivirových peptidů.[15] V některých Ichnoviruses, Vankyrin může také zabránit apoptóze, extrémní reakce buňky k blokování šíření viru.[16][17]
- Ichnoviry produkují některé proteiny zvané vinnexiny, které byly uznány jako homologní s innexiny hmyzu. Jsou zodpovědní za kódování strukturálních jednotek mezerových uzlů. Tyto proteiny mohou změnit mezibuněčnou komunikaci, což by mohlo vysvětlit narušení enkapsidace proces.[18]
Virusové částice
Další strategie používaná parazitoidy Blanokřídlí k ochraně jejich potomků je výroba virové částice. VLP jsou svou strukturou podobné virům, ale nenesou žádnou nukleovou kyselinu. Například, Venturia canescens (Ichneumonidea ) a Leptopilina sp. (Figitidaea ) produkují VLP.
VLP lze srovnávat s PolyDNAvirusem, protože jsou vylučovány stejným způsobem a oba působí na ochranu larev před imunitním systémem hostitele. V. canescens-VLP (VcVLP1, VcVLP2, VcNEP ...) se produkují v buňkách kalichu předtím, než jdou do vejcovodů. Práce v roce 2006 nenalezla jejich vazbu na žádné viry a předpokládala buněčný původ.[8] Novější srovnání je spojuje s vysoce přeskupenými domestikovanými Nudivirus sekvence.[19]
VLP chrání lokálně larvy Hymenoptera, zatímco polyDNAvirus může mít globálnější účinek. VLP umožňují larvám uniknout z imunitního systému: larva není hostitelem rozpoznána jako škodlivá nebo imunitní buňky s ní nemohou díky VLP interagovat.[8] V. canescens použijte je místo polydnavirů, protože jejich ichnovirus byl deaktivován.[19]
Vosa Leptopilina heterotoma vylučují VLP, které jsou schopné proniknout do lamellocytů díky specifickým receptorům a poté upravují jejich tvarové a povrchové vlastnosti tak, aby se staly neúčinnými a larvy byly v bezpečí před zapouzdřením.[20] The Leptopilina VLP nebo extracelulární vezikuly smíšené strategie (MSEV) obsahují některé sekreční systémy. Jejich evoluční obraz je méně jasný,[21] ale nedávno nahlášený virus, L. boulardi Zdá se, že vláknitý virus (LbFV) vykazuje podobnosti.[22]
Mikro-RNA
MicroRNA jsou malé fragmenty RNA produkované v hostitelských buňkách díky specifickému enzymatickému mechanismu. Podporují destrukci virové RNA. MicroRNA se váže na virovou RNA, protože jsou komplementární. Pak je komplex rozpoznán enzymem, který jej zničí. Tento jev je známý jako PTGS (pro potlačení post transkripčního genu)[23]
Je zajímavé uvažovat o fenoménu microRNA v kontextu polyDNAviru. Lze formulovat mnoho hypotéz:
- Braconidae nosit nudivirus související geny v jejich genomu,[24] takže mohou být schopni produkovat mikroRNA proti nudiviru jako vrozenou imunitu.
- Vosy možná používají mikroRNA ke kontrole virových genů, které nesou.
- PolyDNAvirus může také používat PTGS k interferenci s expresí genu hostitele.
- PTGS se také používá pro vývoj organismů pomocí stejných enzymů jako umlčování antivirových genů, takže si můžeme představit, že pokud hostitel používá PTGS proti polyDNAviru, možná to také ovlivní jeho vývoj.
Viz také
Reference
- ^ A b C „Virová zóna“. EXPASY. Citováno 15. června 2015.
- ^ A b ICTV. „Virus Taxonomy: 2014 Release“. Citováno 15. června 2015.
- ^ A b Strand, MR; Burke, GR (květen 2015). „Polydnaviry: od objevu k současným poznatkům“. Virologie. 479-480: 393–402. doi:10.1016 / j.virol.2015.01.018. PMC 4424053. PMID 25670535.
- ^ A b Burke, Gaelen R .; Strand, Michael R. (31. ledna 2012). „Polydnaviry parazitických vos: Domestikace virů jako vektory pro dodávání genů“. Hmyz. 3 (1): 91–119. doi:10,3390 / hmyz3010091. PMC 4553618. PMID 26467950.
- ^ Webb, B. A. (1998). Biologie polydnaviru, struktura genomu a evoluce. In Miller, L.K., Ball, L.A., Eds. Viry hmyzu. Plenum Publishing Corporation. 105–139.
- ^ Roossinck, M. J. (2011). „Změny populační dynamiky v mutualistických versus patogenních virech“. Viry. 3 (1): 12–19. doi:10,3390 / v3010012. PMC 3187592. PMID 21994724.
- ^ Murphy, Nicholas; Banks, Jonathan C .; Whitfield, James B .; Austin, Andrew D. (1. dubna 2008). „Fylogeneze parazitických podskupin mikrogastroidů (Hymenoptera: Braconidae) na základě sekvenčních údajů ze sedmi genů se zlepšeným časovým odhadem původu linie“. Molekulární fylogenetika a evoluce. 47 (1): 378–395. doi:10.1016 / j.ympev.2008.01.022. PMID 18325792.
- ^ A b C Annette Reineke; Sassan Asgari & Otto Schmidt (2006). „Evoluční původ Venturia canescens částic podobných virům“. Archiv biochemie a fyziologie hmyzu. 61 (3): 123–133. doi:10.1002 / arch.20113. PMID 16482583.
- ^ Herniou EA, Huguet E, Thézé J, Bézier A, Periquet G, Drezen JM (2013). „Když parazitické vosy unesly viry: genomický a funkční vývoj polydnavirů“. Philos Trans R Soc Lond B Biol Sci. 368 (1626): 20130051. doi:10.1098 / rstb.2013.0051. PMC 3758193. PMID 23938758.
- ^ Volkoff, AN; Jouan, V; Urbach, S; Samain, S; Bergoin, M; Wincker, P; Demettre, E; Cousserans, F; Provost, B; Coulibaly, F; Legeai, F; Béliveau, C; Cusson, M; Gyapay, G; Drezen, JM (27. května 2010). „Analýza strukturních komponent virionu odhalila pozůstatky genomu jejich předků předků“. PLOS patogeny. 6 (5): e1000923. doi:10.1371 / journal.ppat.1000923. PMC 2877734. PMID 20523890.
- ^ Dupuy C, Huguet E, Drezen JM (2006). "Odvíjení evolučního příběhu polydnavirů". Virus Res. 117 (1): 81–89. doi:10.1016 / j.virusres.2006.01.001. PMID 16460826.
- ^ A b C JM. Drezen; S. Savary; M. Poirier; G. Periquet (1999). „Polydnaviry, virové entity domestikované parazitoidními vosami“. Virologie. 3 (1): 11–21.
- ^ Markus Beck & Michael R. Strand (únor 2005). „Glc1.8 z Microplitis demolitor Bracovirus vyvolává ztrátu adheze a fagocytózy v buňkách hmyzu s vysokým počtem pěti a S2“. Journal of Virology. 79 (3): 1861–1870. doi:10.1128 / jvi.79.3.1861-1870.2005. PMC 544146. PMID 15650210.
- ^ Lu Zhiqiang; Beck Markus H .; Strand Michael R (červenec 2010). „Virový protein Egf1.0 je inhibitor dvojí aktivity proteináz 1 a 3 aktivujících prophenoloxidase z Manduca sexta.“ Hmyzí biochemie a molekulární biologie. 40 (7).
- ^ Bae Sungwoo; Kim Yonggyun (1. září 2009). "IkB geny kódované v Cotesia plutellae bracovirus potlačují antivirovou odpověď a zvyšují patogenitu baculoviru proti můře diamantové, Plutella xylostella". Journal of bezobratlých patologie. 102 (1): 79–87. doi:10.1016 / j.jip.2009.06.007. ISSN 0022-2011. PMID 19559708.
- ^ Fath-Goodin A .; Kroemer J. A .; Webb B. A (srpen 2009). „Protein P-vank-1 z ichnovirového vankyrinového proteinu Campoletis sonorensis inhibuje apoptózu v hmyzích buňkách Sf9“. Molekulární biologie hmyzu. 18 (4): 497–506. doi:10.1111 / j.1365-2583.2009.00892.x. PMID 19453763.
- ^ Clavijo G, Dorémus T, Ravallec M, Mannucci MA, Jouan V, Volkoff AN, Darboux I (2011). "Multigenní rodiny v Ichnoviru: Studie specificity tkáně a hostitele prostřednictvím analýzy exprese vankyrinů z Hyposoter didymator Ichnovirus ". PLOS ONE. 6 (11): e27522. Bibcode:2011PLoSO ... 627522C. doi:10.1371 / journal.pone.0027522. PMC 3210807. PMID 22087334.
- ^ Marziano N.K .; Hasegawa D.K .; Phelan P .; Turnbull M.W. (říjen 2011). „Funkční interakce mezi polydnavirem a hostitelskými buněčnými innexiny“. Journal of Virology. 85 (19): 10222–9. doi:10.1128 / jvi.00691-11. PMC 3196458. PMID 21813607.
- ^ A b Leobold, Matthieu; Bézier, Annie; Pichon, Apolline; Herniou, Elisabeth A; Volkoff, Anne-Nathalie; Drezen, Jean-Michel; Abergel, Chantal (červenec 2018). „Domestikace velkého viru DNA pomocí vosy Venturia canescens zahrnuje cílenou redukci genomu prostřednictvím pseudogenizace“. Biologie genomu a evoluce. 10 (7): 1745–1764. doi:10.1093 / gbe / evy127. PMC 6054256. PMID 29931159.
- ^ R. M. Rizki et T. M. Rizki (listopad 1990). „Částice podobné parazitoidovým virům ničí buněčnou imunitu Drosophila“. Sborník Národní akademie věd Spojených států amerických. 87 (21): 8388–8392. Bibcode:1990PNAS ... 87.8388R. doi:10.1073 / pnas.87.21.8388. PMC 54961. PMID 2122461.
- ^ Heavner, ME; Ramroop, J; Gueguen, G; Ramrattan, G; Dolios, G; Scarpati, M; Kwiat, J; Bhattacharya, S; Wang, R; Singh, S; Govind, S (25. září 2017). „Nové organely s prvky bakteriálních a eukaryotických sekrečních systémů zneškodňují parazity Drosophily“. Aktuální biologie. 27 (18): 2869–2877.e6. doi:10.1016 / j.cub.2017.08.019. PMC 5659752. PMID 28889977.
- ^ Giovanni, D. Di; Lepetit, D .; Boulesteix, M .; Couté, Y .; Ravallec, M .; Varaldi, J. (6. června 2019). "Virus manipulující s chováním jako zdroj adaptivních genů pro vosy parazitoidů". bioRxiv 10.1101/342758.
- ^ Li, H.W. & Ding, S.W. (2005). „Antivirové tlumení u zvířat“. FEBS Lett. 579 (26): 5965–5973. doi:10.1016 / j.febslet.2005.08.034. PMC 1350842. PMID 16154568.
- ^ Bézier A, Annaheim M, Herbinière J, Wetterwald C, Gyapay G, Bernard-Samain S, Wincker P, Roditi I, Heller M, Belghazi M, Pfister-Wilhem R, Periquet G, Dupuy C, Huguet E, Volkoff AN, Lanzrein B, Drezen JM (13. února 2009). „Polydnaviry vos braconidů pocházejí z rodového nudiviru“. Věda. 13. 323 (5916): 926–30. Bibcode:2009Sci ... 323..926B. doi:10.1126 / science.1166788. PMID 19213916.
- Správa ICTVdB (2006). 00,055. Polydnaviridae. In: ICTVdB — The Universal Virus Database, verze 4. Büchen-Osmond, C. (Ed), Columbia University, New York, USA
- Fleming, J.-A. G. W. & Summers, M. D. (1991). „Polydnavirová DNA je integrována do DNA svého parazitoidního vosího hostitele“. Sborník Národní akademie věd. 88 (21): 9770–9774. Bibcode:1991PNAS ... 88.9770F. doi:10.1073 / pnas.88.21.9770. PMC 52802. PMID 1946402.
- Whitfield, J. B. (2002). „Odhad stáří symbiózy vosy polydnavirus-braconid. Sborník Národní akademie věd. 99 (11): 7508–7513. Bibcode:2002PNAS ... 99,7508W. doi:10.1073 / pnas.112067199. PMC 124262. PMID 12032313.
- Espagne, E .; et al. (2004). „Genome Sequence of a Polydnavirus: Insights into Symbiotic Virus Evolution“. Věda. 306 (5694): 286–289. Bibcode:2004Sci ... 306..286E. doi:10.1126 / science.1103066. PMID 15472078.
- Webb, B. A .; et al. (2006). „Polydnavirové genomy odrážejí jejich dvojí roli jako vzájemných a patogenů“. Virologie. 347 (1): 160–174. doi:10.1016 / j.virol.2005.11.010. PMID 16380146.
- Bernard-Samain, S., Wincker, P., IRoditi, I., Heller, M., Belghazi, M., Pfister-Wilhem, R., Periquet, G., Dupuy, C., Huguet, E., Volkoff , AN, Lanzrein, B., Drezen, JM, Polydnaviruses of Braconid Wasps
externí odkazy
- http://research.biology.arizona.edu/mosquito/willott/507/polydnaviruses.html
- Polydnavirová DNA je integrována do DNA hostitele parazitoidních vos —Článek z Sborník Národní akademie věd.
- Abstraktní článku PNAS.
- Genome Sequence of a Polydnavirus: Insights into Symbiotický Virus Evolution článek z Science.
- Viralzone: Polydnaviridae
- ICTV
