Myší modely metastáz rakoviny prsu - Mouse models of breast cancer metastasis
Modely metastatických myší s rakovinou prsu jsou experimentální přístupy, ve kterých jsou myši geneticky manipulováno vyvinout a nádor prsu což vede ke vzdáleným ložiskovým lézím prsu epitel vytvořil metastáza. Rakoviny prsu u myší mohou být způsobeny geneticky mutace které byly identifikovány u lidské rakoviny. To znamená, že modely lze generovat na základě molekulárních lézí v souladu s lidským onemocněním.
Metastáza rakoviny prsu
Metastáza je proces migrace z nádorové buňky z místa primární rakoviny do vzdáleného místa, kde rakovinné buňky tvoří sekundární nádory. Metastatický karcinom prsu představuje nejničivější atribut rakoviny a je považován za událost pokročilého stadia.[1] Lidská rakovina prsu metastázuje do několika vzdálených orgánů, jako je mozek, plíce, kosti a játra.
Genetická rozmanitost mezi primárním a metastatickým nádorem
Klasická teorie vyvinutá na počátku 70. let předpokládala, že metastázy jsou způsobeny geneticky podmíněnými subpopulacemi v primárních nádorech.[2] Genetické rozptyl mezi metastatickými ložisky je významná pouze u konkrétních místo a v rámci specifických buněčných populací nebo pouze jednobuněčná populace vykazuje rozdíly a některá lokusy se liší pouze v jedné buněčné subpopulaci. To vysvětluje koncept heterogenita nádoru a pořadí genetických událostí během vývoj nádoru. Mnoho genů, které řídí růst v primárním místě, může určit šíření a kolonizace na ektopická stránka.[3][4][5] Rakovina prsu je geneticky a klinicky považována za heterogenní onemocnění, protože odráží heterogenita normální prsní tkáně při jejím vzniku 17873350.[6] Musí se vyskytnout řada samostatných genetických událostí, aby se umožnilo jednotlivým nádorovým buňkám, které mají schopnost růst v ektopickém místě. Metastatická progrese závisí na regulaci vývojových programů a událostech prostředí.[7] Metastatický potenciál dílčích populací v buňkách myší mléčné žlázy je nyní považován za relativně časnou událost a k šíření dochází současně s preinvazivními nebo mikroinvazivními lézemi.[8][9] Genetické profily primárních a metastatických léze v prsou karcinomy vykazují velký rozsah klonální příslušnost mezi lézemi.[10][11] Existují různé vzorce prevalence genetických mutací v genomech primárního nádoru prsu a jeho metastázách.[12][13][14] Potvrzuje také genetickou heterogenitu mezi primární novotvar pacientů s rakovinou prsu a jejich příslušných metastáz.[15][16]
Geny podílející se na orgánově specifických metastázách
Rakovina prsu fenotypy pravidelně vyjadřovat geny v metastázování, které jsou pro metastatický proces nepostradatelné. Metastatická diverzita je zprostředkována aktivací genů, které působí jako vazba na orgánově specifický růst.[17] Růst lézí v ektopickém místě závisí na mnoha komplexních interakcích mezi metastatickými buňkami a hostitelem homeostatický mechanismy. Smrtící Interakce protein-protein v metastatickém místě pomáhají přežít přizpůsobeno buňky.[18]
Generování myších modelů rakoviny prsu
Cílené vyjádření onkogeny v myších prsních epiteliálních buňkách je způsob modelování lidské rakoviny prsu. Mutace nebo nadměrná exprese onkogenů může být udržována pod řízenou expresí ve velmi specifickém buněčném kontextu spíše než v celém organismu. Další způsob modelování lidské rakoviny prsu se provádí cílenou inhibicí tumor supresorového genu.[19]
Myši v genetickém výzkumu
- V roce 1909 Clarence C. Malý vyvinuli první inbrední kmen, DBA (Zředěná, hnědá non-Agouti) myš.
- V roce 1915 identifikoval N.M Haldane první vazbu mezi myší Albín myši a zředění růžových očí chromozóm sedm.
- V roce 1921 C57BL se stala jednou z nejpoužívanějších myší v genetice a byla prvním kmenem, který měl svůj genom seřazeno.
- V roce 1982 Palmiter a Brinster implantoval cizí gen do oplodněné vajíčko, nakonec generuje první transgenní myši geneticky inženýrství exprimovat dominantní onkogeny.[20]
- V roce 1982 byla stimulace projevu z MMTV-LTR (virus myšího nádoru mléčné žlázy - dlouhé terminální opakování) bylo provedeno několika koly těhotenství a laktace vyhodnotit význam buňky protoonkogen, c-myc.[21]
Člověk a myš: genomické srovnání
Genetické studie běžných onemocnění u lidí trpí významnými omezeními pro praktické a etický důvodů.[22] Člověk buněčné linie lze použít k modelování onemocnění, ale je obtížné studovat procesy na tkáň úrovni, uvnitř orgánu nebo přes celé tělo. Myši mohou být dobrým zastoupením nemocí u lidí, protože :.[23]
- Existují blízké podobnosti fyziologie, vývoj a buněčná biologie mezi myší a lidmi.
- Lidé i myši mají přibližně 30 000 genů kódujících bílkoviny. Počet myších genů bez odpovídajícího lidského homologu je menší než 1%.
- 90% lidských a myších genomů je syntenický.
- 40% lidských i myších genomů lze srovnat na nukleotid úroveň.
- Myši mají relativně krátké těhotenství období.
- Myším trvá krátký čas, než dosáhnou pohlavní dospělosti.
- Myši mají velké velikosti vrhu.
- Dostupnost stovek mutací ovlivňujících téměř každou tkáň a aspekt vývoje.
Myši nemusí být ideálním modelem pro rakovinu prsu. Je to hlavně kvůli nedostatečné přesnosti u mnoha modelů. Při pohledu na metastázu je obtížné určit přesnou polohu a její frekvenci. Další problém se točí kolem epiteliálních podtypů a neschopnosti je konkrétně cílit při cílení na mutaci. Příkladem toho by mohlo být stanovení vývoje nádorů u myší K14-Cre BRCA2. Ve standardním případě excize BRCA2 nevedla k žádné tumorgenezi, ale pokud by byl p53 mutován a inaktivován, došlo by k tumorgenezi. Proto neexistuje definitivní odpověď, pokud jde o původ nádoru, kvůli zvláštní mutaci v p53.[24]
Buněčné linie metastatického myšího karcinomu prsu
Různé buněčné linie myšího mléčného karcinomu, jako 4T1[25] a TS / A, jsou metastatické u syngenních imunokompetentních myší a lze je použít k identifikaci genů a drah zapojených do metastatického procesu.[26]
Jednoduché modely transplantace nádoru
Transplantace nádorových buněk do imunodeficitní myši je nástroj ke studiu rakoviny prsu a jejích metastatických účinků. Transplantace probíhá buď jako alotransplantáty nebo xenografické transplantace.[27] Lidské buňky běžně jsou naočkovaný u imunokompromitovaných myší příjemce. Očkování buněk nitroděložními transplantacemi,[28] injekcemi vymazaného mléčného tuku[29][30] nebo transplantacemi do ocasní žíly.[31][32][33] Různé orgány mohou být naočkovány buňkami rakoviny prsu v závislosti na cestě injekce[34]
- Srdeční injekce: Kosti
- Injekce do ocasní žíly: Plíce
- Injekce sleziny: Játra
- Injekce krční tepny: mozek
Modely transplantace tkáně nádoru
Specifické imunodeficientní myši, které byly použity, byly NOD / SCID myš (neobézní diabetik / těžký podmíněný imunodeficit). Tyto mutace umožňují integraci nové tkáně xenograftu. Myši musí nejprve nechat humanizovat prsní tukové polštářky injekcí lidské telemorázy imortalizované lidské prsní stromální fibroblasty (RMF / EG fibroblasty) do prsních tukových polštářků. Bez této injekce nejsou lidské epiteliální buňky mléčné žlázy naroubované na destičku schopny kolonizovat a růst. Fibroblast RMF / EG musí být poté ozářen, aby umožnil expresi klíčových proteinů a růstových faktorů. Po 4 týdnech vývoje se nově naočkované lidské epiteliální buňky mléčné žlázy rozšířily do tukového polštářku.[35]
Geneticky upravené myši ke studiu metastáz
Geneticky upravené myši jsou konstruovány tak, aby modelovaly člověka fenotypy a patologie. Mutantní myši mohou zahrnovat transgeny pomocí různých způsobů doručení:
- Použití bakterií odvozeného tetracyklinem indukovatelného systému umožňujícího zapnutí nebo vypnutí (Systém Tet-On / Tet-Off)[36]
- Cílené mutace podle knock in gen a vyřazovací sekvence používáním Cre-Lox rekombinace Systém[37]
- Představení retro virové mutace[38]
- Zavedení chemicky indukovaných mutací
Transgenní myší modely rakoviny prsu
Myši podstupující proces transgeneze jsou známé jako transgenní myši. Základní transgen má a promotér oblast, sekvence kódující protein, Intron a a stop kodon. Virus myšího prsního nádoru (MMTV) je retro virus, který je známým promotorem způsobujícím po aktivaci nádory prsu.[39] MMTV je dědičný somatický mutagen, jehož cílové rozmezí je omezené. Obsahuje regulační sekvenci DNA zvanou long terminal repeat (LTR), která podporuje transkripci indukovanou steroidními hormony.[40][41] Tumorgenezi, která byla indukována virem myšího mléčného nádoru, lze také provést integrací virového genomu. Je známo, že místa integrace jsou kritickými geny pro buněčnou regulaci.[42]Syrovátkový kyselý protein (WAP),[43] je další běžný promotor používaný ke generování myších modelů rakoviny prsu. Seznam dalších promotorů specifických pro mléčnou žlázu a modelů myší viz.[44]
MMTV-PyMT
MMTV-PyMT je model metastáz rakoviny prsu, ve kterém se MMTV-LTR používá k řízení exprese specifické pro mléčnou žlázu polyomavirus střední T-antigen, což vede k rychlému rozvoji vysoce metastatických nádorů.[45] MMTV-PyMT je nejčastěji používaným modelem pro studium progrese a metastáz nádoru mléčné žlázy. Myši MMTV-PyMT jsou potom kříženy s jinými geneticky modifikovanými myšmi za účelem generování různých typů modelů rakoviny prsu, včetně:
- Signalizace PI3K / Akt v metastázách lze prokázat v MMTV-PyMT; Akt1 - / - myši.[46]
- Chemoatraktivní parakrinní smyčka z faktor stimulující kolonie-1 (CSF-1) a EGF ligandy mezi nádorovými makrofágy (TAM) a nádorovými buňkami a metastázy v plicích lze studovat křížením myší MMTV-PyMT s myší Csf-1 - / -.[47]
- Role vrozený a adaptivní imunní odpověď na pomoc metastázám může být studována v MMTV-PyMT; Rag1 - / - myši, ve kterých CD4 + T buňky jsou selektivně ztraceny. Interleukin-4 (IL4) chybí model MMTV-PyMT; IL4 - / - myši.[48]
- Úloha molekuly adheze CD44 při metastázách v plicích.[49]
- Podmíněná ablace v buňkách rakoviny prsu MMTV-PyMT bylo provedeno s cílem odhalit pro-metastatické účinky angiogenní faktory, Cévní endoteliální růstový faktor A (VEGF-A).[50]
- Role autokrinní transformující růstový faktor signalizace beta 1 (TGF-β1) na motilitu a přežití v buňkách PymT odvozených od myší rakoviny prsu MMTV-PymT.[51]
- Jiné jsou MMTV-PyMT; uPA - / -[52] a MMTV-PyMT; MEKK1 - / -.[53]
MMTV-HER2 / neu
MMTV-LTR lze také použít k podpoře receptorové tyrosin-proteinkinázy ErbB2 k transformaci epitelu myšího prsu. ErbB2 je onkogen amplifikovaný a nadměrně exprimovaný u přibližně 20% lidských karcinomů prsu. U myší nesoucích tento onkogen se přibližně 15 týdnů po těhotenství vyvinuly multifokální adenokarcinomy s plicními metastázami.[54][55]K vytvoření přesnější reprezentace mutací genu HER2 vědci spojili myší gen obsahující neu a krysí gen obsahující neu. To řeší problém, pokud jde o modelování amplifikace HER2 ve vývoji myší. U nefúzované myši by se mléčná žláza vrátila k téměř panenské, ale s tímto přídavkem si mléčná žláza udržovala rozvinutou funkci.[56]
Bi-transgenní modely
Myší modely mající dva transgeny se nazývají bi transgenní. Aby zkontrolovali spolupráci dvou onkogenů, Tim Stewert a skupina vyrobili první bi-transgenní myší modely v roce 1987, MMTV-Moje C a MMTV- Ras myši byly kříženy s výsledným zrychlením tumorigeneze.[57] Vyjádření TGFβ v buňkách rakoviny prsu MMTV-ErbB2; Dvojitě transgenní myši MMTV-TGFp mohou indukovat vyšší hladiny cirkulujících nádorových buněk a plicní metastázy.[58] Gen Ras lze kombinovat s rtTA (reverzní tetracyklinový transaktivátor) generovat bi-transgenní indukovatelný myší model prostřednictvím tetracyklinem řízené transkripční aktivace, např. myši nesoucí TetO-KrasG12D (TOR) a MMTV-rtTA (MTB), přicházejí s transgenem exprimujícím reverzní tetracyklinový transaktivátor (rtTA) v epiteliálních buňkách mléčné žlázy.[59]
Tri-transgenní modely
Tri-transgenní myší modely tvoří více než dva geny. Vícenásobné kombinace a genetické modifikace jsou prováděny takovým způsobem, že buď jeden nebo všechny geny jsou uvedeny do nepřetržitě exprimovaného stavu, nebo kontrolovaným způsobem k jejich aktivaci v různých časových bodech. Například TOM (TetO-myc); TOR; MTB myši, kde geny myc (M) a ras (R) jsou pod kontrolou operátorů tetracyklinů. Mohou být také aktivovány nebo deaktivovány přidáním doxycyklinu. Jiné kombinace v tomto ohledu jsou TOM; Kras; MTB, kde myc může být indukován a neindukován v různých časových bodech, zatímco Kras je v nepřetržitém vyjádřeném stavu, a myc; TOR; MTB model je naopak.[60]
Aplikace geneticky modifikovaných myší ke studiu metastáz
Metastatická kaskáda může být studována udržováním aktivace genu pod kontrolou nebo přidáním reportérového genu, např. Beta aktin GFP (zelený fluorescenční protein) nebo RFP (červený fluorescenční protein).
Identifikace genů, které regulují metastázy
Vyřazením / vyřazením specifických genů pomocí homologní rekombinace lze měřit rozsah metastáz a lze dosáhnout identifikace nových cílových genů, např. gen, který důsledně reguluje metastatické chování rakovinných buněk, je TGF-β1. Akutní ablace signalizace TGF-p v buňkách prsních nádorů MMTV-PyMT vede k pětinásobnému zvýšení plicních metastáz.[61]Lze také analyzovat určité oblasti zesilovače a lze je určit jako zásadní součást buněčné proliferace, např. zlepšující oblast, která je spojena s genem p53 kritickým pro rakovinu, který byl stanoven pomocí CRISPR-Cas9.[62]
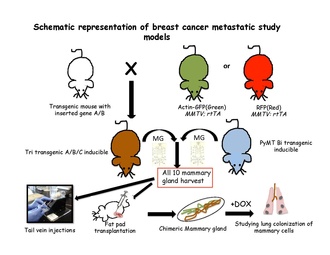
Trasování linie v modelech metastáz
Strategie kvantitativního sledování linie se ukázaly jako úspěšné při řešení buněčných osudů v normálních epiteliálních tkáních buď pomocí tkáňově specifických nebo kmenová buňka -specifické transgeny. Aby bylo možné provést experiment s indukovatelným sledováním linie, musí být do genomu myši zavedeny dvě složky: přepínač a reportér. Přepínač je obvykle lékem regulovaná forma bakteriálního enzymu Cre-rekombinázy. Tento enzym rozpoznává specifické sekvence, které se nazývají místa LoxP.[63] Proteiny, které jsou schopné zesílit identifikaci značených buněk nebo specifické populace v neznačených buňkách, jsou kódovány reportérovými transgeny. Po odebrání všech deseti myších mléčných žláz z transgenních myší se obvykle připraví jednobuněčná suspenze a transplantuje se buď do ocasní žíly netransgenních myších příjemců[31] nebo v vyčištěném tukovém polštářku netransgenních myší repopulujících prsní tukový polštář.[64] Tyto buňky jsou poté sledovány v krevním řečišti, plicích, kostní dřeni a játrech, aby se vyhledalo příznivé místo pro metastázování. Tyto transgenní buňky lze vysledovat podle jejich zvláštních rysů buď fluorescence, nebo indukovaných umístěním příjemců na doxycyklinovou potravu.
Cirkulující nádorové buňky
Dalším nástrojem ke studiu metastáz rakoviny prsu je hledat cirkulující nádorové buňky u transgenních myší, např. Myši MMTV-PyMT mohou reagovat na různé terapie při vylučování nádorových buněk v krvi, což vede k plicním metastázám.[65] Nejen v krvi, ale i v kostní dřeni lze detekovat buňky, např. cytokeratin pozitivní buňky v kostní dřeni transgenních myší MMTV-pyMT a MMTV-Neu byly identifikovány, ale ne u kontrol divokého typu.[66]
Omezení
Při absenci specifických markerů pro buňky mléčné žlázy poskytují modely s genetickým značením nádorových buněk nejlepší experimentální výhodu, avšak použití této techniky omezuje nízký objem periferní krve, který lze získat ze živých zvířat.
In vivo zobrazování modelů metastatických myší
Transgenní myší modely lze zobrazovat různými neinvazivními technikami.
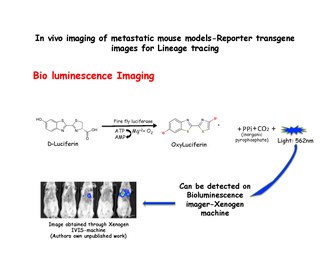
Bioluminiscenční zobrazování
Bioluminiscenční zobrazování spoléhá na detekci světla produkovaného enzymatickou oxidací exogenního substrátu. Substrát luciferin je oxidován na oxyluciferin v přítomnosti luciferáza a vyzařuje světlo, které lze detekovat pomocí systému IVIS, jako je přístroj Xenogen. Disociované prsní buňky od MMTV-PyMT: IRES: Luc; MTB (Místo vstupu do vnitřního ribozomu: Luciferin ) zvířatům (která nebyla vystavena doxycyklinu) lze injikovat do bočních ocasních žil imunodeficitních myší na dietě bez doxycyklinů. V plicích příjemců myší nebude pozorován žádný bioluminiscenční signál, dokud jim nebude podána doxycyklinová potrava. Bioluminiscence pak může být detekována v hrudníku do 2 týdnů od začátku expozice doxycyklinu.[31] Luciferáza se vstřikuje těsně před pořízením snímků.
Fluorescenční zobrazování
Intravitální mikroskopie s excitací více fotonů je technika vizualizace geneticky upravených buněk přímo in vivo. Vícestupňové metastatické kaskády lze vizualizovat značením s jedinečnou fluorescenční barvou pod fluorescenční mikroskop.[67][68]
Radioizotopové zobrazování
Pozitronová emisní tomografie (PET), počítačová tomografie s emisemi jednoho fotonu (SPECT) a počítačová tomografie (CT) byly použity k porovnání účinnosti těchto in vivo zobrazovacích metod pro detekci lézí v rané fázi a pro vyhodnocení odpovědi na chemoterapii.[69]
MRI zobrazování
Zobrazování magnetickou rezonancí vyžaduje použití nanočástic (liposomů) a MRI kontrastní látky zvané gadolinium. Částice pak byly umístěny do vezikul přes polykarbonátový membránový filtr. Nanočástice se injikují do myší s vyvinutými metastázami a nechají se tam dvacet čtyři hodin. Tyto myši jsou poté skenovány a v zobrazovacím softwaru dochází k akumulaci těchto částic v určitých oblastech, kde buňky metastázovaly.[22]
Viz také
- Ensembl genomová databáze modelových organismů
- Mapování osudu
- Světluška luciferin
- Genové cílení
- Zachytávání genů
- Genetická rekombinace
- Historie modelových organismů
- Homologní rekombinace
- Výměna kazety zprostředkovaná rekombinázou
- Site-specific recombinase technology
Reference
- ^ Hanahan, D .; Weinberg, R. (2000). "Charakteristické znaky rakoviny". Buňka. 100 (1): 57–70. doi:10.1016 / S0092-8674 (00) 81683-9. PMID 10647931.
- ^ Fidler, I. J. (1973). "Výběr po sobě jdoucích nádorových linií pro metastázy". Příroda nová biologie. 242 (118): 148–9. doi:10.1038 / newbio242148a0. PMID 4512654.
- ^ Martins, F. C .; De, S; Almendro, V; Gönen, M; Park, S. Y .; Blum, J.L .; Herlihy, W; Ethington, G; Schnitt, S. J .; Tung, N; Garber, J. E.; Fetten, K; Michor, F; Polyak, K (2012). "Evoluční cesty v nádorech prsu souvisejících s BRCA1". Objev rakoviny. 2 (6): 503–11. doi:10.1158 / 2159-8290.CD-11-0325. PMC 3738298. PMID 22628410.
- ^ Shah, S. P .; Morin, R. D .; Khattra, J; Prentice, L; Pugh, T; Burleigh, A; Delaney, A; Gelmon, K; Guliany, R; Senz, J; Steidl, C; Holt, R. A .; Jones, S; Sun, M; Leung, G; Moore, R; Severson, T; Taylor, G. A .; Teschendorff, A.E .; Tse, K; Turashvili, G; Varhol, R; Warren, R.L .; Watson, P; Zhao, Y; Caldas, C; Huntsman, D; Hirst, M; Marra, M. A .; Aparicio, S (2009). „Mutační vývoj v lobulárním nádoru prsu profilovaném při rozlišení jednoho nukleotidu“. Příroda. 461 (7265): 809–13. doi:10.1038 / nature08489. PMID 19812674.
- ^ Geyer, F. C .; Weigelt, B; Natrajan, R; Lambros, M. B .; De Biase, D; Vatcheva, R; Savage, K; MacKay, A; Ashworth, A; Reis-Filho, J. S. (2010). „Molekulární analýza odhaluje genetický základ pro fenotypovou rozmanitost metaplastických karcinomů prsu“. The Journal of Pathology. 220 (5): 562–73. doi:10,1002 / cesta. 2675. PMID 20099298.
- ^ Ashkenazi, R; Jackson, T. L .; Dontu, G; Wicha, M. S. (2007). „Možnosti výzkumu kmenových buněk rakoviny prsu s využitím matematického modelování“. Recenze kmenových buněk. 3 (2): 176–82. doi:10.1007 / s12015-007-0026-2. PMID 17873350.
- ^ Müller, A; Domácí, B; Soto, H; Ge, N; Catron, D; Buchanan, M. E.; McClanahan, T; Murphy, E; Yuan, W; Wagner, S.N .; Barrera, J. L .; Mohar, A; Verástegui, E; Zlotnik, A (2001). "Zapojení chemokinových receptorů do metastáz rakoviny prsu". Příroda. 410 (6824): 50–6. doi:10.1038/35065016. PMID 11242036.
- ^ Klein, C. A. (2009). "Paralelní progrese primárních nádorů a metastáz". Nature Reviews Cancer. 9 (4): 302–12. doi:10.1038 / nrc2627. PMID 19308069.
- ^ Weng, D; Penzner, J. H .; Píseň, B; Koido, S; Calderwood, S. K.; Gong, J (2012). „Metastáza je časná událost u myších karcinomů mléčné žlázy a je spojena s buňkami nesoucími markery kmenových buněk“. Výzkum rakoviny prsu. 14 (1): R18. doi:10.1186 / bcr3102. PMC 3496135. PMID 22277639.
- ^ Liu, W; Laitinen, S; Khan, S; Vihinen, M; Kowalski, J; Yu, G; Chen, L; Ewing, C. M .; Eisenberger, M. A .; Carducci, M. A .; Nelson, W. G .; Yegnasubramanian, S; Luo, J; Wang, Y; Xu, J; Isaacs, W. B .; Visakorpi, T; Bova, G. S. (2009). „Analýza počtu kopií naznačuje monoklonální původ smrtelného metastatického karcinomu prostaty“. Přírodní medicína. 15 (5): 559–65. doi:10,1038 / nm. 1944. PMC 2839160. PMID 19363497.
- ^ Torres, L; Ribeiro, F. R .; Pandis, N; Andersen, J. A .; Heim, S; Teixeira, M. R. (2007). "Intratumorová genomová heterogenita u rakoviny prsu s klonální divergencí mezi primárními karcinomy a metastázami v lymfatických uzlinách". Výzkum a léčba rakoviny prsu. 102 (2): 143–55. doi:10.1007 / s10549-006-9317-6. PMID 16906480.
- ^ Pandis, N; Teixeira, M. R.; Adeyinka, A; Rizou, H; Bardi, G; Mertens, F; Andersen, J. A .; Bondeson, L; Sfikas, K; Qvist, H; Apostolikas, N; Mitelman, F; Heim, S (1998). "Cytogenetické srovnání primárních nádorů a metastáz v lymfatických uzlinách u pacientek s rakovinou prsu". Geny, chromozomy a rakovina. 22 (2): 122–9. doi:10.1002 / (SICI) 1098-2264 (199806) 22: 2 <122 :: AID-GCC6> 3.0.CO; 2-Z. PMID 9598799.
- ^ Kuukasjärvi, T; Karhu, R; Tanner, M; Kähkönen, M; Schäffer, A; Nupponen, N; Pennanen, S; Kallioniemi, A; Kallioniemi, O. P .; Isola, J (1997). "Genetická heterogenita a klonální evoluce, která je základem vývoje asynchronních metastáz u lidské rakoviny prsu". Výzkum rakoviny. 57 (8): 1597–604. PMID 9108466.
- ^ Bonsing, B. A .; Corver, W. E .; Fleuren, G. J .; Cleton-Jansen, A. M .; Devilee, P; Cornelisse, C. J. (2000). „Allelotypová analýza tokově tříděných buněk rakoviny prsu demonstruje geneticky příbuzné diploidní a aneuploidní subpopulace v primárních nádorech a metastázách v lymfatických uzlinách“. Geny, chromozomy a rakovina. 28 (2): 173–83. doi:10.1002 / (SICI) 1098-2264 (200006) 28: 2 <173 :: AID-GCC6> 3.0.CO; 2-1. PMID 10825002.
- ^ Wu, J. M .; Fackler, M. J .; Halushka, M. K .; Molavi, D. W .; Taylor, M. E.; Teo, W. W .; Griffin, C; Fetting, J; Davidson, N.E .; De Marzo, A. M .; Hicks, J.L .; Chitale, D; Ladanyi, M; Sukumar, S; Argani, P (2008). „Heterogenita metastáz rakoviny prsu: Porovnání exprese terapeutického cíle a methylace promotoru mezi primárními tumory a jejich multifokálními metastázami“. Klinický výzkum rakoviny. 14 (7): 1938–46. doi:10.1158 / 1078-0432.CCR-07-4082. PMC 2965068. PMID 18381931.
- ^ Schmidt-Kittler, O; Ragg, T; Daskalakis, A; Granzow, M; Ahr, A; Blankenstein, T. J .; Kaufmann, M; Diebold, J; Arnholdt, H; Muller, P; Bischoff, J; Harich, D; Schlimok, G; Riethmuller, G; Eils, R; Klein, C. A. (2003). „Od latentních diseminovaných buněk po zjevné metastázy: Genetická analýza systémové progrese rakoviny prsu“. Sborník Národní akademie věd. 100 (13): 7737–42. doi:10.1073 / pnas.1331931100. PMC 164657. PMID 12808139.
- ^ Martín, B; Sanz, R; Aragüés, R; Oliva, B; Sierra, A (2008). „Funkční shlukování metastázových proteinů popisuje zdroje plastické adaptace buněk rakoviny prsu na nová mikroprostředí“. Journal of Proteome Research. 7 (8): 3242–53. doi:10.1021 / pr800137w. PMID 18582095.
- ^ Langley, R. R .; Fidler, I.J. (2007). „Interakce mikroprostředí nádor-buňka-orgán v patogenezi rakovinových metastáz“. Endokrinní hodnocení. 28 (3): 297–321. doi:10.1210 / er.2006-0027. PMID 17409287.
- ^ Gupta, PB; Kuperwasser, C. (2004). Chorobné modely rakoviny prsu. Drug Discovery Today: Disease Models 1 (1), 9-16. doi: 10.1016 / j.ddmod.2004.05.001
- ^ Palmiter, R. D .; Brinster, R.L .; Hammer, R.E .; Trumbauer, M. E .; Rosenfeld, M. G .; Birnberg, N. C .; Evans, R. M. (1992). „Dramatický růst myší, který se vyvíjí z vajec mikroinjikovaných fúzními geny metalothioneinu a růstového hormonu. 1982“. Biotechnologie (Reading, Massachusetts). 24: 429–33. PMID 1422050.
- ^ Nusse, R; Varmus, H. E. (1982). „Mnoho nádorů vyvolaných virem myšího mléčného nádoru obsahuje provirus integrovaný ve stejné oblasti hostitelského genomu.“ Buňka. 31 (1): 99–109. doi:10.1016/0092-8674(82)90409-3. PMID 6297757.
- ^ A b Goldman, E; Zinger, A; Silva, DD; Yaari, Z; Vardi-Oknin, D; Goldfeder, M; Schroeder, JE; Shainsky-Roitman, J; Hershkovitz, D; Schroeder, A; (2017). Nanočástice se zaměřují na metastázy rakoviny prsu v raném stadiu in vivo. Nanotechnologie 28 (43), 1-13. doi: 10,1086 / 13616528 / aa8a3d
- ^ Chinwalla, A. T .; Waterston, L. L .; Lindblad-Toh, K. D .; Birney, G. A .; Rogers, L. A .; Abril, R. S .; Agarwal, T. A .; Agarwala, L. W .; Ainscough, E. R .; Alexandersson, J. D .; An, T. L .; Antonarakis, W. E .; Attwood, J. O .; Baertsch, M. N .; Bailey, K. H .; Barlow, C. S .; Beck, T. C .; Berry, B .; Birren, J .; Bloom, E .; Bork, R. H .; Botcherby, M. C .; Bray, R. K.; Brent, S. P .; Brown, P .; Brown, E .; Bult, B .; Burton, T .; Butler, D. G .; et al. (2002). „Počáteční sekvenování a komparativní analýza myšího genomu“. Příroda. 420 (6915): 520–562. doi:10.1038 / nature01262. PMID 12466850.
- ^ Wagner, KW. (2003). Modely rakoviny prsu: quo vadis, zvířecí modelování? Breast Cancer Research 6 (31), 31-38. Doi: 10,1186 / bcr723
- ^ Pulaski BA, S Ostrand-Rosenberg. 2001. „Model myšího nádoru prsu 4T1“. Curr Protoc Immunol. Kapitola 20: Jednotka 20.2. doi: 10.1002 / 0471142735.im2002s39
- ^ Knott SRV, E Wagenblast, S Khan, SY Kim, M Soto, M Wagner, MO Turgeon, L Fish, N Erard, AL Gable, AR Maceli, S Dickopf, EK Papachristou, CS D'Santos, LA Carey, JE Wilkinson, JC Harrell, CM Perou, H Goodarzi, G Poulogiannis a GJ Hannon. 2018. „Asparaginová biologická dostupnost reguluje metastázy v modelu rakoviny prsu“. Příroda. doi: 10,1038 / příroda25465
- ^ Khanna, C; Hunter, K (2005). „Modelování metastáz in vivo“. Karcinogeneze. 26 (3): 513–23. doi:10.1093 / carcin / bgh261. PMID 15358632.
- ^ Behbod, F; Kittrell, F. S .; Lamarca, H; Edwards, D; Kerbawy, S; Heestand, J. C .; Young, E; Mukhopadhyay, P; Yeh, H. W .; Allred, D. C .; Hučení; Polyak, K; Rosen, J. M .; Medina, D (2009). „Intraduktální transplantační model člověk-myš napodobuje subtypy duktálního karcinomu in situ“. Výzkum rakoviny prsu. 11 (5): R66. doi:10.1186 / bcr2358. PMC 2790841. PMID 19735549.
- ^ Aslakson, C. J .; Miller, F. R. (1992). "Selektivní události v metastatickém procesu definované analýzou postupného šíření subpopulací myšího prsního nádoru". Výzkum rakoviny. 52 (6): 1399–405. PMID 1540948.
- ^ Yang, Jing; Mani, Sendurai A; Donaher, Joana Liu; Ramaswamy, Sridhar; Itzykson, Raphael A; Pojď, Christophe; Savagner, Pierre; Gitelman, Inna; Richardson, Andrea; Weinberg, Robert A (2004). „Twist, hlavní regulátor morfogeneze, hraje zásadní roli v metastázování nádorů“. Buňka. 117 (7): 927–39. doi:10.1016 / j.cell.2004.06.006. PMID 15210113.
- ^ A b C Podsypanina, K; Du, Y. C .; Jechlinger, M; Beverly, L. J .; Hambardzumyan, D; Varmus, H (2008). "Očkování a množení netransformovaných myších prsních buněk myší v plicích". Věda. 321 (5897): 1841–4. doi:10.1126 / science.1161621. PMC 2694414. PMID 18755941.
- ^ Talmadge, J. E.; Singh, R. K .; Fidler, I.J .; Raz, A (2007). „Myší modely k hodnocení nových a konvenčních terapeutických strategií pro rakovinu“. American Journal of Pathology. 170 (3): 793–804. doi:10.2353 / ajpath.2007.060929. PMC 1864878. PMID 17322365.
- ^ Kim, M. Y .; Oskarsson, T; Acharyya, S; Nguyen, D. X .; Zhang, X. H .; Norton, L; Massagué, J (2009). „Samoosev nádoru cirkulujícími rakovinnými buňkami“. Buňka. 139 (7): 1315–26. doi:10.1016 / j.cell.2009.11.025. PMC 2810531. PMID 20064377.
- ^ Vargo-Gogola, T; Rosen, J. M. (2007). „Modelování rakoviny prsu: Jedna velikost nevyhovuje všem“. Nature Reviews Cancer. 7 (9): 659–72. doi:10.1038 / nrc2193. PMID 17721431.
- ^ Kuperwasser, C; Chavarria, T; Wu, M; Magrane, G; Gray, JW; Carey, L; Richardson, A; Weinberg, RA. (2004). Rekonstrukce funkčně normální a maligní lidské prsní tkáně u myší. Pnas 101 (14), 4966-4971. doi: 10,1073 / pnas.0401064101
- ^ Gossen, M; Bujard, H (1992). „Důkladná kontrola genové exprese v savčích buňkách promotory reagujícími na tetracyklin“. Sborník Národní akademie věd Spojených států amerických. 89 (12): 5547–51. doi:10.1073 / pnas.89.12.5547. PMC 49329. PMID 1319065.
- ^ Sauer, B; Henderson, N (1989). "Cre stimulovaná rekombinace v DNA sekvencích obsahujících loxP umístěných do genomu savců". Výzkum nukleových kyselin. 17 (1): 147–61. doi:10.1093 / nar / 17.1.147. PMC 331541. PMID 2783482.
- ^ Du, Z; Podsypanina, K; Huang, S; McGrath, A; Toneff, M. J .; Bogoslovskaia, E; Zhang, X; Moraes, R. C .; Fluck, M; Allred, D. C .; Lewis, M. T .; Varmus, H. E.; Li, Y (2006). „Zavedení onkogenů do mléčných žláz in vivo pomocí ptačího retrovirového vektoru iniciuje a podporuje karcinogenezi na myších modelech“. Sborník Národní akademie věd. 103 (46): 17396–401. doi:10.1073 / pnas.0608607103. PMC 1635021. PMID 17090666.
- ^ Callahan, R; Smith, G. H. (2000). „MMTV-indukovaná prsní tumorigeneze: objev genů, progrese do malignity a buněčné dráhy“. Onkogen. 19 (8): 992–1001. doi:10.1038 / sj.onc.1203276. PMID 10713682.
- ^ Ringold, G. M .; Yamamoto, K. R .; Tomkins, G. M .; Bishop, M; Varmus, H. E. (1975). „Indukce RNA viru myšího mléčného nádoru zprostředkovaná dexamethasonem: Systém pro studium působení glukokortikoidů“. Buňka. 6 (3): 299–305. doi:10.1016/0092-8674(75)90181-6. PMID 212202.
- ^ Yamamoto, K. R .; Payvar, F; Firestone, G. L .; Maler, B. A .; Wrange, O; Carlstedt-Duke, J; Gustafsson, J. A .; Chandler, V. L. (1983). "Biologická aktivita klonovaných fragmentů DNA viru nádoru mléčné žlázy, které se vážou na purifikovaný protein receptoru glukokortikoidů in vitro". Cold Spring Harbor Symposia o kvantitativní biologii. 47 (2): 977–84. doi:10.1101 / sqb.1983.047.01.111. PMID 6305596.
- ^ Ross, RS. (2010). Molekulární biologie viru myšího nádoru mléčné žlázy a onkogeneze. Viry 2 (9), 2000-2012. doi: 10,3390 / v2092000
- ^ Campbell, S. M .; Rosen, J. M .; Hennighausen, L. G .; Strech-Jurk, U; Sippel, A. E. (1984). "Srovnání genů syrovátkového kyselého proteinu potkana a myši". Výzkum nukleových kyselin. 12 (22): 8685–97. doi:10.1093 / nar / 12.22.8685. PMC 320407. PMID 6095207.
- ^ Fantozzi, A; Christofori, G (2006). „Myší modely metastáz rakoviny prsu“. Výzkum rakoviny prsu. 8 (4): 212. doi:10.1186 / bcr1530. PMC 1779475. PMID 16887003.
- ^ Guy, C. T .; Cardiff, R. D .; Muller, W. J. (1992). „Indukce prsních nádorů expresí polyomaviru se středním T onkogenem: transgenní myší model pro metastatické onemocnění“. Molekulární a buněčná biologie. 12 (3): 954–61. doi:10.1128 / mcb.12.3.954. PMC 369527. PMID 1312220.
- ^ Klarenbeek, S; Van Miltenburg, M. H .; Jonkers, J (2013). „Geneticky upravené myší modely signalizace PI3K u rakoviny prsu“. Molekulární onkologie. 7 (2): 146–64. doi:10.1016 / j.molonc.2013.02.003. PMC 5528412. PMID 23478237.
- ^ Lin, E. Y .; Nguyen, A. V .; Russell, R. G .; Pollard, J. W. (2001). „Faktor stimulující kolonie 1 podporuje progresi nádorů prsu do malignity“. The Journal of Experimental Medicine. 193 (6): 727–40. doi:10.1084 / jem.193.6.727. PMC 2193412. PMID 11257139.
- ^ Denardo, D. G .; Barreto, J. B .; Andreu, P; Vasquez, L; Tawfik, D; Kolhatkar, N; Coussens, L. M. (2009). „CD4 (+) T buňky regulují plicní metastázy karcinomů mléčné žlázy zvýšením protumorových vlastností makrofágů“. Rakovinová buňka. 16 (2): 91–102. doi:10.1016 / j.ccr.2009.06.018. PMC 2778576. PMID 19647220.
- ^ Lopez, J. I .; Camenisch, T. D .; Stevens, M. V .; Sands, B. J .; McDonald, J; Schroeder, J. A. (2005). „CD44 tlumí metastatické invaze během progrese rakoviny prsu“. Výzkum rakoviny. 65 (15): 6755–63. doi:10.1158 / 0008-5472.CAN-05-0863. PMID 16061657.
- ^ Schoeffner, D. J .; Matheny, S.L .; Akahane, T; Faktor, V; Berry, A; Merlino, G; Thorgeirsson, USA (2005). „VEGF přispívá k růstu nádorů mléčné žlázy u transgenních myší prostřednictvím parakrinních a autokrinních mechanismů“. Laboratorní vyšetřování. 85 (5): 608–23. doi:10.1038 / labinvest.3700258. PMID 15765121.
- ^ Muraoka-Cook, R. S .; Kurokawa, H; Koh, Y; Forbes, J. T .; Roebuck, L. R .; Barcellos-Hoff, M. H .; Moody, S.E .; Chodosh, L. A .; Arteaga, C. L. (2004). „Podmíněná nadměrná exprese aktivního transformujícího růstového faktoru beta1 in vivo urychluje metastázy transgenních nádorů prsu“. Výzkum rakoviny. 64 (24): 9002–11. doi:10.1158 / 0008-5472.CAN-04-2111. PMID 15604265.
- ^ Almholt, K; Lund, L. R .; Rygaard, J; Nielsen, B. S .; Danø, K; Rømer, J; Johnsen, M (2005). "Snížená metastáza transgenního karcinomu prsu u myší s deficitem urokinázy". International Journal of Cancer. 113 (4): 525–32. doi:10.1002 / ijc.20631. PMID 15472905.
- ^ Cuevas, B.D .; Winter-Vann, A. M .; Johnson, N.L .; Johnson, G. L. (2006). „MEKK1 řídí degradaci matrice a šíření nádorových buněk během metastáz rakoviny prsu řízené polyomem uprostřed T“. Onkogen. 25 (36): 4998–5010. doi:10.1038 / sj.onc.1209507. PMID 16568086.
- ^ Slamon, D. J .; Clark, G. M .; Wong, S. G .; Levin, W. J .; Ullrich, A; McGuire, W. L. (1987). "Lidský karcinom prsu: korelace relapsu a přežití s amplifikací HER-2 / neu onkogenu". Věda. 235 (4785): 177–82. doi:10.1126 / science.3798106. PMID 3798106.
- ^ Muller, W. J .; Sinn, E; Pattengale, P. K .; Wallace, R; Leder, P (1988). „Jednostupňová indukce adenokarcinomu mléčné žlázy u transgenních myší nesoucích aktivovaný onkogen c-neu“. Buňka. 54 (1): 105–15. doi:10.1016/0092-8674(88)90184-5. PMID 2898299.
- ^ Fry, EA; Taneka, P; Inoue, K. (2016). Onkogenní a tumor potlačující myší modely pro rakovinu prsu využívající HER2 / neu. International Journal of Cancer 140 (3), 495-503. doi: 10,1002 / ijc.30399
- ^ Sinn, E; Muller, W; Pattengale, P; Tepler, I; Wallace, R; Leder, P (1987). „Koexprese genů MMTV / v-Ha-ras a MMTV / c-myc u transgenních myší: Synergický účinek onkogenů in vivo“. Buňka. 49 (4): 465–75. doi:10.1016/0092-8674(87)90449-1. PMID 3032456.
- ^ Siegel, P. M .; Shu, W; Cardiff, R. D .; Muller, W. J .; Massagué, J (2003). „Signalizace transformujícího růstového faktoru beta zhoršuje neu-indukovanou tumorogenezi mléčné žlázy a podporuje plicní metastázy“. Sborník Národní akademie věd. 100 (14): 8430–5. doi:10.1073 / pnas.0932636100. PMC 166246. PMID 12808151.
- ^ Gunther, E. J .; Belka, G. K .; Wertheim, G. B .; Wang, J; Hartman, J.L .; Boxer, R. B .; Chodosh, L. A. (2002). "Nový doxycyklinem indukovatelný systém pro transgenní analýzu biologie mléčné žlázy". FASEB Journal. 16 (3): 283–92. doi:10.1096 / fj.01-0551com. PMID 11874978.
- ^ Podsypanina, K; Politi, K; Beverly, L. J .; Varmus, H. E. (2008). „Spolupráce onkogenu při udržování a recidivě nádorů u nádorů myší mléčné žlázy indukovaných Myc a mutantem Krasem“. Sborník Národní akademie věd. 105 (13): 5242–7. doi:10.1073 / pnas.0801197105. PMC 2278195. PMID 18356293.
- ^ Bierie, B; Stover, D. G .; Abel, T. W .; Chytil, A; Gorska, A.E .; Aakre, M; Forrester, E; Yang, L; Wagner, K.U .; Moses, H.L. (2008). „Transformující růstový faktor-beta reguluje přežití buněk prsního karcinomu a interakci s přilehlým mikroprostředím“. Výzkum rakoviny. 68 (6): 1809–19. doi:10.1158 / 0008-5472.CAN-07-5597. PMID 18339861.
- ^ Korkmaz, G; Lopes, R; Ugalde, AP; Nevedomskaya, E; Han, R; Myacheva, K; Zwart, W; Elkon, R; Agami, R. (2016). Funkční genetika testuje zesilovací prvky v lidském genomu pomocí CRISPR-Cas9. Nature Biotechnology 34, 192-198. doi: 10,1038 / nbt.3450
- ^ Srinivas, S; Watanabe, T; Lin, C. S .; William, C. M .; Tanabe, Y; Jessell, T. M .; Costantini, F (2001). "Cre reportérské kmeny produkované cílenou inzercí EYFP a ECFP do lokusu ROSA26". BMC vývojová biologie. 1: 4. doi:10.1186 / 1471-213X-1-4. PMC 31338. PMID 11299042.
- ^ Liao, M. J .; Zhang, C. C .; Zhou, B; Zimonjic, D. B .; Mani, S. A .; Kaba, M; Gifford, A; Reinhardt, F; Popescu, N. C .; Guo, W; Eaton, E. N .; Lodish, H. F .; Weinberg, R. A. (2007). „Obohacení populace buněk mléčné žlázy, které tvoří mammosféry a mají repopulační aktivitu in vivo“. Výzkum rakoviny. 67 (17): 8131–8. doi:10.1158 / 0008-5472.CAN-06-4493. PMID 17804725.
- ^ Biswas, S; Guix, M; Rinehart, C; Dugger, T. C .; Chytil, A; Moses, H.L .; Freeman, M. L .; Arteaga, C. L. (2007). „Inhibice TGF-beta s neutralizujícími protilátkami brání radiačně indukované akceleraci progrese metastatického karcinomu“. Journal of Clinical Investigation. 117 (5): 1305–13. doi:10.1172 / JCI30740. PMC 1838926. PMID 17415413.
- ^ Hüsemann, Y; Geigl, J. B .; Schubert, F; Musiani, P; Meyer, M; Burghart, E; Forni, G; Eils, R; Fehm, T; Riethmüller, G; Klein, C. A. (2008). „Systémové šíření je časným krokem u rakoviny prsu“. Rakovinová buňka. 13 (1): 58–68. doi:10.1016 / j.ccr.2007.12.003. PMID 18167340.
- ^ Egeblad, M; Nakasone, E. S .; Werb, Z (2010). „Nádory jako orgány: Složité tkáně, které se stýkají s celým organismem“. Vývojová buňka. 18 (6): 884–901. doi:10.1016 / j.devcel.2010.05.012. PMC 2905377. PMID 20627072.
- ^ Entenberg, D; Wyckoff, J; Gligorijevic, B; Roussos, E. T .; Verkhusha, V. V .; Pollard, J. W .; Condeelis, J (2011). „Nastavení a použití dvou-laserového vícefotonového mikroskopu pro vícekanálové intravitální fluorescenční zobrazování“. Přírodní protokoly. 6 (10): 1500–20. doi:10.1038 / nprot.2011.376. PMC 4028841. PMID 21959234.
- ^ Alberini, Jean-Louis; Boisgard, Raphaël; Guillermet, Stéphanie; Siquier, Karine; Jego, Benoît; Thézé, Benoît; Urien, Saik; Rezai, Keyvan; Menet, Emmanuelle (2016-08-01). "Multimodální zobrazení in vivo tumorigeneze a reakce na chemoterapii u modelu rakoviny prsu u transgenních myší". Molekulární zobrazování a biologie. 18 (4): 617–626. doi:10.1007 / s11307-015-0916-7. ISSN 1860-2002. PMC 4927598. PMID 26630973.
externí odkazy
- http://www.la-press.com/tetracycline-regulated-systems-in-functional-oncogenomics-article-a200 Podrobný přehled Tet-systémů ve funkční onkogenomice
