Mitochondriální teorie stárnutí - Mitochondrial theory of ageing
Mitochondriální teorie stárnutí má dvě varianty: volný radikál a volný radikál. První je jednou z variant teorie volných radikálů stárnutí. Byl formulován J. Michelem v roce 1980 a byl vyvinut v dílech A. V. Linnana (1989). Druhý navrhl A. N. Lobachev v roce 1978. [1]
Mitochondriální teorie volných radikálů stárnutí, MFRTA, navrhuje to volné radikály produkovaný mitochondriální aktivita poškozuje buněčné komponenty, což vede k stárnutí.

Mitochondrie jsou buňka organely které poskytují buňce energii produkcí ATP (adenosintrifosfát). Během produkce ATP elektrony může uniknout z mitochondrií a reagovat s vodou za vzniku reaktivní formy kyslíku, Zkráceně ROS. ROS může poškodit makromolekuly, počítaje v to lipidy, bílkoviny a DNA, o kterém se předpokládá, že usnadňuje proces stárnutí.
V padesátých letech Denham Harman navrhl teorie volných radikálů stárnutí, kterou později rozšířil na MFRTA.
Při studiu mutace v antioxidanty, které odstraňují ROS, byly výsledky nekonzistentní. Bylo však zjištěno, že nadměrná exprese antioxidačních enzymů v droždí, červi, letí a myši bylo prokázáno, že se zvyšují životnost.
Molekulární základ

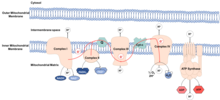
Mitochondrie jsou považovány za organely, které se vyvinuly z endocytovaný bakterie který se naučil koexistovat uvnitř starověký buňky. Tyto bakterie si uchovávaly vlastní DNA, mitochondriální DNA (mtDNA), který kóduje komponenty elektronový transportní řetězec (ATD). ETC se nachází v vnitřní mitochondriální membrána a funkce k výrobě energie ve formě molekul ATP. Proces se nazývá oxidační fosforylace, protože ATP se vyrábí z ADP v sérii redoxní reakce. Elektrony jsou přenášeny prostřednictvím ETC z NADH a FADH2 na kyslík, snižování kyslík do vody.
ROS

ROS jsou vysoce reaktivní, obsahující kyslík chemické druhy, který zahrnuje superoxid, peroxid vodíku a hydroxylový radikál. Pokud komplexy ETC nefungují správně, elektrony mohou unikat a reagovat s vodou a vytvářet ROS. Únik je obvykle nízký a ROS se udržuje na hodnotě fyziologický úrovně, plnění rolí v signalizace a homeostáza. Ve skutečnosti jejich přítomnost na nízkých úrovních vede k prodloužení životnosti aktivací transkripční faktory a metabolické cesty zahrnutý do něčeho, zůčastnit se čeho dlouhověkost. Při vyšších úrovních způsobuje ROS oxidační poškození oxidací makromolekul, jako jsou lipidy, proteiny a DNA. Toto oxidační poškození makromolekul je považováno za příčinu stárnutí. Mitochondriální DNA je obzvláště citlivá na oxidační poškození kvůli své blízkosti místa produkce těchto druhů.[2] Poškození mitochondriální DNA způsobuje mutace, což vede k produkci komplexů ETC, které nefungují správně, zvyšuje produkci ROS a zvyšuje oxidační poškození makromolekul.
UPRmt
The mitochondriální rozvinutá proteinová odpověď (UPRmt) je zapnutý v reakci na mitochondriální stres. Mitochondriální stres nastává, když protonový gradient přes vnitřní mitochondriální membránu se rozptýlí, mtDNA se mutuje a / nebo se hromadí ROS, což může vést k chybné skládání a snížená funkce mitochondriálních proteinů. Stres vnímá jádro, kde chaperony a proteázy jsou upregulovaný, což může opravit skládací nebo odstraňte poškozené proteiny.[3] Pokles hladin proteázy je spojen se stárnutím, protože zůstane mitochondriální stres, který udržuje vysoké hladiny ROS.[4] Takový mitochondriální stres a dysfunkce byly spojeny s různými nemoci spojené s věkem, počítaje v to kardiovaskulární choroby, a cukrovka typu 2.[5]
Mitochondriální metabolity
Jako mitochondriální matice je místo, kde TCA cyklus se odehrává, jinak metabolity jsou obvykle omezeny na mitochondrie. Po stárnutí mitochondriální funkce klesá, což umožňuje únik těchto metabolitů, což může vyvolat epigenetický Změny,[6] spojené se stárnutím.

Acetyl-koenzym A (Acetyl-CoA) vstupuje do cyklu TCA v mitochondriální matrici a je oxidovaný v procesu výroby energie. Po úniku z mitochondrií a vstupu do jádra může působit jako Podklad pro acetylace histonů.[7] Acetylace histonu je epigenetická modifikace, která vede k aktivace genu. V mladém věku jsou hladiny acetyl-CoA vyšší v jádře a cytosol a jeho transport do jádra se může prodloužit životnost u červů.[8][9]
Nikotinamid Adenin Dinukleotid (NAD+) se produkuje v mitochondriích a při úniku do jádra může působit jako substrát pro sirtuiny.[10] Sirtuiny jsou rodina bílkovin, o nichž je známo, že hrají roli v dlouhověkosti. Celulární NAD+ Bylo prokázáno, že hladiny s věkem klesají.[11]
VLHKOSTI
Poškození spojené s molekulárními vzory (DAMP) jsou molekuly, které se uvolňují během buněčný stres. Mitochondriální DNA je DAMP, který je dostupný pouze během mitochondriálního poškození. Hladiny mitochondriální DNA v krvi se s věkem zvyšují, což přispívá k stárnutí zánětů, chronický stav zánětu charakteristický pro pokročilý věk.[12]
Mitochondriální deriváty peptidů
Je známo, že mitochondriální DNA kóduje 13 proteinů. Nedávno byly identifikovány další krátké sekvence kódující protein a jejich produkty jsou označovány jako peptidy odvozené od mitochondrií.[13]
Peptid odvozený od mitochondrií humanin bylo prokázáno, že chrání před Alzheimerova choroba, který je považován za nemoc související s věkem.[14]
Ukázalo se, že MOTS-c zabraňuje stárnutí rezistence na inzulín, hlavní příčina cukrovky typu 2.
Bylo prokázáno, že hladiny humaninu a MOTS-c s věkem klesají a zdá se, že jejich aktivita zvyšuje dlouhověkost.[15]
Mitochondriální membrána
Almaida-Pagan a spolupracovníci zjistili, že mitochondriální membrána složení lipidů se s věkem při studiu mění Tyrkysový killifish.[16] Podíl monosaturated mastné kyseliny s věkem klesal a podíl polynenasycené zvýšené mastné kyseliny. Celkově fosfolipid s věkem také obsah klesal.
Dějiny
V roce 1956 Denham Harman nejprve postuloval teorie volných radikálů stárnutí, kterou později upravil na mitochondriální teorii stárnutí volných radikálů (MFRTA).[17] Zjistil, že ROS je hlavní příčinou poškození makromolekul, známé jako „stárnutí“. Později upravil svou teorii, protože zjistil, že mitochondrie produkují a poškozují ROS, což ho vedlo k závěru, že mitochondrie určují stárnutí. V roce 1972 publikoval svou teorii v Journal of the American Geriatrics Society.[18]
Důkaz
Bylo pozorováno, že s věkem mitochondriální funkce klesá a mitochondriální DNA mutace se zvyšuje v tkáň buňky způsobem závislým na věku. To vede ke zvýšení produkce ROS a potenciálnímu snížení schopnosti buňky odstranit ROS. Ukázalo se, že většina zvířat s dlouhým životem je odolnější vůči oxidačnímu poškození a má nižší produkci ROS, což spojuje hladiny ROS s délkou života.[19][20][21][22][23] Nadměrná exprese antioxidanty Bylo také prokázáno, že která funkce pro odstranění ROS zvyšuje životnost.[24][25] Bioinformatika analýza ukázala, že aminokyselinové složení mitochondriálních proteinů koreluje s dlouhověkostí (dlouho žijící druhy jsou vyčerpány cystein a methionin ), spojující mitochondrie s procesem stárnutí.[26][27] Studiem výrazu jistoty geny v C. elegans,[28] Drosophila,[29] a myši [30] bylo zjištěno, že narušení komplexů ETC může prodloužit životnost - spojením mitochondriální funkce s procesem stárnutí.
Důkazy podporující teorii se začaly rozpadat počátkem roku 2000. Myši se sníženou expresí mitochondriálního antioxidantu, SOD2, nahromaděné oxidační poškození a vyvinuto rakovina, ale nežil déle než normální život.[31] Nadměrná exprese antioxidantů snižovala buněčný stres, ale nezvyšovala délku života myší.[32][33] The nahý krysa, který žije 10krát déle než normální myši, bylo prokázáno, že má vyšší úrovně oxidačního poškození.[34]
Viz také
Reference
- ^ Lobachev A.N.Úloha mitochondriálních procesů ve vývoji a stárnutí organismu. Stárnutí a rakovina (PDF), Chemické souhrny. 1979 v. 91 N 25 91: 208561v. Depozitovaný dokument, VINITI 2172-78, 1978, str. 48
- ^ Kowald; Kirkwood (2018). „Řešení záhady klonální expanze delecí mtDNA“. Geny (Basilej). 9 (3): 126. doi:10,3390 / geny9030126. PMC 5867847. PMID 29495484.
- ^ Nargund; et al. (2015). „Mitochondriální a jaderná akumulace transkripčního faktoru ATFS-1 podporuje zotavení OXPHOS během UPR (mt)“. Molekulární buňka. 58 (1): 123–133. doi:10.1016 / j.molcel.2015.02.008. PMC 4385436. PMID 25773600.
- ^ Bota; et al. (2005). „Downregulace lidské Lon proteázy narušuje mitochondriální strukturu a funkci a způsobuje buněčnou smrt“. Volná radikální biologie a medicína. 38 (1): 665–677. doi:10.1016 / j.freeradbiomed.2004.11.017. PMID 15683722.
- ^ Kim; Wei; Sowers (2008). „Role mitochondriální dysfunkce v inzulínové rezistenci“. Výzkum oběhu. 102 (4): 401–414. doi:10.1161 / CIRCRESAHA.107.165472. PMC 2963150. PMID 18309108.
- ^ Frezza (2017). „Mitochondriální metabolity: tajné signální molekuly“. Zaměření rozhraní. 7 (2): 20160100. doi:10.1098 / rsfs.2016.0100. PMC 5311903. PMID 28382199.
- ^ Menzies; Zhang; Katsuyaba; Auwerx (2016). "Acetylace bílkovin v metabolismu - metabolity a kofaktory". Recenze přírody Endokrinologie. 12 (1): 43–60. doi:10.1038 / nrendo.2015.181. PMID 26503676.
- ^ Shi; Tu (2015). "Acetyl-CoA a regulace metabolismu: mechanismy a důsledky". Současný názor na buněčnou biologii. 33: 125–131. doi:10.1016 / j.ceb.2015.02.003. PMC 4380630. PMID 25703630.
- ^ Benayoun; Pollina; Brunet (2015). „Epigenetická regulace stárnutí: propojení environmentálních vstupů s genomickou stabilitou“. Nature Reviews Molecular Cell Biology. 16 (1): 593–610. doi:10.1038 / nrm4048. PMC 4736728. PMID 26373265.
- ^ Imai; Guarente (2016). „Tango vyžaduje dva: NAD + a sirtuiny v řízení stárnutí / dlouhověkosti“. NPJ Stárnutí a mechanismy nemocí. 2: 16017. doi:10.1038 / npjamd.2016.17. PMC 5514996. PMID 28721271.
- ^ Schultz; Sinclair (2016). „Proč NAD (+) klesá během stárnutí: je zničeno“. Buněčný metabolismus. 23 (6): 965–966. doi:10.1016 / j.cmet.2016.05.022. PMC 5088772. PMID 27304496.
- ^ Pinti; et al. (2014). „Cirkulující mitochondriální DNA se zvyšuje s věkem a je známou vlastností: Důsledky pro„ zánětlivé stárnutí “"". European Journal of Immunology. 44 (5): 1552–1562. doi:10.1002 / eji.201343921. PMID 24470107.
- ^ Kim; et al. (2017). „Mitochondriálně odvozené peptidy jako nové regulátory metabolismu“. The Journal of Physiology. 595 (21): 6613–6621. doi:10.1113 / JP274472. PMC 5663826. PMID 28574175.
- ^ Kim; et al. (2017). „Mitochondriálně odvozené peptidy jako nové regulátory metabolismu“. The Journal of Physiology. 595 (21): 6613–6621. doi:10.1113 / JP274472. PMC 5663826. PMID 28574175.
- ^ Kim; et al. (2017). „Mitochondriálně odvozené peptidy jako nové regulátory metabolismu“. Fyziologický časopis. 595 (21): 6613–6621. doi:10.1113 / JP274472. PMC 5663826. PMID 28574175.
- ^ Almaida-Pagan; et al. (2019). „Změny složení mitochondriální membrány Nothobranchius furzeri související s věkem: srovnání s déle žijícím druhem Nothobranchius“. Biogerontologie. 20 (1): 83–92. doi:10.1007 / s10522-018-9778-0. PMID 30306289.
- ^ Harman (1956). „Stárnutí: teorie založená na volné radikálové a radiační chemii“. Časopis gerontologie. 11 (3): 298–300. doi:10.1093 / geronj / 11.3.298. PMID 13332224.
- ^ Harman (1972). „Biologické hodiny: mitochondrie?“. Journal of the American Geriatrics Society. 20 (4): 145–147. doi:10.1111 / j.1532-5415.1972.tb00787.x. PMID 5016631.
- ^ Martin; et al. (1996). „Genetická analýza stárnutí: role oxidačního poškození a environmentálních zátěží“. Genetika přírody. 13 (1): 25–34. doi:10.1038 / ng0596-25. PMID 8673100.
- ^ Liang; et al. (2003). "Genetické modely myší s prodlouženou životností". Experimentální gerontologie. 38 (11–12): 1353–1364. doi:10.1016 / j.exger.2003.10.019. PMID 14698816.
- ^ Lambert; et al. (2007). „Nízká míra produkce peroxidu vodíku izolovanými mitochondriemi srdce je spojena s dlouhou maximální délkou života v homeotermách obratlovců“. Stárnoucí buňka. 6 (5): 607–618. doi:10.1111 / j.1474-9726.2007.00312.x. PMID 17596208.
- ^ Ungvari; et al. (2011). „Extrémní dlouhověkost je spojena se zvýšenou odolností proti oxidačnímu stresu u Arctica islandica, nejdéle žijícího nekoloniálního zvířete“. Časopisy gerontologie. Série A, Biologické vědy a Lékařské vědy. 66 (7): 741–750. doi:10.1093 / gerona / glr044. PMC 3143345. PMID 21486920.
- ^ Barja; et al. (2014). "Mitochondriální teorie volných radikálů stárnutí". Pokrok v molekulární biologii a translační vědě. 127: 1–27. doi:10.1016 / B978-0-12-394625-6.00001-5. ISBN 9780123946256. PMID 25149212.
- ^ Slunce; et al. (2002). „Indukovaná nadměrná exprese mitochondriální Mn-superoxiddismutázy prodlužuje životnost dospělého Drosophila melanogaster“. Genetika. 161 (2): 661–672. PMC 1462135. PMID 12072463.
- ^ Orr; Sohal (1994). „Prodloužení života nadměrnou expresí superoxiddismutázy a katalázy v Drosophila melanogaster“. Věda. 263 (5150): 1128–30. Bibcode:1994Sci ... 263.1128O. doi:10.1126 / science.8108730. PMID 8108730.
- ^ Moosmann; Behl (2008). "Mitochondriálně kódovaný cystein předpovídá životnost zvířat". Stárnoucí buňka. 7 (1): 32–46. doi:10.1111 / j.1474-9726.2007.00349.x. PMID 18028257.
- ^ Aledo; et al. (2011). „Mitochondriálně kódovaný methionin je nepřímo úměrný dlouhověkosti u savců“. Stárnoucí buňka. 10 (2): 198–207. doi:10.1111 / j.1474-9726.2010.00657.x. PMID 21108730.
- ^ Rea; et al. (2007). „Vztah mezi dysfunkcí mitochondriálního elektronového transportního řetězce, vývojem a prodloužením života u Caenorhabditis elegans“. PLOS Biology. 5 (10): e259. doi:10.1371 / journal.pbio.0050259. PMC 1994989. PMID 17914900.
- ^ Copeland; et al. (2009). "Prodloužení délky života Drosophila o RNAi mitochondriálního dýchacího řetězce". Aktuální biologie. 19 (19): 1591–1598. doi:10.1016 / j.cub.2009.08.016. PMID 19747824.
- ^ Liu; et al. (2005). „Evoluční zachování mechanismu dlouhověkosti závislého na clk-1: ztráta mclk1 zvyšuje buněčnou zdatnost a životnost myší“. Geny a vývoj. 19 (20): 2424–2434. doi:10.1101 / gad.1352905. PMC 1257397. PMID 16195414.
- ^ Van Remmen; et al. (2003). „Celoživotní snížení aktivity MnSOD má za následek zvýšené poškození DNA a vyšší výskyt rakoviny, ale nezrychluje stárnutí“. Fyziologická genomika. 16 (1): 29–37. doi:10.1152 / physiolgenomics.00122.2003. PMID 14679299.
- ^ Huang; et al. (2000). „Všudypřítomná nadměrná exprese superoxiddismutázy CuZn neprodlužuje životnost myší“. Časopisy gerontologie. Série A, Biologické vědy a Lékařské vědy. 55 (1): B5-9. doi:10.1093 / gerona / 55.1.b5. PMID 10719757.
- ^ Pérez; et al. (2009). „Je teorie oxidačního stresu stárnutí mrtvá?“. Biochimica et Biophysica Acta (BBA) - Obecné předměty. 1790 (10): 1005–1014. doi:10.1016 / j.bbagen.2009.06.003. PMC 2789432. PMID 19524016.
- ^ Andziak; et al. (2006). "Vysoká úroveň oxidačního poškození u nejdéle žijícího hlodavce, nahého krtka". Stárnoucí buňka. 5 (6): 463–471. doi:10.1111 / j.1474-9726.2006.00237.x. PMID 17054663.
