Snížení jodidem samarnatým - Reductions with samarium(II) iodide
Snížení jodidem samarnatým zahrnovat přeměnu různých tříd organických sloučenin na redukované produkty působením jodid samarnatý (II) mírné jednoelektronové redukční činidlo.[1][2][3]
Dějiny
V roce 1979 Kagan pozoroval redukci různých organických funkčních skupin jodidem samariem za mírných podmínek.[4] Od té doby se jodid samaria používá v různých kontextech v organické syntéze jak pro manipulaci s funkční skupinou, tak pro vytváření vazby uhlík-uhlík.

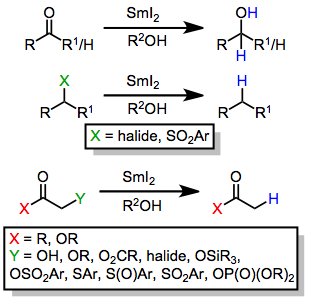
Samarium jodid je jednoelektronové redukční činidlo a obvykle působí redukcí prostřednictvím řady kroků přenosu elektronů a přenosu protonů (z protického rozpouštědla).[3][2] Redukovatelné funkční skupiny zahrnují:
- α-funkcionalizované karbonylové sloučeniny
- Ketony a aldehydy
- Karboxylové kyseliny (za silně kyselých nebo zásaditých podmínek)
- Organické halogenidy
- Nitrosloučeniny
Některé příklady funkčnosti snížené o SmI2 jsou uvedeny níže.
(1)
Reaktivita SmI2 je významně ovlivněna volbou rozpouštědla. Použití hexamethylfosforamidu (HMPA) jako pomocného rozpouštědla při redukcích jodidu samaria umožňuje, aby reakce probíhala za mnohem mírnějších podmínek než za nepřítomnosti.[6] Nedávno bylo zkoumáno a stanoveno, že triamid kyseliny tripyrrolidinofosforečné (TPPA) lze použít místo HMPA jako aktivátoru pro SmI2 redukce, produkující rychlejší reakce a podobné výtěžky, přičemž se vyhýbá použití známého karcinogenu.[7] Polární rozpouštědla obecně zvyšují redukční vlastnosti jodidu samaria.
Mechanismus a stereochemie
Snížení obsahu organických halogenidů
V přítomnosti jodidu samaria je atom halogenu alkyl, alkenyl a arylhalogenidů nahrazen vodíkem. v tetrahydrofuran, mechanismus redukce alkylhalogenidu pravděpodobně probíhá prostřednictvím radikálních meziproduktů.[8] Redukce alkylhalogenidů využívající HMPA jako pomocné rozpouštědlo však pravděpodobně zahrnuje velkou část organosamariových meziproduktů.[9] Níže je uveden jednotný mechanický obrázek. Počáteční přenos elektronů a ztráta halogenidu generují organický radikál, který se může spojit s druhou molekulou jodidu samaria za vzniku organosamariového druhu. Protonace tohoto druhu pak poskytuje redukovaný produkt. Alternativně může přechodný organický radikál oddělit atom vodíku z rozpouštědla S – H.
(3)
Reakce aryl- a alkenylhalogenidů zahrnují pouze radikální meziprodukty; redukce meziproduktových radikálů na organosamarium je evidentně pomalejší než odběr atomu vodíku z rozpouštědla.[10]
Pokud je v poloze p alkylhalogenidu přítomen substituent, může dojít k redukční fragmentaci na diastereomerní směs alkenů. β-Eliminace intermediárního organosamariového druhu vede k pozorovaným produktům.[11]

(4)
Redukce aldehydů a ketonů
Mechanismus redukce aldehydů a ketonů jodidem samariem je založen především na mechanismech objasněných pro podobná jednoelektronová redukční činidla.[12] Po přenosu jednoho elektronu ketyl dimer iv formuláře. V nepřítomnosti protického rozpouštědla se tento dimer zhroutí a vytvoří 1,2-dioly. V přítomnosti zdroje protonu však může dimer projít buď disproporcionací za vzniku alkoxidu a karbonylové sloučeniny samaria, nebo protonací za vzniku karbinolového radikálu ii následuje druhá redukce a protonace, čímž se získá alkohol.
(5)

Snížení α-funkcionalizovaných karbonylových sloučenin
a-Funkcionalizované karbonylové sloučeniny se redukují na odpovídající nefunkční karbonylové sloučeniny v přítomnosti jodidu samaria. Tento proces může být zahájen počátečním přenosem elektronů buď na substituent v poloze a nebo na karbonylovou část, v závislosti na relativní elektronové afinitě funkčních skupin. Okamžitě následuje druhá redukce, po které produkt získá buď protonace nebo eliminační tautomerizace.[13]
(6)

Snížení nitrosloučenin
Nitrosloučeniny lze snížit na úroveň oxidace hydroxylaminu nebo aminu jodidem samariem v závislosti na použitých podmínkách. Přenos elektronů, následovaný přenosem a eliminací protonů, vytváří intermediární nitrososloučeninu, která podstoupí další dvě kola přenosu elektronů a protonace, čímž se získá hydroxylamin. Další redukce hydroxylaminu vede k aminu.[14]
(7)

Rozsah a omezení
Alkylhalogenidy se redukují jodidem samaria na odpovídající alkany. Podmínky redukce jsou kompatibilní s celou řadou funkčních skupin, včetně alkoholů, arenů, alkenů a esterů. Arylhalogenidy se redukují na odpovídající bezhalogenové aromatické sloučeniny.[6]
(8)

Redukční fragmentace β-substituovaných alkylhalogenidů poskytuje diastereomerní směsi alkenů. Dobře odstupující skupiny pro tento proces zahrnují hydroxid, alkoxidy, karboxyláty a enoláty. Snadno dostupné cyklické výchozí materiály lze použít ke generování stereodefinovaných acyklických produktů, které by bylo obtížné získat jinými metodami.[15]
(9)

Samodium jodid může být použit ke snížení ketonů a aldehydů na alkoholy; diastereoselektivita je však nízká a existuje celá řada stereoselektivních metod.[16] Aldehydy mohou být selektivně redukovány v přítomnosti ketonů.[4]
(10)

a-Funkcionalizované karbonylové sloučeniny se redukují, aby se získaly odpovídající karbonylové sloučeniny. Řadu funkčních skupin lze pomocí této metody nahradit vodíkem; jedna transformace, která je relativně jedinečná pro jodid samaria, je redukce a-hydroxyketonů a α-hydroxylaktonů. Obecně platí, že α, β-diheterosubstituované laktony mohou eliminovat za vzniku nenasycených laktonů po reakci se SmI2, i když použití ethylenglykolu jako donoru protonu tento proces minimalizuje[17]
(11)

Některé funkční skupiny obsahující dusík, zejména nitroskupiny, se redukují jodidem samaria na odpovídající hydroxylaminy nebo aminy. Nitrosloučeniny mohou být selektivně redukovány na jeden produkt v závislosti na reakčních podmínkách a čase.[18]
(12)

Srovnání s jinými metodami
Jodid samaria je účinný při redukci široké škály funkčních skupin; v určitých kontextech jsou však užitečnější jiná redukční činidla. SmI2 způsobuje redukční dimerizaci allylových nebo benzylových halogenidů a chirální halogenidy procházejí nestereospecifickou redukcí.[4] Na druhou stranu je jeho kompatibilita s funkční skupinou větší než u mnoha redukčních činidel - redukce halogenidů je možná v přítomnosti esterů nebo alkoholů.[6] Redukční fragmentace jodidem samarnatým mají tu nevýhodu, že nejsou stereospecifické; stereoselektivita je však vyšší v některých případech, když SmI2 se používá místo jiných redukčních činidel.[19] Redukce α, β-nenasycených karboxylových kyselin a jejich derivátů na odpovídající nasycené karbonylové sloučeniny pomocí SmI2 je užitečná transformace zprostředkovaná několika dalšími redukčními činidly.[20] Mírné reakční podmínky použité pro redukci jodidu samaria představují významnou výhodu reakce oproti jiným redukcím s jedním elektronem, včetně metod redukce kovem a způsobů přechodného kovu.[13]
Experimentální podmínky a postup
Typické podmínky
Jodid samaria se běžně generuje při reakci kovu samaria s buď dijodmethanem nebo dijodethanem. Použití dijodmethanu je vhodné, protože oxidační činidlo je kapalina (dijodethan je pevná látka). Ačkoli čistý SmI2 je citlivý na vzduch, s roztoky činidla lze manipulovat na vzduchu bez zvláštních opatření. SmI2 reaguje velmi pomalu s vodou a ještě pomaleji s alkoholy. Alkoholy se v SmI běžně používají jako spolurozpouštědla nebo zdroje protonů2 redukce, protože okamžité zhášení záporně nabitých meziproduktů zdrojem protonu se ukázalo jako prospěšné pro výtěžky reakce.[21] Důležité je, protože SmI2 je jedno-elektronový redukční prostředek, k dosažení dvouelektronové redukce organických substrátů je třeba použít několik ekvivalentů. Ve většině případů postačuje stechiometrické množství činidla nebo mírný přebytek.
Polarita rozpouštědla má zásadní vliv na průběh SmI2 redukce. Zvyšování polarity reakčního média obecně dělá SmI2 silnější redukční činidlo. K tomuto účelu lze použít HMPA; HMPA je však známý karcinogen a mělo by se s ním zacházet velmi opatrně.
Postupy zpracování se mohou lišit v závislosti na stabilitě produktů. Pokud jsou organické produkty reakce stabilní vůči vodné kyselině, může se k uhasení reakce použít vodná kyselina chlorovodíková. Pro zpracování zahrnující produkty labilní vůči kyselinám lze použít mírně zásadité roztoky nebo pufry pH 7–8. Samariové soli jsou za těchto podmínek obvykle nerozpustné, vytvářejí však ve vodné fázi suspenzi, ze které lze extrahovat požadovaný organický produkt.[22]
Příklad postupu
(13)
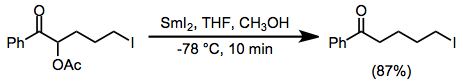
Ke kaši prášku samaria (0,32 g, 2,1 mmol) ve 2 ml tetrahydrofuranu se při teplotě místnosti přidá roztok 1,2-dijodethanu (0,56 g, 2 mmol) ve 2 ml tetrahydrofuranu. Výsledná olivově zelená suspenze byla míchána při teplotě okolí po dobu 1 hodiny, po této době byla výsledná tmavě modrá suspenze jodidu samarnatého ochlazena na -78 ° a zpracována roztokem 2-acetoxy-5- jod-l-fenyl-l-pentanon (0,35 g, 1 mmol) v 1 ml methanolu a 2 ml tetrahydrofuranu. Výsledná hnědá směs se míchá 10 minut při -78 ° C, zahřeje se na teplotu místnosti a poté se nalije do nasyceného vodného uhličitanu draselného. Vodná fáze byla extrahována diethyletherem (5 x 10 ml) a spojené extrakty byly vysušeny (bezvodý síran hořečnatý). Odpařením rozpouštědla se získá pevná látka, která se překrystaluje z diethyletheru. Získá se 0,24 g (87%) 5-jod-1-fenyl-1-pentanonu, teplota tání 72 až 73 ° C. IR (CCl4): 1690 cm−1. 11H NMR (CCI4): 5 7,9 (m, 3H), 7,4 (m, 3H), 3,2 (t, J = 6 Hz, 2H), 2,9 (t, J = 7,5 Hz, 2H), 1,8 (m, 4H). 13C NMR: 5 199,26, 136,63, 132,90, 128,21 (2 C), 127,84 (2 C), 37,09, 32,85, 24,92, 6,12. Přesná hmotnostní spektrální analýza, vypočtená pro C11H13IO, 288,0012; nalezeno 288,0011.[13]
Reference
- ^ Molander, Gary A. (2004). "Snížení jodidem Samarium (II)". Organické reakce. 211–367. doi:10.1002 / 0471264180.nebo 046.03. ISBN 0471264180.
- ^ A b Gary A. Molander, Christina R. Harris, André B. Charette (2005). „Samarium (II) jodid“. Encyclopedia of Reagents for Organic Synthesis, 8 Volume Set. Encyklopedie činidel pro organickou syntézu. doi:10.1002 / 047084289X.rs004.pub2. ISBN 0471936235.CS1 maint: používá parametr autoři (odkaz)
- ^ A b Molander, Gary A .; Harris, Christina R. (1996). "Sekvenční reakce s jodidem Samarium (II)". Chemické recenze. 96 (1): 307–338. doi:10.1021 / cr950019y. PMID 11848755.
- ^ A b C Girard, P .; Namy, J. L .; Kagan, H. B. (1980). „Dvojmocné deriváty lanthanoidů v organické syntéze. 1. Mírná příprava jodidu samaria a jodidu yterbia a jejich použití jako redukčních nebo vazebných činidel.“ Journal of the American Chemical Society. 102 (8): 2693. doi:10.1021 / ja00528a029.
- ^ William J. Evans; Tammy S.Gummersheimer a Joseph W. Ziller (1995). „Koordinační chemie dijodidu samaria s ethery, včetně krystalové struktury tetarhydrofuran-solvatovaného samodiumdiodidu, SmI2(THF)5". J. Am. Chem. Soc. 117 (35): 8999–9002. doi:10.1021 / ja00140a016.
- ^ A b C Inanaga, Junji; Ishikawa, Mitsuhiro; Yamaguchi, Masaru (1987). „Mírná a pohodlná metoda redukce organických halogenidů za použití roztoku SmI2-THF v přítomnosti triamidu hexamethylfosforečného (HMPA)“. Chemické dopisy. 16 (7): 1485–1486. doi:10.1246 / cl.1987.1485.
- ^ McDonald, Chriss E .; Ramsey, Jeremy D .; Sampsell, David G .; Butler, Julie A .; Cecchini, Michael R. (2010). „Triamid kyseliny tripyrrolidinofosforečné jako aktivátor při snižování obsahu jodidu samaria“. Organické dopisy. 12 (22): 5178–81. doi:10.1021 / ol102040s. PMID 20979412.
- ^ Kagan, H; Namy, J.L .; Girard, P. (1981). „Divalentní deriváty lanthanoidů v organické syntéze - II Mechanismus smi2, reakce v přítomnosti ketonů a organických halogenidů“. Čtyřstěn. 37: 175. doi:10.1016/0040-4020(81)85053-3.
- ^ Walborsky, H. M .; Topolski, Marek (1992). "Reakce chirálních cyklopropylhalogenidů s jodidem samaria". The Journal of Organic Chemistry. 57: 370–373. doi:10.1021 / jo00027a064.
- ^ Curran, Dennis P .; Totleben, Michael J. (1992). "Samariová Grignardova reakce. Tvorba in situ a reakce primárních a sekundárních alkylsamariových (III) činidel". Journal of the American Chemical Society. 114 (15): 6050. doi:10.1021 / ja00041a024.
- ^ Künzer, H (1991). „Redukční desulfonylace fenylsulfonů jodidem samarnatým-hexamethylfosforečným triamidem“. Čtyřstěn dopisy. 32 (17): 1949–1952. doi:10.1016 / 0040-4039 (91) 85009-T.
- ^ Huffman, John W. (1983). "Redukce kov-amoniak cyklických alifatických ketonů". Účty chemického výzkumu. 16 (11): 399–405. doi:10.1021 / ar00095a002.
- ^ A b C Molander, Gary A .; Hahn, Gregory (1986). "Lanthanidy v organické syntéze. 2. Redukce a-heterosubstituovaných ketonů". The Journal of Organic Chemistry. 51 (7): 1135. doi:10.1021 / jo00357a040.
- ^ Kende, A (1991). "Řízená redukce nitroalkanů na alkylhydroxylaminy nebo aminy samarium-jodidem". Čtyřstěn dopisy. 32 (14): 1699–1702. doi:10.1016 / S0040-4039 (00) 74307-3.
- ^ Honda, T .; Naito, K .; Yamane, S .; Suzuki, Y. (1992). „Jodid samarnatý (II) podporoval redukční fragmentaci γ-halogenkarbonylových sloučenin: Aplikace na enantiošpecifickou syntézu (-) - oudemansinu A“. J. Chem. Soc., Chem. Commun. (17): 1218. doi:10.1039 / C39920001218.
- ^ Morokuma, Keiji .; Borden, Weston Thatcher .; Hrovat, David A. (1988). „Přechodové stavy křesel a lodí pro přeskupení Cope. Studie CASSCF“. Journal of the American Chemical Society. 110 (13): 4474. doi:10.1021 / ja00221a092.
- ^ Inanaga, Junji; Katsuki, Junko; Yamaguchi, Masaru (1991). „Deacetoxylace O-acetylsugarových laktonů podporovaná SmI2. Snadný přístup k deoxysugarovým laktonům“. Chemické dopisy. 20 (6): 1025–1026. doi:10.1246 / cl.1991.1025.
- ^ Souppe, J (1983). "Některé organické reakce podporované jodidem samarnatým". Journal of Organometallic Chemistry. 250: 227–236. doi:10.1016 / 0022-328X (83) 85053-0.
- ^ Crombie, L (1988). „Kruhové štěpení cyklických β-halogen-etherů se samarium-di-jodidem: syntéza (E) - a (Z) -nynolů“. Čtyřstěn dopisy. 29 (49): 6517–6520. doi:10.1016 / S0040-4039 (00) 82388-6.
- ^ Cabrera, A (1992). "Samarium (II) jodid - HMPA: Velmi účinný systém pro selektivní redukci α, β, -nenasycených karbonylových sloučenin". Čtyřstěn dopisy. 33 (35): 5007–5008. doi:10.1016 / S0040-4039 (00) 61174-7.
- ^ Molander, Gary A. (1992). "Aplikace lanthanidových činidel v organické syntéze". Chemické recenze. 92: 29–68. doi:10.1021 / cr00009a002.
- ^ Molander, Gary A .; Hahn, Gregory (1986). "Lanthanidy v organické syntéze. 4. Redukce a., .P-epoxyketonů s samodiumjodidem. Cesta k chirálním, neracemickým aldolům". The Journal of Organic Chemistry. 51 (13): 2596. doi:10.1021 / jo00363a038.


![{ displaystyle { begin {array} {r} {} { ce {RX -> [{ ce {SmI2}}] [- { ce {SmI2X}}] [R.] ->}} { begin {Bmatrix} { ce {-> [{ ce {SmI2}}] [{ text {R = alkyl}}] R-SmI2 -> [{ ce {HX}}]}}} {} { ce {-> [{ ce {Solv-H}}] [{ ce {-Solv ^ {.}}}]}} end {Bmatrix}} { ce {-> { RH} + SmI2X}} { text {R = aryl, alkenyl}} end {pole}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4857b54a4bcaa4d733be1f2ecd77bcec6f2fe6fe)
