Navádění specifické pro střeva - Gut-specific homing
Navádění specifické pro střeva je mechanismus, kterým se aktivuje T buňky a buňky vylučující protilátky (ASC) jsou zaměřeny na oba zanícený a nezánětlivé oblasti střeva, aby byly účinné imunitní odpověď. Tento proces se opírá o klíčovou interakci mezi integrin α4β7 a addressin MadCAM-1 na povrchu příslušných buněk. Navíc je tato interakce posílena přítomností CCR9, a chemokinový receptor, který interaguje s TECK. Vitamin A -odvozený kyselina retinová reguluje expresi těchto proteinů buněčného povrchu.
Souhrn T buněk

T buňky se produkují v brzlík, a při odchodu migrují do a kolem lymfatické orgány těla, včetně lymfatické uzliny. V paracortex lymfatických uzlin, kterým jsou vystaveni buňky prezentující antigen (APC), jako je dendritické buňky (DC). Specifické interakce mezi naivními T buňkami a jejich příbuznými antigeny vést k aktivaci T buněk. Aktivované T buňky, imunoblasty, podstoupit klonální expanzi před získáním funkcí efektoru. Aktivované T buňky poté emigrují z lymfatických uzlin prostřednictvím eferentní lymfatická céva a migrují kolem těla v krev.[1]
Za určitých okolností některé aktivované T buňky dávají přednost hlídání určitých papírové kapesníky. Toto bylo pojmenováno navádění lymfocytů. Navádění specifické pro střeva je preferenční pohyb aktivovaných T buněk do střevo a střevo. Tímto způsobem se T buňky účinně získávají, aby tvořily součást první linie obrany proti patogeny. Je to proto, že T buňky jsou namířeny a recirkulovány kolem míst primární infekce. Celkově to vede k extrémně vysoké koncentraci lymfocyty v tomto regionu; 70% imunoglobulin - produkující buňky se nacházejí v slizniční povrchy těla.[2]
Dějiny
Griselli poprvé navrhl, že existují různé cesty migrace T buněk.[3]
Počáteční teorie, že T buňky nebyly namířeny na tkáň, ale na antigeny, byly vyvráceny, protože práce Cahilla ukázala, že vyčištěné T buňky se přemístí do oblasti aktivace. Například T buňky aktivované v Peyerova náplast lymfatické uzliny nalezené ve střevě by se do střeva vrátily.[1] Následná práce se zaměřila na vysvětlení příčiny cílení této T buňky.

Původně se předpokládalo, že mikroprostředí lymfoidních tkání poskytuje podněty pro preferenční navádění lymfocytů.[4] I když tomu tak do jisté míry může být, v současnosti se obecně předpokládá, že hlavním faktorem navádění lymfocytů jsou interakce mezi T buňkami adhezní molekuly (receptory pro navádění lymfocytů ) a ligandy (adresiny) na tkáni vysoké endoteliální venuly (HEV). Tato teorie vznikla z pozorování, že integriny buněčného povrchu se lišily mezi různými populacemi T buněk. Byly zahájeny práce na identifikaci rozdílů a toho, co znamenají pro migraci T buněk.
Ukázalo se, že na aktivovaných T buňkách byly významně vyšší hladiny integrinu a4p7 ve srovnání s naivními T buňkami. Navíc byl tento integrin mnohem častější na CD8 + T buňkách aktivovaných v Peyerových náplastích (PP T-buňky) ve srovnání s jinými podskupinami T buněk, jako jsou periferní a mezenterické lymfatické uzliny aktivované T buňky.
Mechanismus
Mechanismus navádění specifického pro střeva je do značné míry založen na interakcích mezi receptory.
Postupná interakce
Lymfocyty migrují z krevního oběhu prostřednictvím výrazné „klouzavé interakce“ zprostředkované interakcemi mezi buněčnými povrchovými proteiny. K této „postupné interakci“ dochází ve třech fázích:
- Počáteční vazba lymfocytů vybrat a jeho ligand. To vytváří nestabilní interakci, kde je lymfocyt lehce držen na endotel stěna. Síla lymfy způsobuje, že se buňka charakteristicky valí podél cévy. Příkladem toho je interakce mezi L-selektin a ligand PNAD (adresa periferního uzlu).
- Zadržení „válcovací“ buňky aktivačním krokem. Další interakce mezi proteiny nebo aktivace prostřednictvím chemokiny způsobit vznik stabilnějších sil mezi buňkou a nádobou. Buňka je nyní pevně připevněna ke stěně cévy. Pokračováním příkladu by buňka byla zatčena interakcí mezi ICAM a LFA-1 které jsou posíleny chemokiny.
- Konformační změna. Buněčná aktivace způsobuje konformační změnu, která má za následek zploštění buňky proti stěně cévy. Jakmile se buňka zploští, může podstoupit transendoteliální migrace.[1]
Interakce proteinů specifické pro střeva
„Homing receptory“ mají zásadní význam při tvorbě interakcí, které umožňují pohyb lymfocytů.
Receptory zapojeny
MadCAM-1
MadCAM-1 exprese je kontinuální ve vysokých endoteliálních žilách Peyerových náplastí a v mikrotékách střevního traktu.[5] Inhibitory MadCAM-1 zabraňují migraci T buněk do střev.
Strukturní analýza proteinu MadCAM-1 ukazuje, že se jedná o transmembránový protein 41,5 kDa s malým cytoplazmatickým ocasem a velkou extracelulární oblastí. Tato extracelulární oblast zahrnuje tři domény podobné imunoglobinu (Ig). Poslední z nich má 33% strukturní identitu s Ca2 doména IgA-1. Předpokládá se, že první dvě z domén budou nejdůležitější v interakci s α4β7.
Protein MadCAM-1 má strukturální homologii s vaskulárními povrchovými receptory VCAM1 a ICAM na 28%, respektive 32%.[6]
Α4β7 integrin
To je vyjádřeno na aktivovaných T buňkách s potiskem pro navádění specifickým pro střeva. Je to protireceptor proteinu MadCAM-1 a jehož interakce způsobují počáteční krok interakce v „válcování“ buněčného modelu migrace lymfocytů
CCR9
CCR9 receptory jsou prezentovány na T buňkách a podílejí se na tvorbě stabilnější interakce mezi lymfocytem a stěnou cévy. Ligandem pro proteiny CCR9 je CCL25 chemokinový (což je jinak známý jako TECK) protein. CCL25 je chemokin, který po navázání na svůj receptor CCR9 na lymfocytu aktivuje konformační změna v povrchových integrinech na tomto lymfocytu,[7] umožňující vysokoafinitní vazbu na stěnu cévy a následně transmigrace.
Chemokin CCL25 převládá v epiteliální tkáni tenkého střeva (7). Bylo prokázáno, že CD8 + T buňky aktivované v lymfatické tkáni Peyer's patch vykazují a tropismus směrem k chemokinu CCL25. T buňky migrují nahoru gradientem směrem k CCL25.[4]
Ostatní buňky
Všechny GALT (lymfoidní tkáň spojená se střevem ) DC, s řetězcem α CD103, jsou schopné produkovat T-buňky navádějící střeva. Z toho bylo navrženo, aby byly dendritické buňky nějakým způsobem otištěny před dosažením lymfoidních orgánů, aby se indukovaly naváděcí schopnosti.[8]
Regulace vitaminu A.
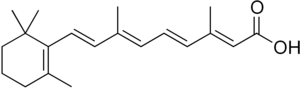
Vitamin A hraje zásadní součást reakce navádění na střeva. Důkazy ukazují, že se vitamin A přeměňuje na kyselina retinová (RA) oxidací v dendritických buňkách náplastí Peyers. Přítomnost RA vede k expresi klíčových naváděcích receptorů, α4β7 a CCR9, na buněčný povrch T buněk potenciálně prostřednictvím transkripční regulace.
Výroba kyseliny retinové
Alkohol dehydrogenázy (ADH) a retinální dehydrogenáza Enzymy (RALDH) katalyzují oxidaci dietního vitaminu A na kyselinu retinovou. Je to přítomnost této kyseliny retinové, která indukuje expresi CCR9 a α4β7.[9] Nižší koncentrace kyseliny retinové uvnitř buňky mají za následek sníženou expresi chemokinového receptoru CCR9, což zase omezuje schopnost buňky vstupovat do střevní sliznice. Zatímco exprese a4p7 je také snížena při nižších koncentracích kyseliny retinové, předpokládá se, že hladiny kyseliny retinové musí být ve větší míře vyčerpány, aby ovlivnily expresi a4p7 ve srovnání s CCR9.[10]
Analýza Western blot ukázala, že dendritické buňky z Peyersových náplastí produkují jak RALDH1, tak ADH proteiny. Dále bylo zjištěno, že jsou exprimovány v epiteliálních buňkách tenkého střeva. Z toho tedy vyplývá, že tyto buňky jsou schopné přeměňovat vitamin A na hlavní fyziologickou formu RA: all-trans RA. Studie ukazující schopnost DC katalyzovat změnu retinolu na kyselinu retinovou tento předpoklad potvrzují.[10]

Účinek na expresi receptorů
Výzkum na myších ukázal, že hladina kyseliny retinové v buňkách měla významný vliv na expresi receptorů na buněčném povrchu. Myší modely ukázaly, že dokonce 0,1 nM zvýšení koncentrace kyseliny retinové v buňkách zvýšilo expresi a4. Exprese β7 byla dále zvýšena zvýšením koncentrace buněčné kyseliny retinové. Aby se zajistilo, že zvýšení koncentrace RA bylo způsobeno katalytickými enzymy ADH a RALDH, byly použity inhibitory těchto enzymů. Citral, inhibitor enzymu RALDH, potlačil expresi α4β7 adhesinů na buněčném povrchu, což naznačuje, že katalýza na vitamin A → kyselina retinová byla důležitá.
Naváděcí schopnost
To by teoreticky mělo zvýšit schopnost navádění aktivovaných T buněk do střeva. Důkazem toho byly studie používající myši léčené RA a deficitem vitaminu A. U myší se zvýšenou hladinou RA byl ve střevní tkáni nalezen vyšší počet T buněk. Výzkum myší s nedostatkem vitaminu A potvrdil, že opak je pravdivý, protože ve střevě byl nalezen významně nižší počet T buněk lamina propria ve srovnání s kontrolními myšmi. Naproti tomu nedošlo k žádnému takovému snížení počtu T buněk v plicích a játrech deficitních myší, což by znamenalo, že dráha otisku RA je jedinečná pro naváděcí T buňky specifické pro střeva.[11]
Regulace transkripce kyselinou retinovou
Teorizoval, že hladiny RA ovlivňují expresi receptorů MadCAM-1 a α4β7 transkripční regulací.
Receptory RAR a RXR, které jsou nukleovými receptory pro RA, mohou za určitých buněčných podmínek vytvářet heterodimery. V dimerní konformaci jsou receptory schopné vázat RARE nebo RXRE sekvence nacházející se v DNA. Tyto genetické oblasti se často nacházejí na 5 'konci genů, což naznačuje, že hrají regulační roli. Ve skutečnosti se často nacházejí poblíž začátku nebo v intronech genů regulovaných v reakci na hladiny retinoidů.
Sekce těchto RARE sekvencí a navíc RA boxy byly nalezeny v prvních exonech genů, které kódují receptory b7 a CCR9. Použití antagonistických proteinů proti RAR podjednotce ukázalo snížení exprese alfa.[12]
Může se tedy stát, že exprese alfa receptorů je transkripčně regulována koncentrací RA v buňce.
Další účinky vitaminu A na navádění lymfocytů
Bylo také prokázáno, že zvýšené koncentrace vitaminu A snižují expresi receptorů P-Lig, E-Lig a Fuct-VII in vitro. To naznačuje, že vitamin A nejen zvyšuje schopnost T-buněk vracet se do střev, ale také současně snižuje pravděpodobnost, že se buňka naváže na jinou tkáň.
Důvody pro navádění lymfocytů
Nejpřesvědčivějším argumentem je, že nasměrováním lymfocytů na oblast, ve které byly aktivovány, je pravděpodobnější, že přijdou do styku se svým příbuzným antigenem. Zaměřují se na oblast, kde se antigen patogenu s největší pravděpodobností nachází na periferii. Dále je možné, že typ tkáně může mít vliv na fenotypový rysy T-buněk jak po aktivaci, tak po migraci přes tkáň. Proto by se zdálo rozumné, aby T buňky vykazovaly známky preferenční tkáně, protože pravděpodobně plní svoji ochrannou roli v prostředí, pro které jsou nejvhodnější.
Obavy o zdraví
U starších lidí je běžný pokles střevní imunitní odpovědi. Tento imunosenescence Předpokládá se, že je to způsobeno zhoršeným naváděním lymfocytů na náplasti Peyers nalezené ve střevě.[13]
Tento proces není pro člověka jedinečný a je dokumentován u jiných zvířat, včetně makaků rhesus [14] a krysy. Výzkum ukázal, že starší krysy měly sníženou expresi klíčových naváděcích receptorů specifických pro střeva α4β7; a MadCAM-1. Tyto starší krysy měly o 30% méně α4β7; a o 17% méně MadCAM-1 než ekvivalenty mladých potkanů.[15]
I když dosud nebyl prokázán žádný příčinný vztah, spekuluje se, že snížená exprese receptorů je zodpovědná za celkovou ztrátu imunitní odpovědi. Navíc posttranslační modifikace mohou oslabit vzájemnou afinitu receptorů.[15]
Budoucí práce
Je zapotřebí mnohem více práce, abychom plně porozuměli podmínkám potřebným k navození navádění na tkáň. S lepším porozuměním však pole nabízí velký potenciál v lékařské terapii. Je možné zaměřit se na orální oslabené vakcíny na střevní sliznici. Tímto způsobem by snad vakcína byla spolehlivější a účinnější. Navíc může zlepšit léčbu chronického onemocnění střev.
Navádění jiných lymfocytů specifických pro tkáně
Specifické navádění do střeva je nejvíce chápáno z navádění lymfocytů. Existuje však mnoho dalších příkladů, které zahrnují:
- Lymfoidní specifické navádění- Navádění naivních T buněk do lymfatické tkáně kolem těla. Adhesin exprimovaný naivními T buňkami je L-selektin (1). jakmile jsou T buňky aktivovány, potlačují expresi L selektinu, aby jim umožnily volnou migraci po těle v krvi.
- Navádění specifické pro kůži- Působí jako metoda náboru velkého počtu paměťových T buněk do kůže, což představuje vysoké riziko infekce. To opět zahrnuje expresi různých integrinů. V tomto případě u lidí α4β1 a kožní lymfocytární antigen (CLA ) jsou exprimovány na povrchu T buněk. Tyto integriny interagují s E-výběr molekuly nacházející se na zanícené kůži.
- Určení prsu- Podílí se na přesměrování T-buněk do mléčných žláz. k tomu dochází, aby mohly být do mateřského mléka zahrnuty ochranné lymfocyty.
- Navádění B buněk- O tom jsou pozdní znalosti omezené.
Reference
- ^ A b C Mackay (1993). "Navádění naivních, paměťových a efektorových lymfocytů". Aktuální názor na imunologii. 5 (3): 423–427. doi:10.1016 / 0952-7915 (93) 90063-X. PMID 8347302.
- ^ von Andrian, Mempel (2003). "Vracení a mobilní provoz v lymfatických uzlinách". Recenze přírody Imunologie. 3 (11): 867–878. doi:10.1038 / nri1222. PMID 14668803.
- ^ Iwata, Hirakiyama; et al. (2004). "Kyselina retinová otiskuje specificitu navádění na T buňky". The Journal of Clinical Investigation. 21 (8): 527–538. doi:10,1172 / JCI44262. PMC 3223921. PMID 21737878.
- ^ A b Rodrigo Mora, Nono, Manjunath; et al. (2003). "Selektivní otisk střevních buněk T podle Peyerových náplastí dendritických buněk". Příroda. 424 (6944): 88–93. Bibcode:2003 Natur.424 ... 88 mil. doi:10.1038 / nature01726. PMID 12840763.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Schippers, A; Leuker, C; Pabst, O; Kochut, A; Prochnow, B; Gruber, AD; Leung, E; Krissansen, GW; Wagner, N; Müller, W (září 2009). „Mukosální adresinová buněčná adhezní molekula-1 řídí migraci a funkci plazmatických buněk v tenkém střevě myší“. Gastroenterologie. 137 (3): 924–33. doi:10.1053 / j.gastro.2009.05.039. PMID 19450594.
- ^ Briskin; et al. (1996). „Strukturální požadavky na vazbu slizničního vaskulárního adresinu na jeho lymfocytový receptor alfa 4 beta 7. společná témata mezi interakcemi rodiny integrin-Ig“. Journal of Immunology. 156 (2): 719–726. PMID 8543825.
- ^ Parmo-Cabañas, M; García-Bernal D; García-Verdugo R; Kremer L; Márquez G; Teixidó J. (srpen 2007). "Intracelulární signalizace vyžadovaná pro CCL25 stimulovanou T buněčnou adhezi zprostředkovanou integrinem alfa4beta1". J. Leukoc. Biol. 82 (2): 380–91. doi:10.1189 / jlb.1206726. hdl:10261/72227. PMID 17510295.
- ^ Johansso-Lindbom; et al. (2005). "Funkční specializace střevních CD103 + dendritických buněk v regulaci navádění tkáňově selektivních T buněk". Journal of Experimental Medicine. 234 (1): 268–281. doi:10.1111 / j.0105-2896.2009.00874.x. PMID 20193025.
- ^ Duester (2000). "Rodiny retinoid dehydrogenáz regulujících funkci vitaminu A: produkce vizuálního pigmentu a kyseliny retinové". European Journal of Biochemistry. 8 (14): 4315–24. doi:10.1046 / j.1432-1327.2000.01497.x. PMID 10880953.
- ^ A b Berlin (1993). „Integrin alfa4beta7 zprostředkovává vazbu lymfoktu na slizniční vaskulární adresin MAdCAM-1“. Buňka. 74 (1): 185–195. doi:10.1016 / 0092-8674 (93) 90305-a. PMID 7687523.
- ^ Versnel (2004). "Kyselina retinoová: vzdělávací" vitaminový elixír "pro střevní buňky T". Imunita. 21 (4): 458–460. doi:10.1016 / j.immuni.2004.10.002. PMID 15485623.
- ^ Iwata; et al. (2004). "Kyselina retinová otiskuje Gut homing specifický na T buňkách". Imunita. 21 (4): 527–538. doi:10.1016 / j.immuni.2004.08.011. PMID 15485630.
- ^ Schmucker, DL; Owen, RL; Outenreath, R; Thoreux, K (2003). „Základ pro věkem snížený imunitní systém sliznic“. Klinická a vývojová imunologie. 10 (2–4): 167–72. doi:10.1080/10446670310001642168. PMC 2485420. PMID 14768948.
- ^ Taylor, LD; Daniels, CK; Schmucker, DL (duben 1992). "Stárnutí ohrožuje imunitní odpověď sliznice trávicího traktu u opice rhesus". Imunologie. 75 (4): 614–8. PMC 1384839. PMID 1592437.
- ^ A b Schmucker, Douglas L; Owen, Trevor M; Issekutz, Thomas B; Gonzales, Loida; Wang, Rose K (srpen 2002). "Exprese receptorů pro navádění lymfocytů α4β7 a MAdCAM-1 u mladých a starých krys". Experimentální gerontologie. 37 (8–9): 1089–1095. doi:10.1016 / S0531-5565 (02) 00065-7. PMID 12213559.
