Kyselina kyanurová - Cyanuric acid - Wikipedia
 | |||
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC 1,3,5-Triazinan-2,4,6-trion[1] | |||
| Ostatní jména 1,3,5-Triazin-2,4,6 (1H,3H,5H) -trione[1] 1,3,5-triazinetriol s-Triazinetriol s-Triazinetrion Trikarbimid Kyselina isokyanurová Kyselina pseudokyanurová | |||
| Identifikátory | |||
3D model (JSmol ) |
| ||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.003.290 | ||
| KEGG | |||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C3H3N3Ó3 | |||
| Molární hmotnost | 129,07 g / mol | ||
| Vzhled | bílý krystalický prášek | ||
| Hustota | 1,75 g / cm3 | ||
| Bod tání | 320–360 ° C (608–680 ° F; 593–633 K) se rozkládá | ||
| 0,27 g / 100 ml (25 ° C) | |||
| -61.5·10−6 cm3/ mol | |||
| Nebezpečí | |||
| Bezpečnostní list | ICSC 1313 | ||
| Související sloučeniny | |||
Příbuzný triaziny | Kyanurový fluorid Chlorid kyanurový Kyanurový bromid | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
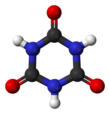
Kyselina kyanurová nebo 1,3,5-triazin-2,4,6-triol je chemická sloučenina s vzorec (CNOH)3. Stejně jako mnoho průmyslově užitečných chemikálií i toto triazin má mnoho synonym. Tato bílá pevná látka bez zápachu nachází použití jako předchůdce nebo složka bělidla, dezinfekční prostředky a herbicidy. V roce 1997 činila celosvětová produkce 160 milionů kilogramů.[2]
Vlastnosti a syntéza
Vlastnosti
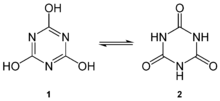
Kyselinu kyanurovou lze považovat za cyklickou zastřihovač nepolapitelného druhu kyselina kyanová, HOCN. Kroužek může snadno převádět mezi dvěma struktur přes keto – enol tautomerismus. Triol tautomer, který může mít aromatický charakter,[3] v řešení převládá. The hydroxyl (-OH) skupiny předpokládají fenolický charakter. Deprotonace bází poskytuje řadu kyanurátů soli:
- [C (O) NH]3 ⇌ [C (O) NH]2[OŠIDIT]− + H+ (pKA = 6.88)[4]
- [C (O) NH]2[OŠIDIT]− ⇌ [C (O) NH] [C (O) N]22− + H+ (pKA = 11.40)
- [C (O) NH] [C (O) N]22− ⇌ [C (O) N]33− + H+ (pKA = 13.5)
Kyselina kyanurová je známá svou silnou interakcí s melamin, tvořící nerozpustný melaminkyanurát. Tato interakce zablokuje kyselinu kyanurovou do triketo tautomeru.
Syntéza
Kyselina kyanurová (CYA) byla nejprve syntetizována Friedrich Wöhler v roce 1829 tepelným rozkladem močovina a kyselina močová.[5] Současná průmyslová cesta na CYA zahrnuje tepelný rozklad močoviny s uvolňováním amoniaku. Konverze začíná při přibližně 175 ° C:[2]
- 3 H2N-CO-NH2 → [C (O) NH]3 + 3 NH3
CYA krystalizuje z vody jako dihydrát.
Kyselinu kyanurovou lze vyrobit hydrolýzou surového nebo odpadního melaminu a následnou krystalizací. Kyselé odpadní toky z rostlin vyrábějících tyto materiály obsahují kyselinu kyanurovou a příležitostně rozpuštěné aminosubstituované triaziny, jmenovitě ammeline, ammelid a melamin. V jedné metodě, an síran amonný Roztok se zahřeje na teplotu varu a zpracuje se stechiometrickým množstvím melaminu, což znamená, že přítomná kyselina kyanurová se vysráží jako komplex melamin-kyanurová kyselina. Různé odpadní toky obsahující kyselinu kyanurovou a aminosubstituované triaziny mohou být kombinovány k likvidaci a během rušivých podmínek může být v odpadních tocích přítomna nerozpuštěná kyselina kyanurová.[6][7]
Meziprodukty a nečistoty
Meziprodukty při dehydrataci zahrnují obojí kyselina isokyanová, biuret, a triuret:
- H2N-CO-NH2 → HNCO + NH3
- H2N-CO-NH2 + HNCO → H2N-CO-NH-CO-NH2
- H2N-CO-NH-CO-NH2 + HNCO → H2N-CO-NH-CO-NH-CO-NH2
Jednou nečistotou při výrobě CYA je ammelid, zvláště pokud reakční teplota překročí 190 ° C: 3 H2N-CO-NH-CO-NH2 → [C (O)]2(CNH2) (NH)2N + 2 NH3 + H2První výskyt ammelamidu nastává před 225 ° C a předpokládá se, že k němu dochází také při rozkladu biuretu, ale je produkován pomaleji než u CYA.
Melamin, [C (NH2) N]3, k tvorbě dochází mezi 325 a 350 ° C a pouze ve velmi malém množství.[8]
Aplikace
Kyselina kyanurová se používá jako stabilizátor chloru v bazény. Váže se na volný chlór a pomalu ho uvolňuje, čímž prodlužuje čas potřebný k vyčerpání každé dávky dezinfekčního prostředku.
The antineoplastický teroxiron, se tvoří reakcí kyseliny kyanurové se 3 ekvivalenty epichlorhydrin.[9]
Prekurzory chlorovaných kyanurátů
Kyselina kyanurová se používá hlavně jako a předchůdce na N-chlorované kyanuráty, které se používají k dezinfekci vody. Dichlorderivát se připravuje přímou chlorací:
- [C (O) NH]3 + 2 Cl2 + 2 NaOH → [C (O) NCl]2[C (O) NH]
Tento druh se obvykle převádí na sodnou sůl, dichlor-s-triazinetrion sodný. Další chlorace dává kyselina trichlorisokyanurová, [C (O) NCl]3. Tyto N-chlorované sloučeniny slouží jako dezinfekční prostředky a algicidy pro vodu v bazénu.[2] Stabilizuje chlór v bazénu a zabraňuje rychlé spotřebě chloru slunečním zářením.
Prekurzory síťovacích činidel
Díky své trifunkčnosti je CYA předchůdcem síťovacích činidel, zejména pro polyuretan pryskyřice a polyisokyanurát termosetové plasty.
Analýza
Testování koncentrace kyseliny kyanurové se běžně provádí turbidometrickým testem, při kterém se k vysrážení kyseliny kyanurové použije činidlo, melamin. Příbuzný zákal zreagovaného vzorku kvantifikuje koncentraci CYA. Citováno v roce 1957.[10]Tento test funguje, protože melamin kombinuje s kyselinou kyanurovou ve vodě jemnou, nerozpustnou bílou barvu sraženina (melaminkyanurát), který způsobuje zakalení vody v poměru k množství kyseliny kyanurové v ní. V poslední době byla vyvinuta citlivá metoda pro analýzu kyseliny kyanurové v moči.[11]
Krmivo pro zvířata
FDA umožňuje, aby v některých bylo přítomno určité množství kyseliny kyanurové nebílkovinový dusík (NPN) přísady používané v krmivech a pitné vodě.[12] Jako NPN byla použita kyselina kyanurová. Například, Archer Daniels Midland vyrábí doplněk NPN pro skot, který obsahuje biuret, triuret, kyselinu kyanurovou a močovina.[13]
2007 připomíná krmivo pro domácí zvířata
Kyselina kyanurová se podílí na spojení s 2007 připomíná krmivo pro domácí zvířata, kontaminace a rozsáhlé stahování mnoha značek krmiv pro kočky a psy počínaje březnem 2007. Výzkumy prokázaly, že kyselina kyanurová, složka moči, spolu s melaminem tvoří špatně rozpustné krystaly, které mohou způsobit selhání ledvin (viz část Analýza výše).
Bezpečnost
Kyselina kyanurová je klasifikována jako „v podstatě netoxická“.[2] 50% orální medián smrtelné dávky (LD50 ) je 7700 mg / kg u potkanů.[14]
Pokud je však kyselina kyanurová přítomna společně s melamin (což je samo o sobě další látka s nízkou toxicitou), bude tvořit nerozpustnou látku a spíše nefrotoxický komplex,[15] jak dokazují psi a kočky během Kontaminace krmiva pro zvířata v roce 2007 a u dětí během Čínský skandál s mlékem z roku 2008 případech.
Přirozený výskyt
Nečistá měďnatá sůl kyseliny se vzorcem Cu (C3N3Ó3H2)2(NH3)2, je v současné době jediný známý isokyanurátový minerál, zvaný joanneumit. Byl nalezen na guananském ložisku v Chile. Je to velmi vzácné.[16]
Reference
- ^ A b Nomenklatura organické chemie: Doporučení IUPAC a preferovaná jména 2013 (modrá kniha). Cambridge: Královská společnost chemie. 2014. s. 733. doi:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ A b C d Klaus Huthmacher, Dieter Most "Kyselina kyanurová a chlorid kyanurový" "Ullmann's Encyclopedia of Industrial Chemistry" 2005, Wiley-VCH, Weinheim. Doi 10,1002 / 14356007.a08 191
- ^ Pérez-Manríquez, Liliana; Cabrera, Armando; Sansores, Luis Enrique; Salcedo, Roberto (7. září 2010). „Aromaticita v kyselině kyanurové“. Journal of Molecular Modeling. 17 (6): 1311–1315. doi:10.1007 / s00894-010-0825-2. PMC 3102184. PMID 20820829.

- ^ „Disociační konstanty organických kyselin a zásad“ Příručka chemie a fyziky CRC, internetová verze 2005 (85. vydání)
- ^ Wöhler, F. (1829) „Ueber die Zersetzung des Harnstoffs und der Harnsäure durch höhere Temperatur,“ (O rozkladu močoviny a kyseliny močové při vyšší teplotě), Annalen der Physik und Chemie, 2. série, 15 : 619-630.
- ^ „Proces přípravy čisté kyseliny kyanurové“. 14. července 1981. Citováno 2007-12-10.
- ^ „Vysokotlaký proces tepelné hydrolýzy k rozkladu triazinů v kyselých odpadních tocích“. 22. března 1977. Citováno 2007-12-10.
- ^ Shaber, Peter M. a kol. „Studie tepelného rozkladu reakce močoviny (pyrolýzy) a významu pro výrobu kyseliny kyanurové,“ American Laboratory, srpen 1999: 13-21 „Archivovaná kopie“ (PDF). Archivovány od originál (PDF) dne 28. 9. 2007. Citováno 2007-05-08.CS1 maint: archivovaná kopie jako titul (odkaz)
- ^ M. Budnowski, Angew. Chem., 7, 827 (1968).
- ^ „Test zákalu společnosti Merck“. Merck. 6. června 2003. Archivovány od originál 1. července 2007. Citováno 2007-05-06. (mrtvý odkaz 8. dubna 2018)
- ^ Panuwet P, Wade EL, Nguyen JV, Montesano MA, Needham LL, Barr DB. Kvantifikace zbytků kyseliny kyanurové v lidské moči pomocí vysoce účinné kapalinové chromatografie - tandemové hmotnostní spektrometrie. J Chromatogr B Analyt Technol Biomed Life Sci 2010 878 (28): 2916-2922.
- ^ „21CFR573.220 Krmný biuret“. US Food and Drug Administration. 1. dubna 2006. Citováno 2007-05-06.
- ^ „Roughage Buster Plus: přísady“. Archer Daniels Midland. Archivovány od originál dne 12.02.2007. Citováno 2007-05-06.
- ^ US Food and Drug Administration, „Prozatímní bezpečnost melaminu a analogů / posouzení rizik; dostupnost“, Archivováno 16. prosince 2007, na Wayback Machine Federální registr: 30. května 2007 (svazek 72, číslo 103). Zpřístupněno 27. 9. 2008.
- ^ „Interakce melaminu a kyseliny kyanurové může hrát roli v nemoci a smrti z důvodu odvolání krmiva pro domácí mazlíčky“ Archivováno 18. května 2007, v Wayback Machine, Americká veterinární lékařská asociace (AVMA), tisková zpráva, 1. května 2007. Zpřístupněno 27. 9. 2008.
- ^ Mindat, http://www.mindat.org/min-42755.html
externí odkazy
- Mezinárodní karta chemické bezpečnosti 1313
- Oregonská veterinární lékařská asociace (OVMA) Kontaminace krmiva pro zvířata v zájmovém chovu - Novinky a vývoj jsou pravidelně aktualizovány