Chlorid kyanurový - Cyanuric chloride
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC 2,4,6-trichlor-1,3,5-triazin | |
| Ostatní jména Trichlorotriazin chlorid s-triazinu Kyanurylchlorid TCT | |
| Identifikátory | |
3D model (JSmol ) | |
| 124246 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.003.287 |
| Číslo ES |
|
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
| UN číslo | 2670 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C3Cl3N3 | |
| Molární hmotnost | 184.40 g · mol−1 |
| Vzhled | bílý prášek |
| Zápach | pronikavý |
| Hustota | 1,32 g / cm3 |
| Bod tání | 144–148 ° C (291–298 ° F; 417–421 K) |
| Bod varu | 192 ° C (378 ° F; 465 K) |
| hydrolyzuje | |
| Rozpustnost v organických rozpouštědlech | rozpustný |
| Struktura | |
| monoklinický | |
| Nebezpečí | |
| Bezpečnostní list | ICSC 1231 |
| Piktogramy GHS |    |
| Signální slovo GHS | Nebezpečí |
| H302, H314, H317, H330 | |
| P260, P261, P264, P270, P271, P272, P280, P284, P301 + 312, P301 + 330 + 331, P302 + 352, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P320, P321, P330, P333 + 313, P363, P403 + 233, P405, P501 | |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | Nehořlavé |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
LD50 (střední dávka ) | 485 mg / kg (potkan, orálně) |
| Související sloučeniny | |
Příbuzný triaziny | Kyselina kyanurová Kyanurový fluorid Kyanurový bromid Kyselina trichlorisokyanurová |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Chlorid kyanurový je organická sloučenina s vzorec (NCCl)3. Tato bílá pevná látka je chlorovaný derivát 1,3,5-triazin. To je zastřihovač z chlorkyan.[1] Chlorid kyanurový je hlavním předchůdcem populárního, ale kontroverzního herbicidu atrazin.
Výroba
Chlorid kyanurový se připravuje ve dvou krocích od kyanovodík prostřednictvím prostředníka chlorkyan, který je trimerizován při zvýšených teplotách na uhlíkovém katalyzátoru:
- HCN + Cl2 → ClCN + HCl

V roce 2005 bylo vyrobeno přibližně 200 000 tun.[2]
Průmyslové použití
Odhaduje se, že 70% chloridu kyanurového se používá zejména při přípravě pesticidů třídy triazinu atrazin. Tyto reakce se spoléhají na snadné vytěsnění chloridu nukleofily jako jsou aminy:
- (ClCN)3 + 2 RNH2 → (RNHCN) (ClCN)2 + RNH3+Cl−
Jiné triazinové herbicidy, jako např simazin, anilazin a cyromazin jsou vyrobeny analogickým způsobem.[3]
Chlorid kyanurový se také používá jako předzvěst barviv a síťovacích činidel. Největší třídou těchto barviv jsou sulfonované triazin-stilbenové optické zjasňovače (OBA) nebo fluorescenční bělící prostředky (FWA), které se běžně vyskytují ve vzorcích detergentů a bílém papíře.[2] Mnoho reaktivní barviva také začleňují triazinový kruh. Rovněž se vyrábějí výše popsanou reakcí s vytěsňováním chloridů.[3][4]
Organická syntéza
V jedné specializované aplikaci se chlorid kyanuritý používá jako a činidlo v organická syntéza pro přeměnu alkoholů a karboxylových kyselin na alkylchloridy a acylchloridy:[5]
Používá se také jako dehydratační činidlo a pro aktivaci karboxylových kyselin pro redukci na alkoholy. Vytápění pomocí DMF dává mi „Goldovo činidlo“2NCH = NCH = NMe2+Cl−, což je všestranný zdroj aminoalkylací a předchůdce heterocyklů.[6][7]
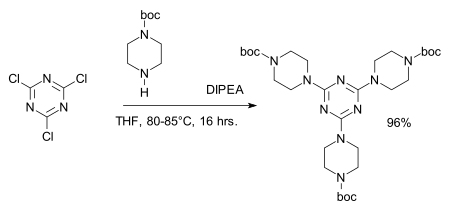
Chloridová centra lze snadno nahradit aminy dát melamin deriváty, například při syntéze dendrimery:[8][9]
Rovněž se používá syntéza experimentu adenosinový receptor ligand .:[10]
Chlorid kyanurový lze také použít jako alternativu k oxalylchlorid v Swernova oxidace.[11]
Viz také
- Thiazylchloridový trimer - strukturní analog s atomy síry místo uhlíku
Reference
- ^ Chlorid kyanurový na adrese Chemicalland21.com
- ^ A b Klaus Huthmacher, Dieter Most „Cyanuric Acid and Cyanuric Chloride“ v Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002 / 14356007.a08_191.
- ^ A b Ashfordův slovník průmyslových chemikálií, 3. vydání, 2011, strany 2495-8
- ^ Tappe, Horst; Helmling, Walter; Mischke, Peter; Rebsamen, Karl; Reiher, Uwe; Russ, Werner; Schläfer, Ludwig; Vermehren, Petra (2000). Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002 / 14356007.a22_651. ISBN 978-3527306732.
- ^ K. Venkataraman & D. R. Wagle (1979). „Chlorid kyanurový: užitečné činidlo pro přeměnu karboxylových kyselin na chloridy, estery, amidy a peptidy“. Tetrahedron Lett. 20 (32): 3037–3040. doi:10.1016 / S0040-4039 (00) 71006-9.
- ^ Probst, D. A .; Hanson, P. R .; Barda, D. A. „Cyanuric Chloride“ v Encyclopedia of Reagents for Organic Synthesis, 2004, John Wiley & Sons. doi:10.1002 / 047084289X.rn00320
- ^ John T. Gupton; Steven A. Andrews (1990). „β-Dimethylaminomethylenace: N,N-Dimethyl-N'-p-tolylformamidin ". Organické syntézy.; Kolektivní objem, 7, str. 197
- ^ Abdellatif Chouai a Eric E. Simanek (2008). „Syntéza kilogramového měřítka dendrimeru druhé generace založená na 1,3,5-triazinu s využitím zelených a průmyslově kompatibilních metod s jediným chromatografickým krokem“. J. Org. Chem. 73 (6): 2357–2366. doi:10.1021 / jo702462t. PMID 18307354.
- ^ Činidlo: DIPEA, amin ochranná skupina: BOC
- ^ WO přihláška 03101980, „1,3,5-Triazinové deriváty jako ligandy pro receptory lidského adenosinu-A3“, publikováno 11. 12. 2003 (Činidlo číslo dvě: norefedrin, základna DIPEA )
- ^ De Luca, L .; Giacomelli, G .; Procheddu, A (2001). „Mírná a účinná alternativa k oxidaci klasického Swernova“. J. Org. Chem. 66 (23): 7907. doi:10.1021 / jo015935s.