Bis (trifenylfosfin) palladiumchlorid - Bis(triphenylphosphine)palladium chloride
 | |
 | |
 | |
| Identifikátory | |
|---|---|
3D model (JSmol ) |
|
| ChemSpider | |
| Informační karta ECHA | 100.034.299 |
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C36H30Cl2P2Pd | |
| Molární hmotnost | 701.90 g · mol−1 |
| Vzhled | žlutý prášek |
| Bod tání | 260 ° C (rozloženo na 300 ° C) |
| Nerozpustný ve vodě, acetonu, etheru, tetrachlormethanu a n-heptanu // Rozpustný v CHCI3 a CH2Cl2, Chloroform (mírně), methanol (mírně, zahřívaný) | |
| Nebezpečí | |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | 181,7 ° C |
| Související sloučeniny | |
Související sloučeniny | Bis (trifenylfosfin) chlorid platiny |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
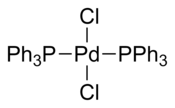
Bis (trifenylfosfin) palladiumchlorid je koordinační sloučenina z palladium obsahující dva trifenylfosfin a dva chlorid ligandy. Je to žlutá pevná látka, která je rozpustná v některých organických rozpouštědlech. Používá se pro palladiem katalyzované kopulační reakce, např. the Reakce Sonogashira – Hagihara. Komplex je čtvercový rovinný. Je známo mnoho analogických komplexů s různými fosfinovými ligandy.
Příprava a reakce
Tuto sloučeninu lze připravit zpracováním chlorid palladnatý s trifenylfosfin:[1][2]
- PdCl2 + 2 PPh3 → PdCl2(PPh3)2
Při redukci s hydrazin v přítomnosti přebytku trifenylfosfinu je komplex předchůdcem tetrakis (trifenylfosfin) palladium, Pd (PPh3)4:[3]
- 2 PdCl2(PPh3)2 + 4 PPh3 + 5 N.2H4 → 2 Pd (PPh3)4 + N2 + 4 N.2H5+Cl−
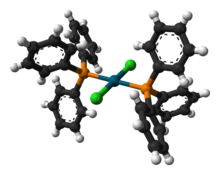
Struktura
Několik krystalové struktury obsahující PdCl2(PPh3)2 byl nahlášen. Ve všech strukturách PdCl2(PPh3)2 přijímá a čtvercová rovinná koordinační geometrie a trans izomerní forma.[4][5][6][7]
Aplikace
Komplex se používá jako předkatalyzátor pro různé vazebné reakce.[8]

The Suzukiho reakce kdysi byla omezena vysokými hladinami katalyzátoru a omezenou dostupností boronových kyselin. Byly také nalezeny náhrady za halogenidy, čímž se zvýšil také počet vazebných partnerů pro halogenid nebo pseudohalid. Použitím bis (trifenylfosfin) palladiumchloridu jako katalyzátoru byly trifláty a boronové kyseliny spojeny v 80 kilogramovém měřítku v dobrém výtěžku.[9] Stejný katalyzátor je účinný pro Sonogashira spojka.[10]
Viz také
Reference
- ^ Norio Miyaura a Akira Suzuki (1990). „Palladiem katalyzovaná reakce 1-alkenylboronátů s vinylovými halogenidy: (1Z, 3E) -1-fenyl-1,3-oktadien“. Organické syntézy. 68: 130. doi:10.15227 / orgsyn.068.0130.CS1 maint: používá parametr autoři (odkaz)
- ^ Hiroshi Itatani, J.C. Bailar (1967). "Homogenní katalýza v reakcích olefinických látek. V.Hydrogenace methylesteru sójového oleje s trifenylfosfinem a trifenylarzinovými palladiovými katalyzátory". Journal of the American Oil Chemists 'Society. 44: 147. doi:10.1007 / BF02558176.CS1 maint: používá parametr autoři (odkaz)
- ^ D. R. Coulson (1972). Tetrakis (trifenylfosfin) palladium (0). Inorg. Synth. Anorganické syntézy. 13. s. 121–124. doi:10.1002 / 9780470132449.ch23. ISBN 9780470132449.
- ^ G. Ferguson, R. McCrindle, A. J. McAlees a M. Parvez (1982). "trans-Dichlorobis (trifenylfosfin) palladium (II) ". Acta Crystallogr. B38 (10): 2679–2681. doi:10.1107 / S0567740882009583.CS1 maint: používá parametr autoři (odkaz)
- ^ G. Steyl (2006). "trans-Dichlorbis (trifenylfosfin) palladium (II), dichlormethanový solvát ". Acta Crystallogr. E. 62: m1324 – m1325. doi:10.1107 / S1600536806017521.
- ^ J. Pons, J. García-Antón, X. Solans, M. Font-Bardia, J. Ros (2008). "trans-Dichloridobis (trifenylfosfin) palladium (II) ". Acta Crystallogr. E. 64: m621. doi:10.1107 / S1600536808008337.CS1 maint: používá parametr autoři (odkaz)
- ^ A. Naghipour, A. Ghorbani-Choghamarani, H. Babaee, M. Hashemi, B. Notash (2017). "Krystalová struktura nové polymorfní formy trans-dichlorbis (trifenylfosfin) palladium (II) a jeho aplikace jako nového, účinného a vyhledatelného katalyzátoru pro aminaci arylhalogenidů a stille křížových vazebných reakcí “. J. Organomet. Chem. 841: 31–38. doi:10.1016 / j.jorganchem.2016.10.002.CS1 maint: používá parametr autoři (odkaz)
- ^ René Severin, Jessica Reimer, Sven Doye (2010). „Postup v jedné nádobě pro syntézu nesymetrických diarylalkynů“. J. Org. Chem. 75 (10): 3518–352. doi:10.1021 / jo100460v. PMID 20420397.CS1 maint: používá parametr autoři (odkaz)
- ^ Jacks, T. E.; Belmont, Daniel T .; Briggs, Christopher A .; Horne, Nicole M .; Kanter, Gerald D .; Karrick, Greg L .; Krikke, James J .; McCabe, Richard J .; Mustakis; Nanninga, Thomas N. (2004). „Vývoj škálovatelného procesu pro CI-1034, antagonistu endotelinu“. Výzkum a vývoj organických procesů. 8 (2): 201–212. doi:10.1021 / op034104g.CS1 maint: používá parametr autoři (odkaz)
- ^ Chinchilla, R .; Nájera, C. (2007). „Sonogashirova reakce: vzkvétající metodika syntetické organické chemie“. Chem. Rev. 107 (3): 874–922. doi:10.1021 / cr050992x. PMID 17305399.CS1 maint: používá parametr autoři (odkaz)

