Fosforečnan amonný - Ammonium phosphate
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC fosforečnan amonný | |
| Ostatní jména fosforečnan triamonný | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.030.709 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
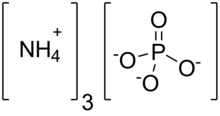
| (NH4)3PO4 | |
| Molární hmotnost | 149,09 g / mol |
| Vzhled | Bílý, čtyřboká krystaly |
| 58,0 g / 100 ml (25 ° C) | |
| Nebezpečí | |
| Piktogramy GHS |  |
| Signální slovo GHS | Varování |
| H302, H319 | |
| P264, P270, P280, P301 + 312, P305 + 351 + 338, P330, P337 + 313, P501 | |
| NFPA 704 (ohnivý diamant) | |
| Termochemie | |
Std entalpie of formace (ΔFH⦵298) | -1671,9 kJ / mol |
| Související sloučeniny | |
jiný kationty | Fosforečnan sodný Fosforečnan draselný |
Související sloučeniny | Fosforečnan diamonný Fosforečnan amonný |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
Fosforečnan amonný je amonium sůl kyseliny ortofosforečné. Je to velmi nestabilní sloučenina s vzorec (NH4)3PO4. Vzhledem ke své nestabilitě je nepolapitelný a nemá žádnou komerční hodnotu. Příbuzná "podvojná sůl" (NH4)3PO4.(NH4)2HPO4 je také uznáván, ale je příliš nestabilní pro praktické použití. Obě triamoniové soli uvolňují amoniak. Na rozdíl od nestabilní povahy triamoniových solí, fosforečnan diamonný (NH4)2HPO4 a monoamonná sůl (NH4) H2PO4 jsou stabilní materiály, které se běžně používají jako hnojiva k zajištění fixovaného dusíku a fosforu rostlinami.[2]
Příprava triammoniumfosfátu
Fosforečnan triamonný lze připravit v laboratoři zpracováním 85% kyseliny fosforečné 30% roztokem amoniaku:[Citace je zapotřebí ]
- H3PO4 + 3 NH3 → (NH4)3PO4
(NH4)3PO4 je bezbarvá krystalická pevná látka. Pevná látka, která má zápach amoniaku, je snadno rozpustná ve vodě. Sůl se přeměňuje na hydrogenfosforečnan diamonný (NH4)2HPO4.
Viz také
Reference
- ^ Lide, David R. (1998). Příručka chemie a fyziky (87 ed.). Boca Raton, Florida: CRC Press. s. 4–42, 5–19. ISBN 978-0-8493-0594-8.
- ^ Schrödter, Klaus; Bettermann, Gerhard; Staffel, Thomas; Wahl, Friedrich; Klein, Thomas; Hofmann, Thomas (2008). "Kyselina fosforečná a fosfáty". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002 / 14356007.a19_465.pub3.
| Tento anorganické sloučenina –Vztahující se článek je pahýl. Wikipedii můžete pomoci pomocí rozšiřovat to. |

