Bakterie navádějící nádor - Tumor-homing bacteria
Bakterie navádějící nádor je skupina fakultativní nebo povinné anaerobní bakterie (schopné produkovat ATP, když kyslík chybí nebo je zničen při normální hladině kyslíku), které jsou schopné cílit na rakovinné buňky v těle, potlačit růst nádorů a přežít v těle dlouhou dobu i po infekci. Když je tento typ bakterií podán do těla, migruje do rakovinných tkání a začne růst, poté zavede odlišné mechanismy ničení pevných nádorů. Každý druh bakterie používá jiný proces k eliminaci nádoru. Některé běžné bakterie navádějící nádor zahrnují Salmonella, Clostridium, Bifidobacterium, Listeria, a Streptococcus.[1] Nejstarší výzkum tohoto typu bakterií byl zdůrazněn v roce 1813, kdy vědci začali pozorovat, že pacienti to měli plynová gangréna, infekce způsobená bakteriemi Clostridium, mohli mít nádorové regrese.[2]
Mechanismy inhibice nádoru
Různé kmeny naváděcích bakterií v odlišných prostředích používají jedinečné nebo podobné procesy k inhibici nebo zničení růstu nádoru.
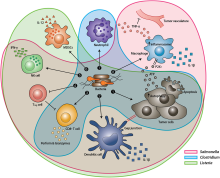
Unikátní mechanismy
- Salmonella bakterie ničí nádorové buňky nekontrolovaným množením bakterií, které může vést k prasknutí rakovinných buněk. Navíc makrofágy a dendritické buňky (typ bílých krvinek) v nich Salmonella-kolonizované nádory vylučují IL-1 p, protein zodpovědný za protinádorovou aktivitu.[3]
- S. Typhimurium flagellin zvyšuje obojí vrozený a adaptivní imunita (nespecifické a specifické obranné mechanismy) bakterií stimulací NK buňky (Buňky přirozeného zabíjení) k produkci interferonu-γ (IFN-γ), což je důležité cytokin (regulační protein) pro tuto imunitu.[1]
- Listeria inhibuje nádory skrz NADPH oxidáza zprostředkovaná produkce (nikotinamidadenin dinukleotid fosfát oxidáza) ROS (reaktivní formy kyslíku), což je buněčný signalizační proces, který se aktivuje CD8 + T buňky (buňky, které ničí rakovinovou tkáň), které se zaměřují na primární nádory.[4]
Podobné mechanismy
- Clostridium, S. Typhimurium, Listeria vyrobit exotoxiny (např. fosfolipázy, hemolysiny, lipázy ), které poškozují membránovou strukturu a buněčné funkce nádoru apoptóza nebo autofagie což je naprogramovaná buněčná smrt.[2]
- Salmonella, Clostridium, a Listeria infekce podporují eliminaci nádoru zvýšením cytokiny a chemokiny (regulační proteiny buněčné signalizace), které regulují infikované stránky pomocí granulocyty a cytotoxické lymfocyty (WBC které zabíjejí rakovinné buňky).[1]
Potvrzené lékařské ošetření
Terapie bakteriálními rakovinami je rozvíjející se oblastí léčby rakoviny. Ačkoli probíhá mnoho klinických studií, od nynějška se pacientům podává jen několik potvrzených léčení.
Léčba živými kmeny bakterií
- Využití živého oslabeného kmene Mycobacterium Bovis, také známý jako Bacillus Calmette-Guérin (BCG), je potvrzenou léčbou rakovina močového měchýře. Terapie BCG se provádí intravezikální instilací (podávání léku do močového měchýře pomocí katétru) a používá se od roku 1970 u pacientů s rakovinou.[5]
- Vzhledem k nekrotickým a hypoxickým oblastem nádorových buněk (oblast rezistence vůči léčbě) je dodávka léčiva chemoterapie může být narušen. Proto Salmonella lze kombinovat s chemoterapií k zajištění léčby a transportu jako Salmonella není těmito regiony ovlivněn. Navíc Salmonella počet mutantního kmene VNP20009 se z této kombinace zvýšil, což způsobuje další inhibici rakovinných buněk stimulací protinádorových proteinů.[6]
Léčba geneticky upravenými bakteriemi
Bakterie navádějící nádory mohou být geneticky upraveny tak, aby zvýšily jejich protinádorové aktivity, a mohou být použity k přepravě terapeutických materiálů na základě lékařských potřeb. Obvykle se transformují na plazmid který obsahuje specifickou genovou expresi těchto terapeutických proteinů bakterií. Poté, co plazmid dosáhne cílového místa, je exprimována genetická sekvence proteinu a bakterie mohou mít svůj plný biologický účinek. V současné době neexistuje žádná schválená léčba geneticky upravenými bakteriemi. Výzkum však probíhá Listeria a Clostridium jako vektory k přepravě RNAi (potlačuje geny) pro rakovina tlustého střeva.[7]
Bezpečnost léčby bakteriální rakoviny
Některé aktivní bakterie zaměřující se na nádor mohou být pro lidské tělo škodlivé, protože produkují toxiny, které narušují buněčný cyklus což vede ke změně buněčného růstu a chronickým infekcím. Bylo však nalezeno mnoho způsobů, jak zvýšit bezpečnost bakterií navádějících nádor v těle. Například když jsou virulentní geny bakterií odstraněny pomocí genové cílení, proces, při kterém jsou geny odstraněny nebo upraveny, může být redukován patogenita (vlastnost způsobující nemoc).
Nepříznivé účinky
- Mutace DNA bakterií v těle, které navádějí nádor, může vést k problémům, jako je extrémní infekce a selhání terapie, protože exprimované geny se budou lišit a způsobí nefunkčnost bakterií.
- Neúplný nádor lýza nebo kolonizace bakteriemi může vést ke zpožděné léčbě a bude vyžadovat použití jiných způsobů léčby rakoviny, jako je chemoterapie nebo jejich kombinace. Zpožděná nebo kombinovaná léčba má na tělo mnoho účinků, jako je zvracení, nevolnost, ztráta chuti k jídlu, únava a vypadávání vlasů.[8]
Prevence nežádoucích účinků
- Mazání msbB gen z Salmonella genetickým inženýrstvím vede ke ztrátě lipid A (lipid odpovědný za hladiny toxicity gramnegativní bakterie ), a proto snižuje toxicitu Salmonella 10 000krát.[9]
- Generování auxotrofní mutanti (kmen mikroorganismů, které se budou množit pouze tehdy, když je médium doplněno nějakou konkrétní látkou), které se nemohou efektivně replikovat v prostředí, kde je určitá živina požadovaná mutantním kmenem vzácná. Salmonella A1-R představuje takový kmen, který je pro aminokyseliny auxotrofní leucin a arginin které jsou obohaceny v nádoru, ale ne v normálních tkáních. Proto v nádoru Salmonella A1-R poroste, ale ne v normálních tkáních, čímž zabráníte infekcím a zvýšíte bezpečnost.[2]
Výzkum
Nejvíce zkoumané bakterie pro léčbu rakoviny jsou Salmonella, Listérie, a Clostridium. Geneticky upravený kmen kmene Salmonella (TAPET-CD) dokončila klinické studie fáze 1 u pacientů s metastatickým karcinomem 4. stupně.[10]Listériev současné době se vyrábějí vakcíny proti rakovině založené na vakcínách, které procházejí mnoha klinickými testy.[11] Fáze I zkoušek Clostridium kmen volal Clostridium novyi (C. novyi-NT) u pacientů s tumory rezistentními na léčbu nebo tumory, které na léčbu nereagují, v současné době probíhá.[12]
Viz také
Reference
- ^ A b C Duong, Mai Thi-Quynh; Qin, Yeshan; Ty, Sung-Hwan; Min, Jung-Joon (prosinec 2019). „Interakce bakterie s rakovinou: léčba rakoviny založená na bakteriích“. Experimentální a molekulární medicína. 51 (12): 1–15. doi:10.1038 / s12276-019-0297-0. ISSN 2092-6413. PMC 6906302. PMID 31827064. S2CID 209169333.
- ^ A b C Zhou, Shibin; Gravekamp, Claudia; Bermudes, David; Liu, Ke (prosinec 2018). „Bakterie zaměřené na nádor navržené pro boj s rakovinou“. Recenze přírody. Rakovina. 18 (12): 727–743. doi:10.1038 / s41568-018-0070-z. ISSN 1474-175X. PMC 6902869. PMID 30405213.
- ^ Kim, Jung-Eun; Phan, Thuy Xuan; Nguyen, Vu Hong; Dinh-Vu, Hong-Van; Zheng, Jin Hai; Yun, Misun; Park, Sung-Gyoo; Hong, Yeongjin; Choy, Hyon E .; Szardenings, Michael; Hwang, Won (2015). „Salmonella typhimurium potlačuje růst nádorů prostřednictvím prozánětlivého cytokinu interleukinu-1β“. Theranostics. 5 (12): 1328–1342. doi:10,7150 / tis. 11322. ISSN 1838-7640. PMC 4615736. PMID 26516371.
- ^ Kim, Sun Hee; Castro, Francisco; Paterson, Yvonne; Gravekamp, Claudia (2009-07-15). „Vysoká účinnost vakcíny proti listové rakovině proti listové listerii odhaluje dvojí způsob působení“. Výzkum rakoviny. 69 (14): 5860–5866. doi:10.1158 / 0008-5472.CAN-08-4855. ISSN 0008-5472. PMC 3127451. PMID 19584282.
- ^ Torres, Wheeler; Lameda, Víctor; Olivar, Luis Carlos; Navarro, Carla; Fuenmayor, Jorge; Pérez, Adrián; Mindiola, Andres; Rojas, Milagros; Martínez, María Sofía; Velasco, Manuel; Rojas, Joselyn (2018-01-24). „Bakterie v léčbě rakoviny: po imunostimulaci“. Journal of Cancer Metastasis and Treatment. 4: 4. doi:10.20517/2394-4722.2017.49. ISSN 2394-4722.
- ^ Mi, Ze; Feng, Zhi-Chao; Li, Cheng; Yang, Xiao; Ma, Meng-Tian; Rong, Peng-Fei (2019-08-20). „Terapie rakoviny zprostředkovaná salmonelou: inovativní terapeutická strategie“. Journal of Cancer. 10 (20): 4765–4776. doi:10,7150 / jca.32650. ISSN 1837-9664. PMC 6775532. PMID 31598148.
- ^ Chien, Tiffany; Doshi, Anjali; Danino, Tal (říjen 2017). „Pokroky v léčbě bakteriálních rakovin pomocí syntetické biologie“. Aktuální názor na systémovou biologii. 5: 1–8. doi:10.1016 / j.coisb.2017.05.009. ISSN 2452-3100. PMC 5986102. PMID 29881788.
- ^ Patyar, S; Joshi, R; Byrav, DS Prasad; Prakash, A; Medhi, B; Das, BK (2010-03-23). „Bakterie v terapii rakoviny: nová experimentální strategie“. Journal of Biomedical Science. 17 (1): 21. doi:10.1186/1423-0127-17-21. ISSN 1021-7770. PMC 2854109. PMID 20331869.
- ^ Toso, John F .; Gill, Vee J .; Hwu, Patrick; Marincola, Francesco M .; Restifo, Nicholas P .; Schwartzentruber, Douglas J .; Sherry, Richard M .; Topalian, Suzanne L .; Yang, James C .; Stock, Frida; Freezer, Linda J. (01.01.2002). „Fáze I Studie intravenózního podání oslabeného Salmonella typhimurium pacientům s metastatickým melanomem“. Journal of Clinical Oncology. 20 (1): 142–152. doi:10.1200 / JCO.2002.20.1.142. ISSN 0732-183X. PMC 2064865. PMID 11773163.
- ^ Cunningham, C .; Nemunaitis, J. (10. 8. 2001). „Studie fáze I s geneticky modifikovanou Salmonella typhimurium exprimující cytosindeaminázu (TAPET-CD, VNP20029) podávaná intratumorální injekcí v kombinaci s 5-fluorcytosinem pro pacienty s pokročilým nebo metastazujícím karcinomem. Protokol č. CL-017. 2001 ". Lidská genová terapie. 12 (12): 1594–1596. ISSN 1043-0342. PMID 11529249.
- ^ Flickinger, John C .; Rodeck, Ulrich; Snook, Adam E. (2018-07-25). „Listeria monocytogenes jako vektor pro imunoterapii rakoviny: současné porozumění a pokrok“. Vakcíny. 6 (3): 48. doi:10,3390 / vakcíny6030048. ISSN 2076-393X. PMC 6160973. PMID 30044426.
- ^ Staedtke, Verena; Roberts, Nicholas J .; Bai, Ren-Yuan; Zhou, Shibin (06.02.2016). "Clostridium novyi-NT v léčbě rakoviny". Geny a nemoci. 3 (2): 144–152. doi:10.1016 / j.gendis.2016.01.003. ISSN 2352-4820. PMC 6150096. PMID 30258882.
