Stieglitzův přesmyk - Stieglitz rearrangement
| Stieglitzův přesmyk | |
|---|---|
| Pojmenoval podle | Julius Stieglitz |
| Typ reakce | Reakce přesmyku |
| Příklady a související reakce | |
| Podobné reakce | Beckmann přesmyk |
The Stieglitzův přesmyk je přesmyková reakce v organická chemie který je pojmenován po americkém chemikovi Julius Stieglitz (1867 - 1937) a byl poprvé vyšetřován jím a Paulem Nicholasem Leechem v roce 1913.[1] Popisuje to 1,2-přeskupení z trityl amin deriváty na triaryl imines.[1][2] Je to srovnatelné s a Beckmann přesmyk což také zahrnuje substituci na atomu dusíku posunem uhlíku na dusík.[3] Například triarylhydroxylaminy mohou projít Stieglitzovým přesmykem dehydratací a posunem fenylová skupina po aktivaci pomocí chlorid fosforečný poskytnout příslušnou triaryl já těžím, a Schiffova základna.[4][5]

Obecně se termín „Stieglitzův přesmyk“ používá k popisu široké škály přesmykových reakcí aminy na imines.[4] I když, to je obecně spojeno s přeskupením triaryl hydroxylaminy, které jsou v akademické literatuře dobře popsány, se Stieglitzovy přesmyky mohou vyskytovat také na alkylovaný amin deriváty,[6] haloaminy[7][8] a azidy[9][10] stejně jako další aktivované amin deriváty.[4]

Reakční mechanismus přesmyku Stieglitz a použité produkty a výchozí materiály ho úzce souvisí s Beckmann přesmyk, které lze použít pro syntézu karboxamidy.[11] Obě přesmykové reakce zahrnují posun uhlíku na dusík, obvykle po elektrofilní aktivaci odstupující skupiny na atomu dusíku.[4][12][13] Hlavním rozdílem výchozích materiálů je však stupeň jejich nasycení. Zatímco Stieglitzův přesmyk probíhá nasyceně amin deriváty s jednoduchou vazbou σ, je typickým výchozím materiálem pro Beckmannovu přesmyk an oxim (hydroxylimin) s C = N-dvojnou vazbou.[4][14] V Beckmannově přesmyku probíhá na uhlí migrace uhlíku na dusík oxim výtěžek a nitrilový ion středně pokročilí.[15] V zásadě probíhá první krok Stieglitzova přesmyku analogickým způsobem.[4] Avšak po generaci kladně nabitých iminiový ion prostřednictvím interakce π mezi dvojicí osamělého dusíku a uhlíkem s nedostatkem elektronů ve Stieglitzově přesmyku se dráhy rozcházejí. Ve Stieglitzově přesmyku lze nábojově neutrální stav molekuly dosáhnout disociací protonu. Alternativně, pokud výchozí materiál neobsahuje žádné aminoprotony, neutrálního stavu lze dosáhnout externím redukčním činidlem, jako je například borohydrid sodný. Snižuje to iminiový ion meziprodukt na odpovídající nasycený amin.[4][16] V Beckmannově přesmyku takový proton také chybí a stabilizace meziproduktu probíhá prostřednictvím nukleofilní adice molekuly vody, disociace protonu a tautomerismu z kyselina imidová do karboxamid.[17]

Variace
Ačkoli původní Stieglitzova reakce je nejlépe známá pro přeskupení tritylhydroxylaminů, existuje několik variant, které zahrnují dobře odstupující skupiny jako N-substituenty (jako jsou halogeny a sulfonáty). Obvykle se používají různá činidla, v závislosti na přesné povaze substrátu.[4]
Stieglitzův přesmyk N-hydroxylované aminy, N-alkoxylované aminy a N-sulfonované aminy
Stieglitzův přesmyk N-hydroxylované aminy
Pro přeskupení tritylhydroxylaminů Lewisovy kyseliny, jako je chlorid fosforečný (PCl5) , oxid fosforečný (P2Ó5) nebo fluorid boritý (BF3) může být použito.[4] Fungují jako elektrofilní aktivátory pro hydroxylová skupina zvýšením kvality odstupující skupiny. Například při použití PCl5 jako činidlo se tritylhydroxylamin nejdříve transformuje na aktivovaný meziprodukt prostřednictvím nukleofilní substituce.[18] Vytvořený meziprodukt pak může projít přesmykem migrací fenylová skupina a disociace fosforu (V) za vzniku N-fenylbenzofenoniminu.[18]

Stieglitzův přesmyk N-alkoxylované aminy
Navíc k N-hydroxytrityl aminy, přesmyky v N-alkoxytrityl aminy jsou také možné. Tyto reakce jsou však známé pro své skutečně nízké výtěžky.[19] Například, N-benzyloxy substituovaný tritylamin může podstoupit Stieglitzův přesmyk v přítomnosti chloridu fosforečného (160 ° C, 40% výtěžek) nebo s BF3 jako činidlo (60 ° C, 29% výtěžek).[20] V druhém případě BF3 působí při elektrofilní aktivaci benzylového kyslíku jako Lewisova kyselina, což umožňuje nukleofilní útok na sousední atom dusíku.[20]

Stieglitzův přesmyk N-sulfonované aminy
Stieglitzovy přesmyky také snadno pokračují s aktivními sulfonáty jako odstupující skupinou.[21] N-sulfonované aminy lze získat z příslušných hydroxylaminů a vhodných sulfonačních činidel. Například Herderin et al. syntetizovaly svůj sekundární hydroxylamin (výchozí materiál v přesmyku zobrazeném níže) podrobením příslušného hydroxylaminu tosylchlorid a hydroxid sodný v acetonitril.[22]
Stieglitzův přesmyk je zvláště reaktivní v případě přemostěného bicyklu N-sulfonované aminy jako výchozí látky, kde jsou dostatečné mírné podmínky pro účinnou reakci.[23] Například přesmyk bicyklické N-tosylovaný amin snadno probíhá ve vodném dioxanu při teplotě místnosti.[24] Příslušný imin se však v tomto případě netvoří, pravděpodobně kvůli napětí, které by takovou strukturu termodynamicky znevýhodňovalo, nesoucí dvojnou vazbu na atomu předmostí (Bredtova vláda ).[25] Místo toho se tosylát nukleofilně přidává v geminální poloze dusíku útokem na iminiový iont.[22]
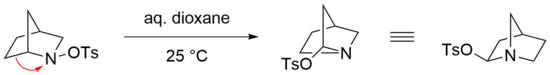
Stieglitzův přesmyk azidů
Stieglitzovy přesmyky mohou probíhat také na organickém azidy s molekulárním dusíkem jako dobrou odstupující skupinou.[4] Tyto reakce probíhají srovnatelně s kroky Schmidtova reakce, kterým se karboxylové kyseliny mohou přeměnit na aminy přidáním kyselina hydrazoová za kyselých vodných podmínek.[26]Stieglitzův přesmyk azidů obecně těží z protonické[16] nebo termální[4] aktivace, kterou lze také kombinovat.[10] V obou případech se molekulární dusík v nevratném kroku uvolní jako plyn. Bylo navrženo, že přesmyk po disociaci N2 molekula, postupuje přes reaktivní nitren středně pokročilí.[10] Tyto meziprodukty by byly velmi podobné těm, které byly navrženy jako klíčové meziprodukty v přeskupovacích reakcích pojmenovaných po Hofmann a Curtius,[27] ale od té doby byly považovány za nepravděpodobné.[28]Když je azid podroben Bronstedově kyselině, protonace azidu aktivuje bazální dusík a snižuje pevnost vazby k sousednímu, takže je usnadněna disociace a vyloučení molekulárního dusíku.[16] Po přeskupení může proton disociovat od iminiového iontu za vzniku iminu.
Alternativním způsobem výroby protonovaných organických azidů je nuklofilní přidání kyseliny hydrazoové do karbokationtů, které pak mohou také podstoupit Stieglitzovy přesmyky.[16]
Stieglitzův přesmyk N-halogenované aminy
Stieglitzův přesmyk N-halogenované aminy lze pozorovat pro chlor[7] a brom[8] substituované aminy, často v kombinaci s organickou bází, jako je methoxid sodný.[4] Potřeba báze je obecně spojena s potřebou deprotonace aminu.[4]
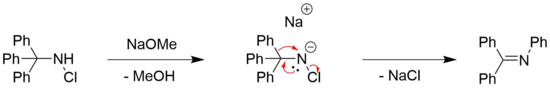
Byly však také hlášeny příklady Stieglitzových přesmyků bez základny N-halogenované aminy. Jako příklad lze uvést celkovou syntézu (±) -lykopodinu pomocí Paul Grieco et al.[6][29] Tam dochází ke vzniku kruhu přesmykem na sekundárním haloaminu jeho vystavením tetrafluoroborátu stříbrnému.[6] AgBF4 je známo, že působí jako zdroj Ag+ionty, které mohou usnadnit disociaci halogenidů z organických molekul, přičemž hnací silou je tvorba příslušného halogenidu stříbrného.[30] Požadovaný produkt se poté získá redukcí s kyanoborohydrid sodný mírné redukční činidlo, které se běžně používá při redukci iminů na aminy.[31]

Stieglitzův přesmyk aminů aktivovaných tetraacetátem olovnatým
Bylo také zjištěno, že přidání tetraacetát olovnatý může usnadnit Stieglitzův přesmyk aminových derivátů.[32] Po vytvoření meziproduktu aktivovaného aminového derivátu koordinací s centrem olova pokračuje následující přesmyk migrací aromatické skupiny za vzniku vazby C-N, disociací olova a deprotonací výsledného iminiového iontu.[33]
Viz také
Reference
- ^ A b Julius Stieglitz, Paul Nicholas Leech (1914). „Molekulární přesmyk triarylmethyl-hydroxylaminů a Beckmannův přesmyk ketoximů“. Journal of the American Chemical Society. 36 (2): 272–301. doi:10.1021 / ja02179a008.
- ^ Bert Allen Stagner (1914). „Molekulární přesmyk triarylmethyl-hydroxylaminů“. Journal of the American Chemical Society. 36 (2): 2069–2081. doi:10.1021 / ja02267a018.
- ^ Wang, Zerong (2010). Komplexní organické názvové reakce a činidla. John Wiley & Sons, Inc., str. 288–295. ISBN 9780471704508.
- ^ A b C d E F G h i j k l m Wang, Zerong (září 2010). Komplexní organické názvové reakce a činidla. John Wiley. 2673–2676. ISBN 9780471704508.
- ^ IUPAC, Kompendium chemické terminologie, 2. vyd. („Zlatá kniha“) (1997). Online opravená verze: (2006–) “Schiffova základna ". doi:10.1351 / goldbook.S05498
- ^ A b C Grieco, Paul A .; Dai, Yujia (květen 1998). „Konstrukce karbocyklického kruhu prostřednictvím intramolekulární Diels-Alderovy reakce in situ generovaného, heteroatomem stabilizovaného allylového kationu: Celková syntéza (±)-lykopodinu“. Journal of the American Chemical Society. 120 (20): 5128–5129. doi:10.1021 / ja980117b.
- ^ A b Vosburgh, Isabella (říjen 1916). „Molekulární přesmyk trifenyl-methylhalogenaminů“. Journal of the American Chemical Society. 38 (10): 2081–2095. doi:10.1021 / ja02267a019.
- ^ A b DeTar, DeLos F .; Broderick, Edward; Foster, George; Hilton, Benjamin D. (květen 1950). "Pokus o přeskupení 9-brommethylenefluorenu na 9-bromfenanthren". Journal of the American Chemical Society. 72 (5): 2183–2184. doi:10.1021 / ja01161a086.
- ^ Morgan, Agnes Fay (říjen 1916). „Molekulární přesmyky některých triaryl-methylchloroaminů“. Journal of the American Chemical Society. 38 (10): 2095–2101. doi:10.1021 / ja02267a020.
- ^ A b C Kuhn, James (prosinec 1916). "Molekulární přesmyk triarylmethylazidů". Journal of the American Chemical Society. 38 (12): 2718–2726. doi:10.1021 / ja02269a014.
- ^ Blatt, A. H. (duben 1933). „Beckmannův přesmyk“. Chemické recenze. 12 (2): 215–260. doi:10.1021 / cr60042a002.
- ^ Taber, Douglass F .; Straney, Patrick J. (prosinec 2010). „Syntéza laurolaktamu z cyklododekanonu prostřednictvím Beckmannova přesmyku“. Journal of Chemical Education. 87 (12): 1392. doi:10.1021 / ed100599q.
- ^ Furuya, Yoshiro; Ishihara, Kazuaki; Yamamoto, Hisashi (srpen 2005). „Chlorid kyanurový jako mírný a aktivní Beckmannův přesmykový katalyzátor“. Journal of the American Chemical Society. 127 (32): 11240–11241. doi:10.1021 / ja053441x. PMID 16089442.
- ^ Guy Donaruma, L .; Heldt, Walter Z. (2011). „Organic Reactions: The Beckmann Rearrangment“: 1–59. doi:10.1002 / 0471264180.nebo011.01. Citovat deník vyžaduje
| deník =(Pomoc) - ^ van Dijk, Tom; Chris Slootweg, J .; Lammertsma, Koop (2017). "Nitrilové ionty - syntéza a aplikace". Organická a biomolekulární chemie. 15 (48): 10134–10144. doi:10.1039 / C7OB02533E. PMID 29188244.
- ^ A b C d Pearson, William H. (září 1996). "Alifatické azidy jako lewisové báze. Aplikace na syntézu heterocyklických sloučenin". Journal of Heterocyclic Chemistry. 33 (5): 1489–1496. doi:10,1002 / jhet. 5570330506. hdl:2027.42/96395.
- ^ Clayden, Jonathan; Greeves, Nick; Warren, Stuart (2012). Organická chemie (2. vyd.). Oxford University Press. str. 958. ISBN 978-0-19-927029-3.
- ^ A b Li, Jie Jack (2003). Název reakce: Soubor podrobných reakčních mechanismů (2. vyd.). Springer. str. 361. ISBN 978-3-662-05338-6.
- ^ Metzger, Karl Horst; Müller, Peter; Müller-Dolezal, Heidi; Schwall, Horst; Söll, Hanna (2014). Houben-Weyl Methods of Organic Chemistry Vol. X / 1, 4. vydání: Nitro, Nitroso a Hydroxylamine Compounds (4. vyd.). Georg Thieme Verlag. str. 1266. ISBN 9783131805546.
- ^ A b Ayres, Erle B .; Hauser, Charles R. (leden 1948). "Přeskupení N-Trifenylmethyl-O-benzylhydroxylamin prostředkem amidu draselného fluoridu boritého ". The Journal of Organic Chemistry. 13 (1): 116–119. doi:10.1021 / jo01159a015. PMID 18917716.
- ^ Pearson, William H .; Schkeryantz, Jeffrey M. (září 1992). „Intramolekulární, Schmidtova reakce alkylazidu s karbokací. Tvorba a přeskupení konformačně omezeného sekundárního aminodiazoniového iontu“. Čtyřstěn dopisy. 33 (37): 5291–5294. doi:10.1016 / s0040-4039 (00) 79075-7. hdl:2027.42/29850.
- ^ A b Heesing, A .; Herdering, W. (leden 1981). „Sauerstoff-insertion bei der umlagerung von 2-aza-bicyklo [2.2.1] hept-2-enderivaten“. Čtyřstěn dopisy. 22 (47): 4675–4678. doi:10.1016 / s0040-4039 (01) 83010-0.
- ^ Renslo, Adam R .; Danheiser, Rick L. (říjen 1998). "Syntéza substituovaných pyridinů prostřednictvím regiováno [4 + 2] cykloadice oximinosulfonátů". The Journal of Organic Chemistry. 63 (22): 7840–7850. doi:10.1021 / jo981014e.
- ^ Gassman, Paul G .; Hartman, George D. (leden 1973). "Chemistry of nitrenium ions. XXVII. Leaving group efficient in the generation of nitrenium ionts from hydroxylamine derivates". Journal of the American Chemical Society. 95 (2): 449–454. doi:10.1021 / ja00783a023.
- ^ Fawcett, Frank S. (říjen 1950). „Bredtovo pravidlo dvojných dluhopisů ve strukturách atomových můstků“. Chemické recenze. 47 (2): 219–274. doi:10.1021 / cr60147a003. PMID 24538877.
- ^ Wolff, Hans (2011). Organické reakce. John Wiley and Sons, Inc., str. 307–336. doi:10.1002 / 0471264180.nebo003.08.
- ^ Ghosh, Arun K .; Sarkar, Anindya; Brindisi, Margherita (2018). „Curtiusovo přeskupení: mechanický pohled a nedávné aplikace v syntéze přírodních produktů“. Organická a biomolekulární chemie. 16 (12): 2006–2027. doi:10.1039 / c8ob00138c. PMC 5864567. PMID 29479624.
- ^ Rauk, Arvi; Alewood, Paul F. (1. května 1977). "Teoretická studie Curtiova přesmyku. Elektronické struktury a přeměny druhů CHNO." Canadian Journal of Chemistry. 55 (9): 1498–1510. doi:10.1139 / v77-209.
- ^ Hager, Anastasia; Vrielink, Nina; Hager, Dominik; Lefranc, Julien; Trauner, Dirk (2016). „Syntetické přístupy k alkaloidům nesoucím α-terciární aminy“. Zprávy o přírodních produktech. 33 (3): 491–522. doi:10.1039 / c5np00096c. PMID 26621771.
- ^ Achilonu, Matthew Chilaka; Umesiobi, Dennis O. (listopad 2016). „Tvorba vazeb uhlík-uhlík a uhlík-heteroatom za použití tetrafluoroboritanu stříbrného jako promotoru“. Arabian Journal of Chemistry. 9: 1984–2003. doi:10.1016 / j.arabjc.2015.06.038.
- ^ Christen, Hans; Meyer, Gerd (1997). Grundlagen der allgemeinen und anorganischen Chemie (1. vyd.). Salle + Sauerländer. str. 824. ISBN 978-3-7935-5493-6.
- ^ Sisti, Anthony Joseph (1968). "Reakce tetraacetátu olovnatého s fenylmethylaminy". Chemical Communications (Londýn) (21): 1272. doi:10.1039 / C19680001272.
- ^ Sisti, Anthony J .; Milstein, Stanley R. (prosinec 1974). "Stieglitzův přesmyk s tetraacetátem olovnatým a triarylmethylaminy". The Journal of Organic Chemistry. 39 (26): 3932–3936. doi:10.1021 / jo00940a030.
