Schwartzovo činidlo - Schwartzs reagent - Wikipedia
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC chloridobis (η5-cyklopentadienyl) hydridozirkonium | |||
| Ostatní jména Str2ZrClH, hydrid zirkonocenchloridu | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.048.599 | ||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C10H11ClZr | |||
| Molární hmotnost | 257,87 g / mol | ||
| Vzhled | Bílá pevná látka | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Schwartzovo činidlo je obecný název pro organozirkoniová sloučenina s vzorec (C5H5)2ZrHCl, někdy nazývaný zirkonocen hydrochlorid nebo zirkonocen chlorid hydrid, a je pojmenována po Jeffrey Schwartzovi, profesorovi chemie na Univerzita Princeton. Tento metalocen se používá v organická syntéza pro různé transformace alkeny a alkyny.[1]
Příprava
Komplex nejprve připravili v surové formě Wailes a Weigold.[2] Lze jej zakoupit nebo snadno připravit snížením o chlorid zirkonocen s lithiumaluminiumhydrid:
- (C5H5)2ZrCl2 + 1⁄4 LiAlH4 → (C.5H5)2ZrHCl +1⁄4 LiAlCl4
V praxi tato reakce také poskytuje (C.5H5)2ZrH2, který je ošetřen methylenchlorid čímž se získá směsný hydrid chlorid.[3] Byl také popsán alternativní postup, který generoval Schwartzovo činidlo z dihydridu.[4]
Struktura
Dimetalická struktura byla potvrzena MicroED.[5] Výsledky jsou v souladu s FT-IR spektroskopie, který prokázal, že hydridy jsou přemostěny. NMR v pevné fázi spektroskopie také indikuje dimerní strukturu. Rentgenová krystalografická struktura pro methylovou sloučeninu (C.5H5)4Zr2H2(CH3)2 sloučenina je analogická.[6]
Využití v organické syntéze
Schwartzovo činidlo lze použít pro řadu reakcí. Ukázalo se, že jej lze použít ke snížení amidy na aldehydy. Redukce terciárních amidů Schwartzovým činidlem může dosáhnout účinných výtěžků, ale primární a sekundární amidy budou vykazovat snížené výtěžky. Použití Schwartzova činidla tímto způsobem nebude vyžadovat žádné přidané teplo a lze ho provést rychle a bez redukce alkohol forma není problematická vedlejší reakce, jak to může být u jiných redukční činidla. Schwartzovo činidlo selektivně redukuje amid v jakékoli snadno redukovatelné formě estery které mohou být přítomny v reakční směsi.[7]
Vinylace ketony ve vysokých výtěžcích je možné použití Schwartzova činidla.[8]
Schwartzovo činidlo se používá při syntéze některých makrolidová antibiotika,[9][10] (-) - motuporin,[11] a protinádorové látky.[12]
Hydrozirkonace
Hydrozirkonace je forma hydrometalace. Substráty pro hydrozirkonaci jsou alkeny a alkyny. S koncovými alkyny se tvoří převážně koncový vinylzirkoniový produkt. Sekundární reakce jsou nukleofilní adice, transmetalace,[13] konjugované dodatky,[14] vazebné reakce, karbonylace a halogenace.
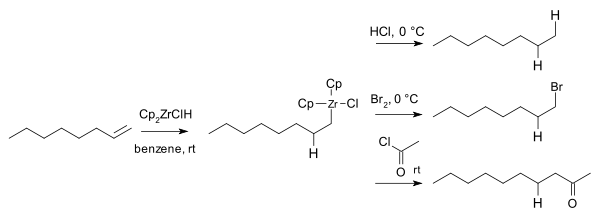
Výpočtové studie naznačují, že z vnitřní části dochází k hydrozirkonaci.[15][16]Při léčbě jedním ekvivalentem Cp2ZrClH, difenylacetylen dává odpovídající alkenylzirkonium jako směs cis a trans izomery. Se dvěma ekvivalenty hydridu byl konečný produkt směsí erythro a threo zirkonové alkany:
V roce 1974 Hart a Schwartz uvedli, že organozirkoniové meziprodukty reagují s elektrofily jako kyselina chlorovodíková, bróm a chloridy kyselin dát odpovídající alkanu, bromalkany, a ketony:[17]
Korespondence organoboron a organohliník sloučeniny již byly známy, ale jsou citlivé na vzduch a / nebo samozápalný zatímco sloučeniny organozirkonia nejsou.
Rozsah
V jedné studii obvyklé regioselektivita alkynová hydrozirkonace je obrácena přidáním chlorid zinečnatý:[18][19]
Jeden příklad a jeden hrnec hydrozirkonace - karbonylace - vazba je znázorněna níže:[20][21]
S jistotou allylalkoholy, alkohol skupina je nahrazena nukleofilním uhlíkem tvořícím a cyklopropan prsten:[22] Podrobně byla studována selektivita hydrozirkonace alkynů.[23][24] Obecně platí, že přidání Zr – H probíhá prostřednictvím syn-přidání. Rychlost přidání k nenasyceným vazbám uhlík-uhlík je terminální alkiny> terminální alken ≈ interní alkiny> disubstituovaný alken [25] Acyl komplexy lze generovat vložením CO do vazby C – Zr, která je výsledkem hydrozirkonace.[26] Po vložení alkenu do vazby zirkoniumhydridu výsledný alkyl zirkonia podléhá snadnému přeskupení na koncový alkyl, a proto lze tímto způsobem syntetizovat pouze koncové acylové sloučeniny. Přesmyk s největší pravděpodobností probíhá prostřednictvím eliminace β-hydridu a následného opětovného vložení.
Další čtení
- Hart, D. W .; Schwartz, J. (1974). "Hydrozirkonace. Organická syntéza prostřednictvím organozirkoniových meziproduktů. Syntéza a přesmyk komplexů alkylzirkonia (IV) a jejich reakce s elektrofily". J. Am. Chem. Soc. 96 (26): 8115–8116. doi:10.1021 / ja00833a048.
- Schwartz, J .; Labinger, J. A. (2003). „Hydrozirconation: a New Transition Metal Reagent for Organic Synthesis“. Angew. Chem. Int. Vyd. 15 (6): 330–340. doi:10,1002 / anie.197603331.
- Hart, Donald W .; Blackburn, Thomas F .; Schwartz, Jeffrey (1975). "Hydrozirconation. III. Stereospecifická a regioselektivní funkcionalizace alkylacetylenů prostřednictvím vinylzirkonia (IV) meziprodukty". J. Am. Chem. Soc. 97 (3): 679–680. doi:10.1021 / ja00836a056.
Reference
- ^ Pinheiro, Danielle L. J .; De Castro, Pedro P .; Amarante, Giovanni W. (2018). „Nedávný vývoj a syntetické aplikace nukleofilních zirkonocenových komplexů ze Schwartzova činidla“. European Journal of Organic Chemistry. 2018 (35): 4828–4844. doi:10.1002 / ejoc.201800852.
- ^ Wailes, P. C .; Weigold, H. (1970). "Hydrido komplexy zirkonia I. Příprava". J. Organomet. Chem. 24 (2): 405–411. doi:10.1016 / S0022-328X (00) 80281-8.
- ^ Buchwald, S.L .; LaMaire, S. J .; Nielsen, R. B .; Watson, B. T .; King, S. M. „Schwartzovo činidlo“. Organické syntézy.; Kolektivní objem, 9, str. 162
- ^ Wipf, Peter; Takahashi, Hidenori; Zhuang, Nian (1998). „Kinetická vs. termodynamická regulace v hydrozirkonačních reakcích“ (PDF). Pure Appl. Chem. 70 (5): 1077–1082. doi:10.1351 / pac199870051077.
- ^ Jones, Christopher G .; Asay, Matthew; Kim, Lee Joon; Kleinsasser, Jack F .; Saha, Ambarneil; Fulton, Tyler J .; Berkley, Kevin R .; Cascio, Duilio; Malyutin, Andrey G .; Conley, Matthew P .; Stoltz, Brian M .; Lavallo, Vincent; Rodríguez, José A .; Nelson, Hosea M. (6. září 2019). "Charakterizace reaktivních organokovových druhů pomocí MicroED". ACS Central Science. 5 (9): 1507–1513. doi:10,1021 / acscentsci.9b00403. PMC 6764211. PMID 31572777.
- ^ Rossini, A. J .; Mills, R. W .; Briscoe, G. A .; Norton, E. L .; Geier, S. J .; Hung, I .; Zheng, S .; Autschbach, J .; Schurko, R. W. (2009). „Chlor v pevné fázi NMR skupiny IV přechodných kovových organokovových komplexů“. Journal of the American Chemical Society. 131 (9): 3317–3330. doi:10.1021 / ja808390a. PMID 19256569.
- ^ Leighty, M. W .; Spletstoser, J. T .; Georg, Gunda I. (2011). "Mírná přeměna terciárních amidů na aldehydy pomocí Cp2ZrHCl (Schwartzovo činidlo) ". Org. Synth. 88: 427–437. doi:10.1002 / 0471264229.os088.39. ISBN 978-0471264224.
- ^ Li, H .; Walsh, P. J. (2005). "Katalytická asymetrická vinylace a dienylace ketonů". J. Am. Chem. Soc. 127 (23): 8355–8361. doi:10.1021 / ja0425740. PMID 15941269.
- ^ Duffey, Matthew O .; Le Tiran, Arnaud; Morken, James P. (2003). "Enantioselektivní celková syntéza borrelidinu". J. Am. Chem. Soc. 125 (6): 1458–1459. doi:10.1021 / ja028941u. PMID 12568588.
- ^ Wu, J .; Panek, J. S. (2011). "Celková syntéza (-) - Virginiamycin M2: Aplikace krotylsilanů přístupných enantioselektivním Rh (II) nebo Cu (I) karbenoidovým vložením Si – H “. J. Org. Chem. 76 (24): 9900–9918. doi:10.1021 / jo202119p. PMID 22070230.
- ^ Hu, T .; Panek, J. S. (1999). "Celková syntéza (-) - motuporinu". J. Org. Chem. 64 (9): 3000–3001. doi:10.1021 / jo9904617. PMID 11674393.
- ^ Nicolaou, K. C .; et al. (2003). "Celková syntéza apoptolidinu: dokončení syntézy a analogické syntézy a hodnocení". J. Am. Chem. Soc. 125: 15443–15454. doi:10.1021 / ja030496v. PMID 14664590.
- ^ „Allylalkoholy přenosem alkenu ze zirkonia na zinek: 1 - [(terc-butyldifenylsilyl) oxy] -dec-3-en-5-ol". Organické syntézy. 9 (74): 205. 1998. Citováno 2013-03-23.
Organic Syntheses, Coll. Sv. 9, str. 143 (1998); Sv. 74, str. 205 (1997).
- ^ Přidání konjugátu vinylzirkoniového činidla: 3- (1-okten-1-yl) cyklopentanon, Organické syntézy, Sb. Sv. 9, str. 640 (1998); Sv. 71, str. 83 (1993).
- ^ Pankratyev, E. Y .; Tyumkina, T. V .; Parfenova, L. V .; Khursan, S.L .; Khalilov, L. M .; Dzhemilev, U. M. (2011). "DFT a Ab Initio Study on Mechanism of Olefin Hydroalumination by XAlBui2 v přítomnosti Cp2ZrCl2 Katalyzátor. II. (1) Interakce olefinů s katalyticky aktivními centry “. Organometallics. 30 (22): 6078–6089. doi:10.1021 / om200518h.
- ^ Wang, Juping; Xu, Huiying; Gao, Hui; Su, Cheng-Yong; Zhao, Cunyuan; Phillips, David Lee (2010). „Studie DFT o mechanismu amidů aldehydů pomocí Cp2Zr (H) Cl ". Organometallics. 29 (1): 42–51. doi:10.1021 / om900371u.
- ^ Hart, D. W .; Schwartz, J. (1974). "Hydrozirkonace. Organická syntéza prostřednictvím organozirkoniových meziproduktů. Syntéza a přesmyk komplexů alkylzirkonia (1 V) a jejich reakce s elektrofily". Journal of the American Chemical Society. 96 (26): 8115–8116. doi:10.1021 / ja00833a048.
- ^ Zhang, Donghui (2007). "Řízená hydrozirkonace propargylických alkoholů". Journal of the American Chemical Society. 129: 12088–12089. doi:10.1021 / ja075215o.
- ^ Elektrofil v této reakci je jód. Předpokládá se, že přísada podporuje řízení kinetické reakce.
- ^ Kang, Suk-Ku (2002). „Palladiem katalyzovaná kopulační reakce acylzirkonocenchloridů s hypervalentními jodoniovými solemi: syntéza aryl-substituovaných ketonů“. Journal of the Chemical Society, Perkin Transactions 1 (4): 459–461. doi:10.1039 / b110983a.
- ^ Činidla: fenylacetylen Schwartzovo činidlo, tetrafenylpalladium a jod difenyljodoniumtetrafluorborát (fenyl skupinový dárce)
- ^ Gandon, Vincent (2002). „Přístup v jedné nádobě k cyklopropanům z allylových etherů pomocí hydrozirkonace - tvorby deoxygenativního kruhu“. Chemická komunikace (12): 1308–1309. doi:10.1039 / b203762a.
- ^ Sun, R. C .; Okabe, M .; Coffen, D. L .; Schwartz, J. (1998). "Přidání konjugátu vinylzirkoniového činidla: 3- (1-okten-1-yl) cyklopentanon". Organické syntézy.; Kolektivní objem, 9, str. 640
- ^ Panek, J. S .; Hu, T. (1997). "Stereo- a regio-řízená syntéza rozvětvených trisubstituovaných konjugovaných dienů palladiem (0) -katalyzovanou křížovou vazebnou reakcí". J. Org. Chem. 62 (15): 4912–4913. doi:10.1021 / jo970647a.
- ^ Wipf, Peter; Jahn, Heike (1996). "Syntetické aplikace komplexů organochlorozirkonocenů". Čtyřstěn. 52 (40): 12853–12910. doi:10.1016/0040-4020(96)00754-5.
- ^ Bertelo, Christopher A .; Schwartz, Jeffrey (1975). „Hydrozirkonace. II. Oxidační homologace olefinů prostřednictvím inzerce oxidu uhelnatého do vazby uhlík-zirkonium“. J. Am. Chem. Soc. 97 (1): 228–230. doi:10.1021 / ja00834a061.
externí odkazy
- Příklady v organické syntéze na webových stránkách University of Connecticut