Spektroskopie nukleární magnetické rezonance sacharidů - Nuclear magnetic resonance spectroscopy of carbohydrates
Sacharidová NMR spektroskopie je aplikace nukleární magnetická rezonance (NMR) spektroskopie ke strukturní a konformační analýze sacharidy. Tato metoda umožňuje vědcům objasnit strukturu monosacharidy, oligosacharidy, polysacharidy, glykokonjugáty a další deriváty sacharidů ze syntetických a přírodních zdrojů. Mezi strukturní vlastnosti, které lze určit pomocí NMR, patří primární struktura (včetně stereochemie), sacharidová konformace, stechiometrie substituentů a poměr jednotlivých sacharidů ve směsi. Moderní NMR přístroje s vysokým polem používané pro vzorky uhlohydrátů, obvykle 500 MHz nebo vyšší, jsou schopné spustit sadu 1D, 2D a 3D experimentů k určení struktury uhlohydrátových sloučenin.
Pozorovatelné na NMR sacharidů
Chemický posun
Běžné rozsahy chemických posunů pro jádra v sacharidových zbytcích jsou:
- Typický 1H NMR chemické posuny protonů sacharidových kruhů jsou 3–6 ppm (4,5–5,5 ppm pro anomerní protony).
- Typický 13C NMR chemické posuny uhlovodíkových kruhových uhlíků jsou 60–110 ppm
V případě jednoduchých mono- a oligosacharidových molekul jsou všechny protonové signály od sebe obvykle odděleny (obvykle na 500 MHz nebo lepší NMR přístroje) a lze je přiřadit pouze pomocí 1D NMR spektra. Větší molekuly však vykazují významné překrývání protonového signálu, zejména v neanomerní oblasti (3-4 ppm). Uhlík-13 NMR překonává tuto nevýhodu větším rozsahem chemických posunů a speciálními technikami, které umožňují blokovat spřádání vazby uhlík-proton, čímž jsou všechny uhlíkové signály od sebe navzájem odlišitelné.
Typická rozmezí specifických chemických posunů uhlovodíků a uhlíku v nesubstituovaných monosacharidech jsou:
- Anomerické uhlíky: 90-100 ppm
- Uhlíky s cukrovým prstencem nesoucí hydroxylovou funkci: 68-77
- Uhlíkové uhlíky v otevřené formě nesoucí hydroxylovou funkci: 71-75
- Uhlíky s cukrovým prstencem nesoucí amino funkci: 50-56
- Exocyklické hydroxymethylové skupiny: 60-64
- Exocyklické karboxylové skupiny: 172-176
- Uhlíky s desoxygenovaným cukrem: 31-40
- Uhlík na uzávěru pyranózového kruhu: 71-73 (α-anomery), 74-76 (β-anomery)
- Uhlík na uzávěru furanosového kruhu: 80-83 (α-anomery), 83-86 (β-anomery)
Vazebné konstanty
Přímé vazebné konstanty uhlík-proton se používají ke studiu anomerní konfigurace cukru. Vicinální proton-protonové vazebné konstanty se používají ke studiu stereofonní orientace protonů relativně k ostatním protonům v cukrovém kruhu, čímž se identifikuje monosacharid. konstanty se používají ke studiu torzních úhlů podél glykosidické vazby mezi cukry nebo podél exocyklických fragmentů, čímž se odhalí molekulární konformace.
Cukrové kroužky jsou relativně tuhé molekulární fragmenty, proto jsou charakteristické vazby vicinálních protonů a protonů:
- Rovníková až osová: 1–4 Hz
- Rovníková až rovníková: 0–2 Hz
- Axiální až axiální neamerické: 9–11 Hz
- Axiální až axiální anomerní: 7–9 Hz
- Axiální až exocyklický hydroxymethyl: 5 Hz, 2 Hz
- Geminal mezi hydroxymethylovými protony: 12 Hz
Účinky jaderného přetěžovače (NOE)
NE jsou citlivé na meziatomové vzdálenosti, což umožňuje jejich použití jako konformační sondy nebo důkazu o tvorbě glykosidové vazby. Je běžnou praxí porovnávat vypočítané s experimentálními proton-protonovými NOE v oligosacharidech, aby se potvrdila teoretická konformační mapa. Výpočet NOE předpokládá optimalizaci molekulární geometrie.
Další pozorovatelné NMR
Relaxivity, míra nukleární relaxace, tvar linie a další parametry byly uváděny jako užitečné při strukturálních studiích sacharidů.[1]
Elucidace struktury sacharidů pomocí NMR spektroskopie
Strukturální parametry sacharidů
Následuje seznam strukturních znaků, které lze objasnit pomocí NMR:
- Chemická struktura každého sacharidového zbytku v molekule, včetně
- velikost uhlíkové kostry a typ cukru (aldóza / ketóza)
- velikost cyklu (pyranóza / furanóza / lineární)
- stereo konfigurace všech uhlíků (identifikace monosacharidů)
- stereo konfigurace anomerního uhlíku (α / β)
- absolutní konfigurace (D / L)
- umístění amino-, karboxy-, deoxy- a dalších funkcí
- Chemická struktura nezacharidových zbytků v molekule (aminokyseliny, mastné kyseliny, alkoholy, organické aglykony atd.)
- Substituční pozice ve zbytcích
- Pořadí reziduí
- Stechiometrie koncových zbytků a postranních řetězců
- Umístění fosfátových a síranových diesterových vazeb
- Stupeň polymerace a umístění rámu (pro polysacharidy)
NMR spektroskopie vs. jiné metody
Široce známé metody strukturního vyšetřování, jako je hmotnostní spektrometrie a rentgenová analýza, jsou pro sacharidy použitelné pouze omezeně.[1] Takové strukturní studie, jako je stanovení sekvence nebo identifikace nových monosacharidů, těží z NMR spektroskopie nejvíce. Absolutní konfigurace a stupeň polymerace nejsou vždy stanovitelné pouze pomocí NMR, takže proces strukturního objasnění může vyžadovat další metody. Ačkoli monomerní složení lze vyřešit pomocí NMR, chromatografické a hmotnostní spektroskopické metody poskytují tyto informace někdy jednodušší. Ostatní strukturní znaky uvedené výše lze určit pouze pomocí NMR spektroskopických metod. Omezením strukturních studií NMR sacharidů je to, že objasnění struktury lze jen stěží automatizovat a vyžaduje, aby lidský odborník odvodil strukturu z NMR spekter.
Aplikace různých NMR technik na sacharidy
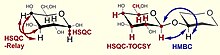
Komplexní glykany mají velké množství překrývajících se signálů, zejména v protonovém spektru. Proto je výhodné pro přiřazení signálů použít 2D experimenty. Tabulka a obrázky níže uvádějí nejrozšířenější NMR techniky používané ve studiích sacharidů.

| NMR experiment | Popis | Získané informace |
|---|---|---|
| 1H 1D | 1D protonové spektrum | měření vazeb, obecné informace, identifikace reziduí, základ pro přiřazení uhlíkového spektra |
| 13C BB | Spektrum 1D uhlíku-13 oddělené od protonů | podrobné informace, identifikace reziduí, substituční polohy |
| 31P BB, 15N BB | 1D heteronukleová spektra oddělená od protonů | dodatečné informace |
| APT, 13C DEPT | připojený protonový test, řízený zvýšený polarizační přenos (upravené 1D uhlíkové spektrum 13) | přiřazení CH2 skupiny |
| 13C Gated, 31P Gated | Spektra 1D uhlíku-13 spojená s protony a heteronukleová spektra | měření heteronukleárních vazeb, objasnění anomerní konfigurace, konformační studie |
| 1H,1H J-vyřešeno | 2D NMR graf ukazující J-vazby ve druhé dimenzi | přesné hodnoty J-spojení a hodnoty chemického posunu pro přeplněné spektrální oblasti |
| 1H DOSY | 2D NMR graf s protonovými spektry jako funkce koeficientu molekulární difúze | měření difuzního koeficientu, odhad velikosti / hmotnosti molekuly, spektrální separace různých molekul ve směsi |
| 1H,1H COSY | Korelace protonových spinů | přiřazení protonového spektra pomocí vicinálních vazeb |
| COZY RCT, COZY RCT2 | Korelace protonového spinu s jedno- nebo dvoustupňovým přenosem koherence | přiřazení protonového spektra, kde se překrývají signály sousedních vicinálních protonů |
| DQF COZY | Dvojitě kvantově filtrovaná korelace protonových spinů | Veličiny J-vazby a počet protonů účastnících se J-vazby |
| 1H HD rozdíl | Selektivní diferenciální homodecoupling | analýza tvaru čáry překrývajících se protonových signálů |
| TOCSY (HOHAHA) | Celková korelace všech protonů v rotačním systému | rozlišování spinových systémů reziduí |
| 1D TOCSY | TOCSY jediného signálu | extrakce spinového systému určitého zbytku |
| NOESY, ROESY | Korelace účinku homonukleárního jaderného overhauseru (vesmírem) | odhalení prostorově blízkých protonových párů, stanovení sekvence reziduí, stanovení průměrné konformace |
| 1H NOE dif | Selektivní diferenciální měření NOE | studie prostorových kontaktů protonů |
| 1H,13C HSQC | Heteronukleární jedno-kvantová koherence, přímá korelace protonu a uhlíku | přiřazení uhlíkového spektra |
| 1H,31P HSQC | Heteronukleární jedno-kvantová koherence, korelace protonu a fosforu | lokalizace zbytků kyseliny fosforečné ve fosfoglykanech |
| 1H,13C HMBC | Heteronukleární korelace s více vazbami, vicinální korelace protonu s uhlíkem | stanovení sekvence zbytků, vzor acetylace / amidace, potvrzení pozic substituce |
| 1H, X 1D HMBC | HMBC pro jediný signál | přiřazení protonu kolem určitého uhlíku nebo heteroatomu |
| 1H,13C HSQC relé | Implicitní korelace uhlík-uhlík prostřednictvím vicinálních vazeb připojených protonů | přiřazení sousedních atomů uhlíku |
| 1H,13C HSQC-TOCSY | Korelace protonů se všemi uhlíky v rotačním systému a naopak | přiřazení C5 pomocí H6 a řešení podobných problémů, rozdělení uhlíkového spektra na subspektra zbytků |
| 1H, X 1D NOE | Heteronukleární měření NOE | heteronukleární prostorové kontakty, konformace |
Schéma výzkumu
NMR spektroskopický výzkum zahrnuje následující kroky:
- Extrakce sacharidového materiálu (pro přírodní glykany)
- Chemické odstraňování skupin maskujících pravidelnost (u polymerů)
- Oddělení a čištění sacharidového materiálu (pro 2D NMR experimenty se doporučuje 10 mg nebo více)
- Příprava vzorku (obvykle v D2O)
- Pořízení 1D spekter
- Plánování, získávání a zpracování dalších NMR experimentů (obvykle vyžaduje od 5 do 20 hodin)
- Přiřazení a interpretace spekter (viz příkladný obrázek)
- Pokud nelze vyřešit strukturální problém: chemická modifikace / degradace a NMR analýza produktů
- Získávání spekter nativní (nemaskované) sloučeniny a jejich interpretace na základě modifikované struktury
- Prezentace výsledků

Sacharidové NMR databáze a nástroje
Bylo vytvořeno několik databází chemických posunů a souvisejících služeb, které napomáhají strukturálnímu objasnění a odborné analýze jejich NMR spekter. Z nich je několik informatických nástrojů věnováno pouze sacharidům:
- GlycoSCIENCES.de
- přes 2000 NMR spekter savčích glykanů[2]
- hledání struktury pomocí NMR signálů a naopak
- CSDB (databáze struktur sacharidů[3][4]) obsahuje:
- přes 4000 NMR spekter bakteriálních, rostlinných a plísňových glykanů,
- hledání struktury pomocí NMR signálů a naopak
- rutina simulace empirického spektra optimalizovaná pro sacharidy,[5]
- statistický odhad chemického posunu založený na HOSE algoritmu optimalizovaném pro sacharidy,[6][7]
- generování struktury a nástroj pro hodnocení na základě NMR.[8]
- CASPER (počítačově podporované spektrální hodnocení běžných polysacharidů).[9][10] obsahuje:
- databáze chemických posunů,
- rutina simulace empirického spektra optimalizovaná pro sacharidy,
- online rozhraní.
- nástroj pro porovnávání struktur. Pro přístup ke strukturním informacím lze použít protony i chemické posuny C a H uhlíku.
Simulace pozorovatelných NMR

Bylo přezkoumáno několik přístupů k simulaci pozorovatelných NMR sacharidů.[1] Obsahují:
- Přístupy univerzální statistické databáze (ACDLabs, Modgraph atd.)
- Využití neuronových sítí k upřesnění předpovědí
- Regresní metody
- NABÍT
- Empirická schémata optimalizovaná na sacharidy (CSDB / BIOPSEL, CASPER).
- Kombinovaný výpočet molekulární mechaniky / dynamiky geometrie a kvantově-mechanické simulace / iterace pozorovatelných NMR (PERCH NMR Software)
- ONIOM přístupy (optimalizace různých částí molekuly s různou přesností)
- Ab initio výpočty.
Rostoucí výpočetní výkon umožňuje použití důkladných kvantově-mechanických výpočtů na vysokých úrovních teorie a velkých sad základů pro zdokonalení molekulární geometrie sacharidů a následnou predikci pozorovatelnosti NMR pomocí GIAO a dalších metod s nebo bez účtu s rozpouštědlovým efektem. Mezi kombinace teoretické úrovně a základní sady uváděné jako dostatečné pro předpovědi NMR patřily B3LYP / 6-311G ++ (2d, 2p) a PBE / PBE (viz přehled). U sacharidů se ukázalo, že empirická schémata optimalizovaná na sacharidy poskytují výrazně lepší přesnost (0,0-0,5 ppm na 13C rezonance) než kvantové chemické metody (nad 2,0 ppm na rezonanci) uváděné jako nejlepší pro simulace NMR a fungují tisíckrát rychleji. Tyto metody však mohou předpovídat pouze chemické posuny a vykazují špatnou účinnost pro jiné než sacharidové části molekul. Jako reprezentativní příklad viz obrázek vpravo.
Viz také
- Metody 1D a 2D NMR spektroskopie ve strukturních studiích přírodních glykopolymerů (přednáška)[11]
- Sacharidové databáze v posledním desetiletí (přednáška; zahrnuje data simulace NMR)[12]
- Uhlohydrát
- Glykan
- Jaderná magnetická rezonance
- Spektroskopie nukleárních magnetických rezonancí nukleových kyselin
- Spektroskopie nukleární magnetické rezonance proteinů
- NMR spektroskopie
- Jaderný Overhauser efekt
Reference
- ^ A b C Toukach F.V .; Ananikov V.P. (2013). „Nedávný pokrok ve výpočetních předpovědích NMR parametrů pro objasnění struktury sacharidů: metody a omezení“. Recenze chemické společnosti. 42 (21): 8376–8415. doi:10.1039 / C3CS60073D. PMID 23887200.
- ^ http://csdb.glycosciences.de
- ^ http://csdb.glycoscience.ru
- ^ Toukach Ph.V. (2011). "Databáze struktur bakteriálních sacharidů 3: Principy a realizace". Journal of Chemical Information and Modeling. 51 (1): 159–170. doi:10.1021 / ci100150d. PMID 21155523.
- ^ http://csdb.glycoscience.ru/bacterial/index.html?help=nmr#empirical
- ^ http://csdb.glycoscience.ru/bacterial/index.html?help=nmr#statistical
- ^ Kapaev R.R .; Egorova K.S .; Toukach Ph.V. (2014). „Schéma zobecnění struktury sacharidů pro databázovou simulaci experimentálních pozorovatelností, jako jsou chemické posuny NMR“. Journal of Chemical Information and Modeling. 54 (9): 2594–2611. doi:10.1021 / ci500267u. PMID 25020143.
- ^ http://csdb.glycoscience.ru/bacterial/index.html?help=nmr#grass
- ^ http://www.casper.organ.su.se/casper/
- ^ P.-E. Jansson; R. Stenutz; G. Widmalm (2006). "Stanovení sekvence oligosacharidů a běžných polysacharidů pomocí NMR spektroskopie a nové webové verze počítačového programu CASPER". Výzkum sacharidů. 341 (8): 1003–1010. doi:10.1016 / j.carres.2006.02.034. PMID 16564037.
- ^ http://toukach.ru/nmrglyco.htm
- ^ http://toukach.ru/glyco-db.htm
Další čtení
- D. Łowicki; A. Czarny; J. Mlynarski (2013). Jaderná magnetická rezonance: NMR sacharidů. Royal Society of Chemistry. str. 383. ISBN 978-1-84973-577-3.
externí odkazy
 Média související s Spektroskopie nukleární magnetické rezonance sacharidů na Wikimedia Commons
Média související s Spektroskopie nukleární magnetické rezonance sacharidů na Wikimedia Commons
