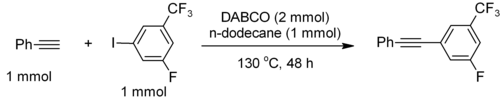DABCO - DABCO - Wikipedia
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC 1,4-Diazabicyklo [2.2.2] oktan | |||
| Ostatní jména Triethylendiamin, TEDA | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.005.455 | ||
| Číslo ES |
| ||
PubChem CID | |||
| UNII | |||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C6H12N2 | |||
| Molární hmotnost | 112.176 g · mol−1 | ||
| Vzhled | Bílý krystalický prášek | ||
| Bod tání | 156 až 160 ° C (313 až 320 ° F; 429 až 433 K) | ||
| Bod varu | 174 ° C (345 ° F; 447 K) | ||
| Rozpustný, hygroskopický | |||
| Kyselost (strK.A) | 3,0, 8,8 (ve vodě)[1] | ||
| Nebezpečí | |||
| Hlavní nebezpečí | Škodlivý | ||
| Piktogramy GHS |    | ||
| Signální slovo GHS | Nebezpečí | ||
| H228, H302, H315, H319, H335, H412 | |||
| P210, P261, P273, P305 + 351 + 338 | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | 62 ° C (144 ° F; 335 K) | ||
| Související sloučeniny | |||
Související sloučeniny | Chinuklidin Tropane | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
DABCO (1,4-diazabicyklo [2.2.2] oktan) je bicyklické organická sloučenina se vzorcem N2(C2H4)3. Tato bezbarvá pevná látka je vysoce nukleofilní terciární amin základna, který se používá jako katalyzátor a činidlo v polymerizace a organická syntéza.[3]
Chinuklidin má podobnou strukturu, přičemž jeden z atomů dusíku je nahrazen atomem uhlíku.
Reakce a aplikace
StrK.A z [HDABCO]+ (protonovaný derivát) je 8,8, což je téměř stejné jako u běžných alkylaminů. Nukleofilita aminu je vysoká, protože aminová centra nejsou narušena. Je dostatečně základní podporovat spojení C – C terminálních acetylenů, například fenylacetylen páry s elektronově deficitními jodareny.
Katalyzátor
DABCO se používá jako základní katalyzátor pro:
- vznik polyuretan z monomerů a předpolymerů funkcionalizovaných alkoholem a isokyanátem.[4]
- Baylis-Hillman a Reakce Mority-Baylis-Hillmanové aldehydů a nenasycených ketonů a aldehydů.[5]
Lewisova základna
Jako neomezený amin je silný ligand a Lewisova základna. S ním tvoří krystalický adukt 2: 1 peroxid vodíku[6] a oxid siřičitý.[7]
Syntéza iontových monomerů
DABCO lze použít k syntéze dvojnásobně nabitých styrenových monomerů. Tyto iontové monomery umožňují syntézu polyelektrolytů a ionomerů se dvěma cyklickými kvartérními amoniovými kationty na každé iontové závěsné skupině. [8]
Tlumič singletového kyslíku
DABCO a příbuzné aminy jsou zhášedly singletového kyslíku a účinných antioxidantů,[9] a lze je použít ke zlepšení životnosti barviva. Díky tomu je DABCO užitečné v lasery na barvení a při montáži vzorků pro fluorescenční mikroskopie (při použití s glycerol a PBS ).[10] DABCO lze také použít k demetylaci kvartérní amonné soli zahřátím dimethylformamid (DMF).[11]
Výroba
Vyrábí se tepelnými reakcemi sloučenin typu H2NCH2CH2X (X = OH, NH2nebo NHR) v přítomnosti zeolitických katalyzátorů. Pro převod z je zobrazen idealizovaný převod ethanolamin:[12]
- 3 H2NCH2CH2OH → N (CH2CH2)3N + NH3 + 3 H2Ó
Reference
- ^ D. H. Ripin; D. A. Evans (2002). „pKa kyselin dusíku“ (PDF).
- ^ „Bezpečnostní údaje pro 1,4-diazabicyklo [2.2.2] oktan (viz bezpečnostní list)“. Sigma-Aldrich.
- ^ Uppuluri V. Mallavadhani, Nicolas Fleury-Bregeot. „1,4-Diazabicyklo [2.2.2] oktan“. v Encyklopedie činidel pro organickou syntézu2010, John Wiley & Sons, Ltd. doi:10.1002 / 047084289X.rd010m.pub2
- ^ "Průvodce polyuretanovými přísadami" (PDF). Air Products & Chemicals. Archivovány od originál (PDF) dne 06.03.2016.
- ^ Baylis, A. B .; Hillman, M. E. D. německý patent 2155113, 1972.
- ^ P. Dembech, A. Ricci, G. Seconi a M. Taddei „Bis (trimethylsilyl) peroxid“ Org. Synth. 1997, svazek 74, s. 84. doi:10.15227 / orgsyn.074.0084
- ^ Ludovic Martial a Laurent Bischoff „Příprava DABSO z Karl-Fischerova činidla“ Org. Synth. 2013, svazek 90, s. 301. doi:10.15227 / orgsyn.090.0301
- ^ Zhang, K .; Drummey, K. J .; Moon, N.G .; Chiang, W. D .; Long, T. E. (2016). „Styrenové monomery obsahující sůl DABCO pro syntézu nových nabitých polymerů“. Chemie polymerů. 7 (20): 3370–3374. doi:10.1039 / C6PY00426A.
- ^ Ouannes, C .; Wilson, T. (1968). "Zchlazení singletového kyslíku terciárními alifatickými aminy. Účinek DABCO (1,4-diazabicyklo [2.2.2] oktanu)". Journal of the American Chemical Society. 90 (23): 6527–6528. doi:10.1021 / ja01025a059.
- ^ Valnes, K .; Brandtzaeg, P. (1985). "Zpomalení blednutí imunofluorescence během mikroskopie" (PDF). Journal of Histochemistry and Cytochemistry. 33 (8): 755–761. doi:10.1177/33.8.3926864. PMID 3926864.
- ^ Ho, T. L. (1972). „Dealkylace kvartérních amonných solí s 1,4-diazabicyklo [2.2.2] oktanem“. Syntéza. 1972 (12): 702. doi:10.1055 / s-1972-21977.
- ^ Karsten Eller, Erhard Henkes, Roland Rossbacher, Hartmut Höke „Amines, Aliphatic“ v Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. doi:10.1002 / 14356007.a02_001
Další čtení
- Cecchi, L .; DeSarlo, F .; Machetti, F. (2006). „1,4-Diazabicyklo [2.2.2] oktan (DABCO) jako účinné reakční činidlo pro syntézu derivátů isoxazolu z primárních nitrosloučenin a dipolarofilů: role báze“. European Journal of Organic Chemistry. 2006 (21): 4852–4860. doi:10.1002 / ejoc.200600475..