Katalýza vodíkovou vazbou - Hydrogen-bond catalysis
Katalýza vodíkovou vazbou je typ organokatalýza který se spoléhá na použití vodíkové vazby interakce k urychlení a kontrole organické reakce. V biologických systémech hraje vodíková vazba klíčovou roli v mnoha enzymatických reakcích, a to jak při orientaci molekul substrátu, tak při snižování bariér reakce.[1] Chemici se však teprve nedávno pokusili využít sílu použití vodíkových vazeb k provedení katalýzy a pole je relativně nevyvinuté ve srovnání s výzkumem v Lewisova kyselá katalýza.[2]
Katalytické množství dárců vodíkových vazeb může podporovat reakce prostřednictvím různých mechanismů. V průběhu reakce může být vodíková vazba použita ke stabilizaci aniontových meziproduktů a přechodové stavy. Alternativně mohou některé katalyzátory vázat malé anionty, což umožňuje tvorbu reaktivních elektrofilních kationtů. Kyselější dárci mohou působit jako obecné nebo specifické kyseliny, které aktivují elektrofily protonací. Silným přístupem je současná aktivace obou partnerů v reakci, např. nukleofil a elektrofil, nazývané „bifunkční katalýza“. Ve všech případech úzká asociace molekuly katalyzátoru se substrátem také činí katalýzu vodíkovou vazbou účinnou metodou indukce enantioselektivita.
Katalyzátory vázající vodík jsou často snadno vyrobitelné, relativně robustní a lze je syntetizovat ve vysoké enantiomerní čistotě. Nové reakce katalyzované donory vodíkových vazeb jsou objevovány s rostoucím tempem, včetně asymetrických variant běžných organických reakcí užitečných pro syntézu, jako je aldol dodatky, Diels-Alder cykloadice a Mannich reakce.[3]
Existuje však několik problémů, které je třeba překonat, než může katalýza vodíkových vazeb dosáhnout svého plného potenciálu, pokud jde o syntetickou užitečnost. Současné známé reakce jsou velmi specifické pro substrát a obecně vykazují zrychlení a obrat nízkou rychlostí, což vyžaduje vysoké naplnění katalyzátorem. Katalyzátory jsou často objevovány a optimalizovány metodou pokusů a omylů a chemici špatně chápou vztah mezi strukturou katalyzátoru a reaktivitou. Kromě toho pole trpí nedostatkem obecného mechanistického porozumění, které bylo výrazně překonáno objevem nových reakcí. Díky podrobnějším studiím struktury a mechanismu v budoucnu má katalýza vodíkových vazeb velký potenciál pro umožnění nových, účinných, selektivních reakcí a slibných aplikací v asymetrické syntéze.
Katalytické strategie
Stabilizace čtyřstěnných meziproduktů
Mnoho užitečných organických reakcí zahrnuje tvorbu čtyřboká meziprodukty prostřednictvím nukleofilního útoku funkčních skupin, jako je aldehydy, amidy nebo imines. V těchto případech je katalýza s donory vodíkových vazeb atraktivní strategií, protože aniontové čtyřstěnné meziprodukty jsou lepšími akceptory vodíkových vazeb než výchozí sloučenina. To znamená, že vzhledem k počátečnímu komplexu katalyzátor-substrát je přechodový stav, nesoucí více záporného náboje, stabilizovaný.

Například v typické acylové substituční reakci je výchozí karbonylová sloučenina koordinována s katalyzátorem prostřednictvím jedné, dvou nebo případně více vodíkových vazeb. Během útoku nukleofilu se na kyslíku vytváří negativní náboj, dokud není dosaženo čtyřboký meziprodukt. Formálně negativní kyslík proto zabírá mnohem silnější vodíkovou vazbu než výchozí karbonylový kyslík kvůli jeho zvýšenému negativnímu náboji. Energeticky to má za následek snížení meziproduktu a přechodový stav, čímž se zrychluje reakce.
Tento způsob katalýzy se nachází v aktivní stránky z mnoha enzymy, tak jako serinové proteázy.[4] V tomto příkladu je amid karbonyl koordinován se dvěma N – H dárci. Tato místa vícenásobné koordinace určená k podpoře karbonylových reakcí v biologii se nazývají „oxyaniontové otvory ". Dodávka serinového nukleofilu tvoří čtyřboký meziprodukt, který je stabilizován zvýšením vodíkové vazby k oxyaniontovému otvoru."

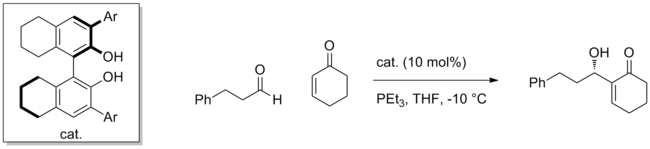
Mnoho syntetických katalyzátorů dokázalo úspěšně použít tuto strategii k aktivaci různých elektrofilů. Pomocí chirál BINOL katalyzátor, například Morita-Baylis-Hillman reakce přidání enonů do aldehydů může být provedeno s vysokou enantioselektivitou.[5] Nukleofil je druh enolátového typu generovaný konjugovanou adicí PEt3 na enon a enantioselektivně se přidává k aldehydu koordinovanému na katalyzátoru.
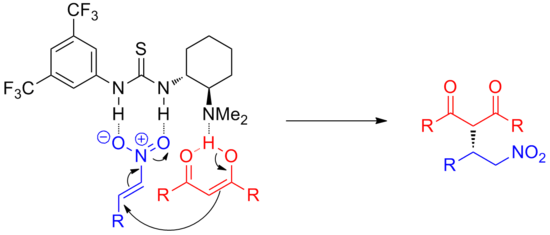
Kromě karbonylových skupin lze úspěšně použít i jiné elektrofily, jako jsou iminy. Například pomocí jednoduchého chirálního thiomočovinového katalyzátoru, asymetrického Mannichova reakce aromatických iminů se silylketenacetaly lze katalyzovat s vysokou ee v téměř kvantitativní přeměně.[6] Mechanismus této reakce není zcela vyřešen a reakce je velmi substrátově specifická, účinná pouze u určitých aromatických elektrofilů.
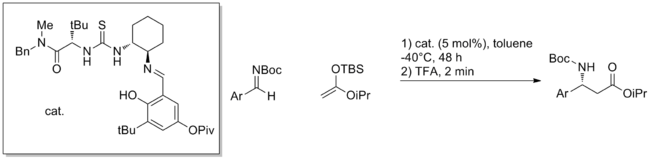
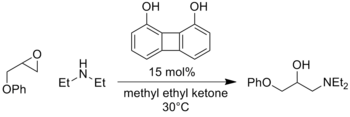
Rozsah tohoto způsobu aktivace je obrovský, s neustálými novými zprávami o různých kombinacích elektrofilů, nukleofilů a struktur katalyzátorů. Kromě toho analogické reakce zahrnující meziprodukty oxyaniontu, jako je přidání enolátu nitroso sloučeniny[7] nebo otevření epoxidy[8] byly touto strategií také úspěšně katalyzovány.
Navzdory množství známých různých reakcí je však obecné porozumění způsobu katalýzy omezené a téměř všechny objevené reakce jsou extrémně specifické pro daný substrát.
Stabilizace aniontových fragmentů
Další strategií, která byla zkoumána, je stabilizace reakcí, u nichž se v přechodovém stavu vyvinou částečné záporné náboje. Příklady úspěšných aplikací jsou nejčastěji reakce, které jsou aproximované vzájemně sladěné a pericyklické povahy. V průběhu reakce se u jednoho fragmentu vyvine částečný negativní charakter a přechodový stav lze stabilizovat přijetím vodíkových vazeb.
Ukázkovým příkladem je katalýza Claisenovy přesmyky esterem substituovaných allylvinyletherů uváděných výzkumnou skupinou Jacobsen.[9] Chirál guanidinium Bylo zjištěno, že katalyzátor úspěšně podporuje reakci blízko teploty místnosti s vysokou enantioselektivitou. Během přechodového stavu se fragment koordinovaný s amidiniovým katalyzátorem vyvíjí částečně aniontový charakter díky elektronegativitě kyslíku a esterové skupiny přitahující elektrony. To zvyšuje pevnost vodíkových vazeb a snižuje energii přechodového stavu, čímž urychluje reakci.

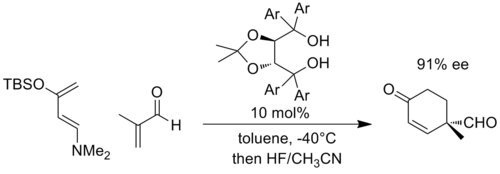
Podobně se záporný náboj může vyvinout v cykloadičních reakcích, jako je Diels-Alder reakce, když jsou partneři vhodně substituováni. Jako reprezentativní příklad vyvinuli Rawal a spolupracovníci chirální katalyzátor na bázi α, α, α, α-tetraaryl-1,3-dioxolan-4,5-dimethanolu (TADDOL ), které by mohly katalyzovat Diels-Alderovy reakce. V následujícím příkladu se předpokládá, že reakce s vysoce elektronově bohatým dienem a elektronově chudým dienofilem vyvine významný negativní náboj na fragmentu enálu a je přechodový stav stabilizován zvýšenou vodíkovou vazbou na TADDOL (Ar = 1 -naftyl).[10]
Anionová vazba
Katalyzátory vodíkové vazby mohou také urychlit reakce tím, že pomáhají při tvorbě elektrofilních druhů abstrahováním a / nebo koordinací aniontu, jako je halogenid. Katalyzátory močoviny a thiomočoviny jsou nejčastějšími donory katalýzy vázající anionty a jejich schopnost vázat halogenidy a jiné anionty je v literatuře dobře zavedena.[11] Použití chirálních katalyzátorů vázajících anionty může vytvořit asymetrický iontový pár a vyvolat pozoruhodnou stereoselektivitu.
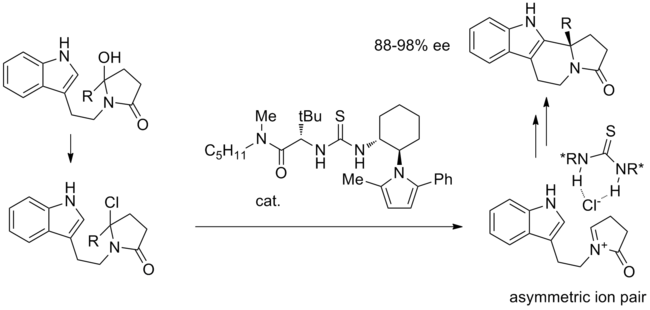
Jednou z prvních reakcí navržených k provedení katalýzy vázající anionty je Pictet-Spengler -typová cyklizace hydroxylaktamů s TMSCI za katalýzy thiomočovinou.[12] V navrhovaném mechanismu se po počáteční substituci hydroxylové skupiny chloridem vytvoří klíčový iontový pár. Aktivovaný iminiový ion je úzce spojen s chirálním chloridem vázaným na thiomočovinu a intramolekulární cyklizace probíhá s vysokou stereoselektivitou.
Asymetrické iontové páry mohou být také napadeny v mezimolekulárních reakcích. Ve zajímavém příkladu lze asymetrické přidání enolsilánových nukleofilů k oxokarbeniumiontovým iontům provést katalytickým vytvořením oxokarbenia přes vazbu aniontu.[13] Chlorether se vychází z acetalu a generuje se chlorid boritý a reagoval s enol silanem a katalyzátorem. Mechanismus tvorby komplexu oxokarbenium-thiomočovina-chlorid není zcela vyřešen. Předpokládá se, že za reakčních podmínek může chloroether epimerizovat a thiomočovina může stereoselektivně vázat chlorid za vzniku úzce spojeného iontového páru. Tento asymetrický iontový pár je poté napaden silanem za vzniku alkylovaného produktu.

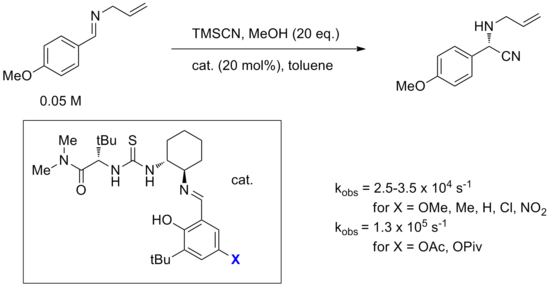
Pozoruhodným příkladem mechanismu vázání aniontů je hydrocyanace iminů katalyzovaná Jacobsenovým amido-thiomočovinovým katalyzátorem znázorněným v následujícím diagramu. Tato reakce je také jedním z nejrozsáhleji studovaných prostřednictvím výpočetních, spektroskopických, značkovacích a kinetických experimentů.[14] I když se uvažovalo o přímém přidání kyanidu k iminu vázanému na katalyzátor, byl vypočítán alternativní mechanismus zahrnující tvorbu iontového páru iminium-kyanid řízený katalyzátorem, který má bariéru nižší o 20 kcal / mol. Navrhovaný nejpravděpodobnější mechanismus začíná vazbou katalyzátoru na HNC, který existuje v rovnováze s HCN. Tento komplex pak protonuje molekulu iminu, tvořící iontový pár iminium-kyanid s vazbou katalyzátoru a stabilizací anionu kyanidu. Předpokládá se, že iminium také interaguje s amidkarbonylem na molekule katalyzátoru (viz bifunkční katalýza níže). Vázaný kyanidový anion se poté otáčí a napadá iminium uhlíkem. Vědci dospěli k závěru, že ačkoli vazba imin-močoviny byla pozorována spektroskopií a byla podporována časnými kinetickými experimenty, vazba iminu je mimo cyklus a všechny důkazy ukazují na tento mechanismus zahrnující kyanid vázaný na thiomočovinu.

Protonace
Často je obtížné rozlišit mezi katalýzou vodíkovou vazbou a obecná kyselá katalýza.[3] Dárci vodíkových vazeb mohou mít různou kyselost, od mírných až po v podstatě silné Bronstedovy kyseliny, jako jsou kyseliny fosforečné. Pohled na rozsah přenosu protonů v průběhu reakce je náročný a ve většině reakcí nebyl důkladně zkoumán. Silné kyselé katalyzátory jsou však často seskupeny s katalyzátory na bázi vodíkové vazby, protože představují extrém tohoto kontinua a jejich katalytické chování má společné podobnosti. Mechanismus aktivace těchto reakcí zahrnuje počáteční protonaci elektrofilního partnera. To má za následek učinění substrátu elektrofilnějším a vytvoření iontového páru, kterým je možné přenášet stereochemické informace.

Asymetrická katalýza zahrnující téměř úplnou protonaci substrátu byla účinná při Mannichových reakcích aromatických aldiminů s uhlíkovými nukleofily.[15] Kromě toho, aza-Friedel-Craftsovy reakce z furany, amidoalkylace z diazokarbonyl sloučeniny, asymetrické hydrofosfonylace z aldiminy a přenos hydrogenací byly také hlášeny.[3] Chirální Bronstedovy kyseliny se často snadno připravují z chirálních alkoholů, jako jsou BINOLy, a mnohé z nich jsou již v literatuře přítomny kvůli jejich zavedené použitelnosti ve výzkumu molekulárního rozpoznávání.[16]
Multifunkční strategie
Jednou z hlavních výhod katalýzy vodíkovou vazbou je schopnost konstruovat katalyzátory, které se účastní několika nekovalentních interakcí na podporu reakce. Kromě použití donorů vodíkových vazeb k aktivaci nebo stabilizaci reaktivního centra během reakce je možné zavést další funkční skupiny, jako je např. Lewisovy základny, areny, nebo adiční místa pro vodíkové vazby za účelem další stabilizace nebo ovlivnění druhého reaktivního partnera.
Například přírodní enzym chorismát mutáza, který katalyzuje Claisenův přesmyk chorismátu, obsahuje kromě vodíkových vazeb podílejících se na stabilizaci enolátového fragmentu i mnoho dalších interakcí, což je příklad výše uvedené strategie stabilizace aniontového fragmentu.[17] Klíčovou interakcí je stabilizace ostatních kationtových látek allyl fragment v interakci kation-pi v přechodovém stavu. Použití mnoha dalších vodíkových vazeb má několik domnělých účelů. Stabilizace více vodíkových vazeb na enzym pomáhá překonat entropické náklady na vazbu. Interakce navíc pomáhají udržovat substrát v reaktivní konformaci a enzymem katalyzovaná reakce má téměř nulovou entropii aktivace, zatímco typické Claisenovy přesmyky v roztoku mají velmi negativní entropie aktivace.

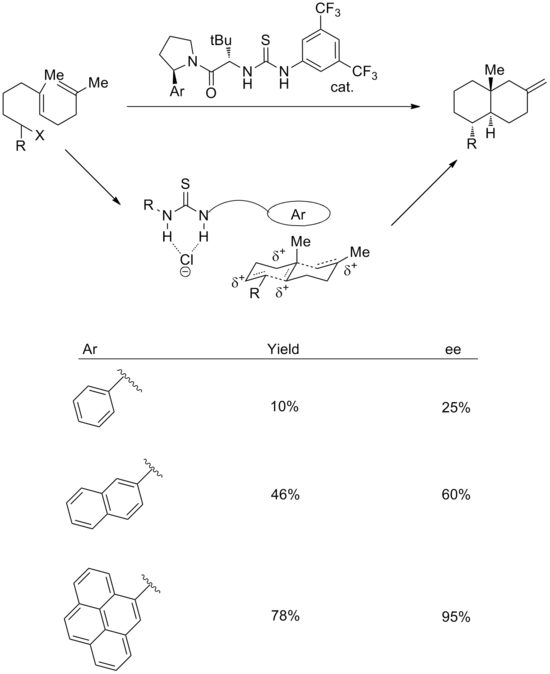
Použití interakcí kation-pi bylo také úspěšně implementováno v reakcích se syntetickými katalyzátory. K provedení enantioselektivních kationtových polycyklizací lze použít kombinaci strategií vázání aniontů a kation-pi.[18] V přechodném stavu se navrhuje, že thiomočovinová skupina váže chlorid, zatímco aromatický systém stabilizuje příslušný polyenový kation. Na podporu toho vede zvětšení velikosti aromatického kruhu ke zlepšení jak výtěžku, tak stereoselektivity. Enantioselektivita dobře koreluje jak s polarizovatelností, tak s kvadrupólovým momentem arylové skupiny.
Protože takové velké množství katalyzátorů a reakcí zahrnuje navázání na elektrofily ke stabilizaci přechodového stavu, mnoho bifunkčních katalyzátorů také představuje Lewisovo bazické akceptorové místo vodíkové vazby. Jako reprezentativní příklad vyvinuli Deng a spolupracovníci thiomočovinový aminový katalyzátor schopný podporovat stereoselektivní Michaelovy reakce.[19] V navrhovaném přechodném stavu je jeden z dárců thiomočoviny N – H koordinován s Michaelovým akceptorem a stabilizuje nárůst záporného náboje. Základní dusíkový osamělý pár působí jako akceptor vodíkové vazby ke koordinaci nukleofilu, ale v přechodném stavu působí jako obecná báze k podpoře přidání nukleofilního enolátu.

Tento motiv zapojení nukleofilních i elektrofilních partnerů do reakce a jejich stabilizace v přechodném stavu je u bifunkční katalýzy velmi běžný a mnoho dalších příkladů lze najít v článku o thiomočovinová organokatalýza.
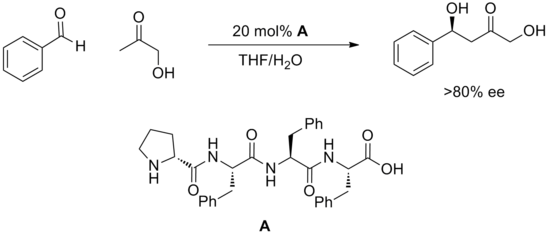
Relativně nová strategie použití syntetických oligopeptidů k provedení katalýzy přinesla mnoho úspěšných příkladů katalytických metod.[20] Peptidy obsahují více potenciálních míst pro vodíkové vazby a obecně se nechápe, jak tyto zabírají se substrátem nebo jak podporují reakci. Výhodou peptidů je, že jsou extrémně modulární a tyto katalyzátory jsou často tříděny ve velkých polích. Tímto způsobem byly objeveny vysoce enantioselektivní reakce, jako je níže popsaná aldolová reakce.
Mezi další transformace úspěšně katalyzované syntetickými peptidy patří hydrocyanace, acylace, adice konjugátů, aldehyd-iminové vazby, aldolová reakce a bromace. Ačkoli povaha přechodových stavů je nejasná, v mnoha příkladech mají malé změny ve struktuře katalyzátoru dramatické účinky na reaktivitu. Předpokládá se, že velký počet vodíkových vazeb jak uvnitř peptidu, tak mezi katalyzátorem a substrátem musí spolupracovat, aby byly splněny geometrické požadavky pro úspěšnou katalýzu. Kromě toho porozumění konstrukci a mechanismu katalyzátoru dosud nepokročilo za hranice vyžadující testování knihoven peptidů.
Konstrukce katalyzátoru
Privilegované struktury
Typy donorů vodíkových vazeb používaných při katalýze se velmi liší od reakce k reakci, dokonce i mezi podobnými katalytickými strategiemi. I když jsou specifické systémy často studovány a optimalizovány extenzivně, obecné chápání optimálního dárce pro reakci nebo vztahu mezi strukturou katalyzátoru a reaktivitou velmi chybí. Dosud není praktické racionálně navrhovat struktury podporující požadovanou reakci s požadovanou selektivitou. Současná katalýza vodíkových vazeb je však primárně zaměřena na několik typů systémů, které se experimentálně zdají být účinné v různých situacích.[21] Ty se nazývají „privilegované struktury“. Stojí však za zmínku, že slibné výsledky vykázaly také další strukturální lešení a motivy, například dárci vodíkových vazeb koordinovaných kovem.[22]
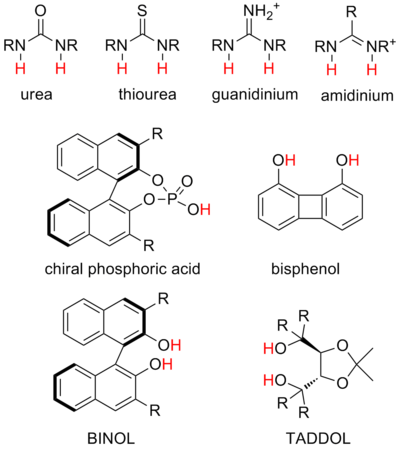
- Močoviny a thiomočoviny jsou zdaleka nejběžnějšími strukturami a mohou stabilizovat řadu negativně nabitých meziproduktů a také se zapojit do katalýzy vázající anionty. V literatuře je hojná katalýza na bifunkční močovinu a thiomočovinu.
- Guanidinium a amidinium ionty jsou strukturními příbuznými močovin a thiomočovin a mohou katalyzovat podobné reakce, ale na základě svého pozitivního náboje jsou silnějšími dárci a mnohem kyselejšími. Předpokládá se, že mechanismus katanidiové a amidiniové katalýzy často zahrnuje částečnou protonaci substrátu.
- Diol Předpokládá se, že katalyzátory zabírají substrát s jednou vodíkovou vazbou, přičemž druhý hydroxyl se účastní vnitřní vodíkové vazby. Toto jsou některé z prvních zkoumaných katalyzátorů vodíkové vazby. Nejčastěji se používají při stabilizaci parciálního aniontového náboje v přechodových stavech, například při koordinaci s aldehydovými dienofily v reakcích hetero-Diels-Alder.
- Kyselina fosforečná katalyzátory jsou nejčastějšími silně kyselými katalyzátory a fungují tvorbou párů chirálních iontů se zásaditými substráty, jako jsou iminy.
Ladění katalyzátoru
Obecně kyselost dárcovských míst dobře koreluje se silou dárce. Například je běžnou strategií přidávat arylové substituenty odebírající elektrony na thiomočovinový katalyzátor, což může zvýšit jeho kyselost a tím i sílu jeho vodíkové vazby. Stále však není jasné, jak síla dárce koreluje s požadovanou reaktivitou. Důležité je, že kyselější katalyzátory nemusí být nutně účinnější. Například močoviny jsou méně kyselé než thiomočoviny zhruba o 6 pKa jednotek, ale není obecně pravda, že močoviny jsou podstatně horší při katalytických reakcích.[23]
Kromě toho je účinek různých substituentů na katalyzátor zřídka dobře znám. Malé změny substituentů mohou zcela změnit reaktivitu nebo selektivitu. Příkladem toho byly optimalizační studie bifunkčního katalyzátoru Streckerovy reakce, jednoho z prvních dobře studovaných thiomočovinových katalyzátorů.[24] Konkrétně se při změně substituentu X na salicylaldiminovém substituentu zjistilo, že typické substituenty přitahující elektrony nebo donory elektronů měly malý účinek na rychlost, ale zdálo se, že esterové substituenty, jako je acetát nebo pivaloát, způsobují znatelné zrychlení rychlosti. Toto pozorování je obtížné racionalizovat vzhledem k tomu, že skupina X je v průběhu reakce daleko od reaktivního centra a elektronika se nejeví jako příčina. Obecně platí, že navzdory relativní snadnosti elektronického ladění s organickými katalyzátory chemici dosud nedosáhli užitečného pochopení těchto modifikací.
Syntetické aplikace
Syntéza přírodních produktů
K dnešnímu dni existuje několik příkladů katalýzy vodíkovou vazbou při syntéze přírodních produktů navzdory velkému počtu objevovaných reakcí. Obecně platí, že s vysokou požadovanou náplní katalyzátoru a často extrémní specificitou substrátu není katalýza vodíkových vazeb dosud vyvinuta dostatečně na to, aby poskytla užitečné, obecné reakce, které představují významné zlepšení oproti tradičním metodám. V publikovaných příkladech se katalýza vodíkovou vazbou používá hlavně v počátečních fázích k rychlému přístupu k časným meziproduktům s vysokým enantiomerním obohacením.
V Jacobsenově syntéze (+) - yohimbin,[25] indolový alkaloid, časná enantioselektivní Pictet-Spenglerova reakce za použití pyrrolem substituovaného thiomočovinového katalyzátoru produkovala gramová množství produktu v 94% ee a 81% výtěžku. Zbytek syntézy byl krátký, za použití redukční aminace a intramolekulární Diels-Alderovy reakce.

V roce 2008 zveřejnil Takemoto stručnou syntézu (-) - epibatidinu, která se opírala o Michaelovou kaskádu katalyzovanou bifunkčním katalyzátorem.[26] Po počátečním asymetrickém přidání Michaela do β-nitrostyren, intramolekulární Michaelova adice poskytuje produkt cyklického ketoesteru v 75% ee. Standardní manipulace s funkčními skupinami a intramolekulární cyklizace poskytují přírodní produkt.

Škálovatelná syntéza stavebních bloků
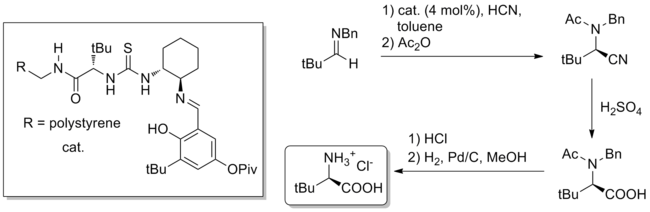
Kromě celkové syntézy je potenciálně užitečnou aplikací katalýzy vodíkovou vazbou hromadná syntéza obtížně dostupných chirálních malých molekul. Pozoruhodným příkladem je gramová stupnice Streckerova syntéza nepřirozeného aminokyseliny pomocí katalýzy thiomočovinou, popsané v časopise Příroda v roce 2009.[27] Katalyzátor, ať už vázaný na polymer nebo homogenní, je odvozen od přírodního terc-leucin a může katalyzovat (naplnění 4% mol. katalyzátoru) tvorbu produktu Strecker z benzhydrylaminu a vodného HCN. Hydrolýzou nitrilu a deprotekcí se získá čistý nepřirozený terc-leucin v 84% celkovém výtěžku a 99% ee.
Výzvy a budoucí cíle
Navzdory širokému zájmu o organokatalýzu a velkému počtu nových katalytických systémů, které jsou neustále objevovány, je pokrok v porozumění mechanismu a konstrukci katalyzátoru v oblasti katalýzy vodíkovou vazbou extrémně omezený. Ve srovnání s rozvinutějším oborem palladiem katalyzované kopulační reakce, katalýza vodíkových vazeb představuje mnoho výzev, které dosud nebyly úspěšně vyřešeny.
- Obrat: Zatímco reakce katalyzované palladiem mohou být často účinné při zatížení katalyzátoru méně než 0,1% mol., Katalyzátory vodíkové vazby se často přidávají ve více než 10% mol. Špatná akcelerace je obecný trend, který bude nutné překonat, aby katalýza vodíkovou vazbou byla praktickou syntetickou strategií.
- Mechanismus: V budoucnu bude nutné další prozkoumání přesných kroků mechanismu katalýzy vodíkových vazeb, které chemikům umožní racionálně navrhnout katalytické strategie pro složitější nebo užitečnější transformace. Pro srovnání byly základní kroky křížové vazby katalyzované palladiem systematicky a důkladně studovány v posledních několika desetiletích a vedly k dramatickému pokroku v principech katalytického rozsahu, řízení a designu. Například lepší porozumění oxidační přísada vedlo k tomu, že se arylchloridy staly praktickými spojovacími partnery, a zároveň lépe porozuměli redukční eliminace vedlo k vývoji nových reakcí zahrnujících sp3 centra. Znalost těchto základních katalytických kroků byla schopnost racionálně plánovat nové reakce a kaskády nesmírně užitečná v oblasti totální syntézy. Naproti tomu nám chybí obecné systematické mechanické pochopení kroků katalýzy vodíkových vazeb a toho, jak je ovlivnit. Podrobné mechanistické studie byly dosud omezeny na jednotlivé systémy a jejich nálezy nebyly prokazatelně prediktivní.
- Katalyzátor: Související výzvou je zkoumání toho, jak lze změny katalyzátoru, strukturní, konformační a elektronické použít k racionálnímu ovlivnění reakce. Cílem by bylo plně pochopit, jak používat více kooperativních interakcí k nejlepšímu zrychlení reakce a šíření selektivity. V ideálním případě racionální návrh katalyzátoru nakonec nahradí screening skupin katalyzátorů a výběr stavebních bloků bude systematičtější.
- Rozsah: I když jsou neustále objevovány nové reakce, většina reakcí má extrémně úzký rozsah substrátu a důvod takového úzkého rozsahu není často pochopen. V oblasti katalýzy palladiem, po založení základů mechanistického porozumění, rozsah reakcí zaznamenal rychlý růst. Znalost faktorů, které ovlivnily každý krok katalýzy, umožnila chemikům předvídat a provádět nové reakce s vysokou syntetickou užitečností, jako jsou reakce aktivace vazby CH. V oblasti katalýzy vodíkovou vazbou chemici dosud nedosáhli stadia, kdy lze snadno a systematicky cílit na nové typy reaktivity. V tomto bodě je objev reakce užitečný, ale k realizaci plného potenciálu katalýzy vodíkovou vazbou je zapotřebí podrobnější mechanistické studie.
Viz také
Další čtení
- Katalýza vodíkových vazeb. Prezentace Evans Group Meeting Petera Fullera. Odkaz
- Asymetrická katalýza vodíkových vazeb. Prezentace MacMillan Group Meeting Anthony Mastracchio. Odkaz
- Vazba vodíku při asymetrické katalýze. Prezentace setkání skupiny Leighton Uttam Tambar. Odkaz
- Asymetrická katalýza od chirálních dárců vodíkových vazeb. Prezentace setkání skupiny Wipf od Zhenglai Fanga Odkaz
- Enantioselektivní organokatalýza. Vyd. Peter I.Dalko, Wiley-VCH: Weinheim, 2007.
Reference
- ^ Jacobsen, E. N .; Knowles, R. R. (září 2010). „Atraktivní nekovalentní interakce v asymetrické katalýze: vazby mezi enzymy a katalyzátory s malými molekulami“ (PDF). Proc. Natl. Acad. Sci. 107 (48): 20678–20685. Bibcode:2010PNAS..10720678K. doi:10.1073 / pnas.1006402107. PMC 2996434. PMID 20956302.
- ^ Jacobsen, E. N .; Taylor, M. S. (únor 2006). „Asymetrická katalýza donory chirálních vodíkových vazeb“. Angew. Chem. Int. Vyd. 45 (10): 1521–1539. doi:10.1002 / anie.200503132.
- ^ A b C Doyle, Abigail G .; Jacobsen, E. N. (prosinec 2007). "Dárci H-vazeb s malou molekulou v asymetrické katalýze". Chem. Rev. 107 (12): 5713–5743. doi:10.1021 / cr068373r. PMID 18072808.
- ^ Sinnott, M. (1998). Comprehensive Biological Catalysis, sv. 1. London: Academic Press. str. 345–379.
- ^ McDougal, N. T .; Shaus, S.E. (září 2003). „Asymetrické Morita-Baylis-Hillmanovy reakce katalyzované chirálními Brøststedovými kyselinami“. J. Am. Chem. Soc. 125 (40): 12094–12095. doi:10.1021 / ja037705w. PMID 14518986.
- ^ Wenzel, A. G .; Jacobsen, E. N. (2002). „Asymetrické katalytické Mannichovy reakce katalyzované deriváty močoviny: enantioselektivní syntéza β-aryl-β-aminokyselin“. J. Am. Chem. Soc. 124 (44): 12964–12965. doi:10.1021 / ja028353g.
- ^ Yamamoto, H .; Momiyama, N. (září 2004). „Bronstedova kyselá katalýza achirálních enaminů pro regio- a enantioselektivní nitroso-aldolovou syntézu“. J. Am. Chem. Soc. 127 (4): 1080–1081. doi:10.1021 / ja0444637. PMC 1460970. PMID 15669829.
- ^ Hine, J .; Linden, S. M .; Kanagasabapathy, V. M. (prosinec 1985). „Katalýza dvojné vodíkové vazby reakce fenylglycidyletheru s diethylaminem 1,8-bifenylenediolem“. J. Org. Chem. 50 (25): 5096–5099. doi:10.1021 / jo00225a021.
- ^ Uyeda, C .; Jacobsen, E. N. (červenec 2008). „Enantioselektivní Claisenovy přesmyky s katalyzátorem donoru vodíkové vazby“. J. Am. Chem. Soc. 130 (29): 9228–9229. doi:10.1021 / ja803370x. PMC 2547484. PMID 18576616.
- ^ Rawal, Viresh H .; Thadani, A.N .; Stankovich, A.R. (2004). „Enantioselektivní Diels-Alderovy reakce katalyzované vodíkovou vazbou“. PNAS. 101 (16): 5846–5850. Bibcode:2004PNAS..101.5846T. doi:10.1073 / pnas.0308545101. PMC 395998. PMID 15069185.
- ^ Schmidtchen, F. P .; Berger, M. (srpen 1997). "Umělé organické hostitelské molekuly pro anionty". Chem. Rev. 97 (5): 1609–1646. doi:10.1021 / cr9603845.
- ^ Raheem, I. T .; Thiara, P. S .; Peterson, E. A .; Jacobsen, E. N. (srpen 2007). "Enantioselektivní Pictet-Spenglerův typ cyklizace hydroxylaktamů: H-Bond donorová katalýza vázáním aniontů". J. Am. Chem. Soc. 129 (44): 13404–13405. doi:10.1021 / ja076179w. PMID 17941641.
- ^ Reisman, S.E .; Doyle, A. G. (květen 2008). „Enantioselektivní thiomočovinou katalyzované přísady k oxokarbeniovým iontům“. J. Am. Chem. Soc. 130 (23): 7198–7199. doi:10,1021 / ja801514m. PMC 2574628. PMID 18479086.
- ^ Zuend, S. J .; Jacobsen, E. N. (září 2009). „Mechanismus amido-thiomočoviny katalyzované enantioselektivní iminové hydrokyanace: stabilizace přechodového stavu prostřednictvím více nekovalentních interakcí“. J. Am. Chem. Soc. 131 (42): 15358–15374. doi:10.1021 / ja9058958. PMC 2783581. PMID 19778044.
- ^ Uraguchi, D .; Terada, M. (duben 2004). „Chirální Bronstedova kyselina katalyzovaná přímá Mannichova reakce prostřednictvím elektrofilní aktivace“. J. Am. Chem. Soc. 126 (17): 5356–5357. doi:10.1021 / ja0491533. PMID 15113196.
- ^ Jansen, A. C. A .; Brussee, J. (květen 1983). "Vysoce stereoselektivní syntéza s (-) - [1,1'-binaftalen] -2,2'-diolu". Tetrahedron Lett. 24 (31): 3261–3262. doi:10.1016 / S0040-4039 (00) 88151-4.
- ^ Lee, A .; Stewart, J. D .; Clardy, J .; Ganem, B. (duben 1995). „Nový pohled na katalytický mechanismus chorismát mutáz ze strukturálních studií“. Chemie a biologie. 2 (4): 195–203. doi:10.1016/1074-5521(95)90269-4. PMID 9383421.
- ^ Knowles, R. R .; Lin, S .; Jacobsen, E. N. (duben 2010). „Enantioselektivní thiomočovinou katalyzované kationtové polycyklizace“. J. Am. Chem. Soc. 132 (14): 5030–5032. doi:10.1021 / ja101256v. PMC 2989498. PMID 20369901.
- ^ Wang, B .; Wu, F .; Wang, Y .; Liu, X .; Deng, L. (leden 2007). "Kontrola diastereoselektivity v tandemových asymetrických reakcích generujících nesousedící stereocentra s bifunkční katalýzou cinchonskými alkaloidy". J. Am. Chem. Soc. 129 (4): 768–769. doi:10.1021 / ja0670409. PMID 17243806.
- ^ Wennemers, Helma (2011). "Asymetrická katalýza s peptidy". Chem. Commun. 47: 12036–12041. doi:10.1039 / C1CC15237H.
- ^ Dalko, P. I. (2007). Enantioselektivní organokatalýza. Weinheim: Wiley-VCH. ISBN 978-3-527-31522-2.
- ^ Xu, Weici; Arieno, Marcus; Löw, Henrik; Huang, Kaifang; Xie, Xiulan; Cruchter, Thomas; Ma, Qiao; Xi, Jianwei; Huang, Biao; Wiest, Olaf; Gong, Lei (20. července 2016). „Metal-Templated Design: Enantioselective Hydrogen-Bond-Driven Catalysis Requiring Only Parts-per-Million Catalyst Load“. Journal of the American Chemical Society. 138 (28): 8774–8780. doi:10.1021 / jacs.6b02769. ISSN 0002-7863.
- ^ Schreiner, Peter R. (2003). „Organokatalýza bez obsahu kovů prostřednictvím explicitních interakcí s vodíkovými vazbami“. Chem. Soc. Rev. 32 (5): 289–296. doi:10.1039 / B107298F. PMID 14518182.
- ^ Jacobsen, E. N. „Asymetrická katalýza s donory chirálních H-vazeb“ (PDF). Citováno 18. prosince 2012.
- ^ Jacobsen, E. N .; Dustin, J. M .; Zuend, S. J. (listopad 2008). "Katalytická asymetrická celková syntéza (+) - yohimbin". Org. Lett. 10 (5): 745–748. doi:10.1021 / ol702781q. PMID 18257582.
- ^ Takemoto, Yoshiji; Miyabe, H. (červenec 2008). „Objev a aplikace asymetrické reakce multifunkčními thiomočovinami“. Býk. Chem. Soc. Jpn. 81 (7): 785–795. doi:10,1246 / bcsj.81.785.
- ^ Zuend, S. J .; Coughlin, M. P .; Lalonde, M. P .; Jacobsen, E. N. (říjen 2009). „Škálovatelné [sic] katalytické asymetrické Streckerovy syntézy nepřirozených alfa-aminokyselin“. Příroda. 461 (7266): 968–970. Bibcode:2009Natur.461..968Z. doi:10.1038 / nature08484. PMC 2778849. PMID 19829379.
