Erytropoetická protoporfyrie - Erythropoietic protoporphyria
tento článek vyžaduje pozornost odborníka na patologii. (Březen 2011) |
| Erytropoetická protoporfyrie | |
|---|---|
| Ostatní jména | EPP[1] |
 | |
| Chronické kožní léze EPP | |
| Specialita | Endokrinologie, dermatologie |
| Rizikové faktory | bolest a podráždění |
Erytropoetická protoporfyrie je forma porfyrie, jehož závažnost se liší a může být velmi bolestivá. Vzniká nedostatkem enzymu ferrochelatase, což vede k neobvykle vysoké úrovni protoporfyrin v červené krvinky (erytrocyty), plazma, kůže a játra.[2] Závažnost se u jednotlivců významně liší.
V roce 2008 byla identifikována klinicky podobná forma porfyrie, známá jako dominantní protoporfyrie spojená s X.[3]
Prezentace
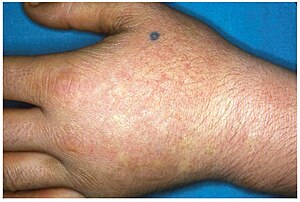
EPP se v dětství obvykle projevuje nejběžnějším způsobem prezentace jako akutní fotocitlivost kůže. Ovlivňuje oblasti vystavené slunci a má tendenci být neřešitelná. Několik minut vystavení slunci vyvolává svědění, zarudnutí, otoky a bolest. Delší období expozice může způsobit popáleniny druhého stupně. Po opakované expozici se u pacientů může objevit lichenifikace, hypopigmentace, hyperpigmentace a zjizvení kůže.[4][5]
EPP se obvykle poprvé projeví v dětství a nejčastěji postihuje obličej a horní povrchy paží, rukou a nohou a exponované povrchy nohou. Většina pacientů, pokud není EPP tak závažná, projevuje příznaky s nástupem puberty, když se během pohlavního vývoje a údržby zvyšuje hladina mužského a ženského hormonu. Závažnější EPP se může projevit v kojeneckém věku. EPP může být spuštěn vystavením slunci, i když je pacient za sklem. Je známo, že emise UV záření z obloukového svařování s použitím plné ochranné masky spouštějí EPP. EPP se také může projevit ve věku od 3 do 6 let.
Dlouhodobé vystavení slunci může vést k otokům rukou, obličeje a nohou, zřídka s puchýři a petechiemi. Někdy může dojít k zesílení kůže.
Lidé s EPP jsou také vystaveni zvýšenému riziku rozvoje žlučové kameny.[6] Jedna studie poznamenala, že pacienti s EPP trpí nedostatkem vitaminu D.[7]
Selhání jater
Protoporfyrin se hromadí na toxické hladiny v játrech u 5–20% pacientů s EPP, což vede k selhání jater. Spektrum hepatobiliárních onemocnění spojených s EPP je široké. Zahrnuje cholelitiázu, mírné parenchymální onemocnění jater, progresivní hepatocelulární onemocnění a konečné onemocnění jater.[4]
Nedostatek diagnostických markerů selhání jater ztěžuje předvídání, u kterých pacientů může dojít k selhání jater, a mechanismus selhání jater není dobře znám. Retrospektivní evropská studie identifikovala 31 pacientů s EPP, kteří podstoupili transplantaci jater v letech 1983 až 2008, s fototoxickými reakcemi u 25% pacientů, kteří nebyli chráněni chirurgickými světelnými filtry. Stejná studie zaznamenala 69% recidivu onemocnění v naroubovaném orgánu. V letech 1987 až 2009 bylo identifikováno pět britských transplantací jater pro EPP. U pacientů s EPP, u kterých dosud nebyla identifikována žádná účinná léčba k léčbě selhání jater, se doporučuje časté jaterní testování.[Citace je zapotřebí ]
Těhotenství
Uvádí se, že příznaky fotocitlivosti EPP u některých pacientek během těhotenství a menstruace ustupují, i když tento jev není konzistentní a mechanismus není znám.[8]
Genetika
Většina případů EPP je výsledkem vrozených chyb metabolismu[2] ale u některých pacientů může dojít k metabolickému defektu.[9] Mutace genu, který kóduje ferrochelatázu v dlouhém rameni chromozomu 18, se vyskytuje ve většině případů. Ferrochelatáza (FECH) katalyzuje vložení železného železa do kruhu protoporfyrinu IX za vzniku hemu. EPP vykazuje jak recesivní, tak dominantní vzorce dědičnosti a vysoký stupeň alelické heterogenity s neúplnou penetrancí. Většina heterozygotů je asymptomatická. Příznaky se neobjevují, pokud aktivita FECH není nižší než 30% normální hodnoty, ale u většiny pacientů nejsou tyto nízké hladiny přítomny.[10]
Patofyziologie
Buňky, které syntetizují hem, jsou převážně erytroblasty / retikulocyty v kostní dřeni (80%) a hepatocytech (20%). Nedostatek FECH má za následek zvýšené uvolňování protoporfyrinu, který se váže na albumin v plazmě a následně podléhá jaterní extrakci. Obvykle se většina protoporfyrinu v hepatocytech vylučuje do žluči; zbytek prochází transformací na hem. Část protoporfyrinu ve žluči se vrací do jater v důsledku enterohepatální cirkulace; zbývající protoporfyrin ve střevě se vylučuje stolicí. Protoporfyrin je nerozpustný, a proto není k dispozici pro vylučování ledvinami. V EPP vede subnormální biotransformace protoporfyrinu na hem k akumulaci protoporfyrinu v hepatocytech.[11]
Protože nedostatek FECH je spojen se zvýšenými koncentracemi protoporfyrinu v erytrocytech, plazmě, kůži a játrech, je retence protoporfyrinu v kůži náchylná k akutní fotocitlivosti. V důsledku absorpce ultrafialového a viditelného světla (maximální citlivost při 400 nm, s menšími vrcholy mezi 500-625 nm[12]) protoporfyrinem v plazmě a erytrocytech, když krev cirkuluje dermálními cévami, vytvářejí se volné radikály, erytrocyty jsou nestabilní a dochází k poškození kůže.[4]
Významné zvýšení hepatobiliárního vylučování protoporfyrinu může poškodit játra jak cholestatickými jevy, tak oxidačním stresem[11] - predispozice k hepatobiliárnímu onemocnění různého stupně závažnosti[13][14]
Diagnóza
EPP je obecně podezřelý z přítomnosti akutní fotocitlivosti kůže a lze jej potvrdit detekcí píku plazmatické fluorescence při 634 nm. Je také užitečné najít zvýšené hladiny protoporfyrinu ve stolici a prokázat nadbytek volného protoporfyrinu v erytrocytech.[15]
Screening pro FECH může být užitečná mutace na jedné alele nebo mutace zesílení funkce syntázy aminolevulové 2 u vybraných členů rodiny, zejména v genetickém poradenství.
Biopsie jater potvrzuje onemocnění jater v EPP přítomností depozitů protoporfyrinu v hepatocytech, které lze pozorovat jako hnědý pigment v žlučových kanálech a portálních makrofázích. Makroskopicky může mít cirhotická játra černou barvu v důsledku usazování protoporfyrinu. Pomocí polarizovaného světla je nalezen charakteristický maltský křížový tvar dvojlomných krystalických pigmentových depozit. Vyšetření jaterní tkáně pod a Woodova lampa odhaluje červenou fluorescenci v důsledku protoporfyrinu. Biopsie jater není užitečná pro odhad prognózy onemocnění jater.[13]
Léčba
Na tuto poruchu neexistuje lék; příznaky však lze obvykle zvládnout omezením expozice dennímu slunci a některým druhům umělého osvětlení. Většina typů umělého osvětlení vyzařuje světlo v problematických vlnových délkách, přičemž nejhorším pachatelem je zářivkové osvětlení. Teplota barvy může být dobrým indikátorem toho, jaké světlo je nejškodlivější, protože čím vyšší je teplota barev, tím více je vyzařováno fialové světlo (380-450 nm). Žárovka a LED osvětlení v oblasti měkké bílé (2700 - 3000 K) produkují nejméně problematické světlo. Navíc výběr žárovek s nižším výkonem může snížit celkový výkon světla.
Protože fotocitlivost je výsledkem světla ve viditelném spektru opalovací krémy jsou málo užitečné (s výjimkou non-nano oxid zinečnatý který poskytuje jednotnou ochranu mezi 290–400 nm a určitou ochranu až do 700 nm[16]). Ochranný oděv proti slunci může být také velmi užitečné, ačkoli oblečení s hodnotami UPF se hodnotí pouze na základě jejich UV ochrany (do 400 nm) a nikoli na základě jejich ochrany před viditelným spektrem. Někteří výrobci slunečních ochranných oděvů používají ve svých tkaninách oxid zinečnatý, například řada ZnO Suntect od společnosti Coolibar, která poskytuje ochranu před viditelným světlem.
Někteří pacienti postupně vytvářejí ochrannou vrstvu melanin pravidelným krátkodobým vystavováním ultrafialovému záření.[Citace je zapotřebí ]
Okenní fólie, které blokují UV a viditelné světlo až do 450 nm, mohou poskytnout úlevu od příznaků, pokud se aplikují na okna automobilu a domácnosti pacienta. Příkladem toho může být Madico Amber 81 které mohou chránit v rozsahu 500 nm.
Chrániče obrazovky s modrým blokováním mohou pomoci zmírnit příznaky způsobené televizory, telefony, tablety a obrazovkami počítačů.
EPP je považován za jeden z nejméně závažných porfyrií. Pokud nedojde k selhání jater, nejedná se o život ohrožující onemocnění.
Schválené terapie
Afamelanotid, vyvinutý společností Clinuvel Pharmaceuticals se sídlem v Austrálii, byl v Evropě schválen v prosinci 2014 pro léčbu nebo prevenci fototoxicity u dospělých pomocí EPP.[17]
Použití mimo označení
Používá se několik léků mimo označení pacienty s EPP:
- Kyselina ursodeoxycholová je žlučová kyselina který se podává k podpoře biliární sekrece protoporfyrinu. Výsledky jeho použití v EPP jsou kontroverzní. Je však známo, že mění složení žluči, chrání hepatocyty před cytotoxickým účinkem hydrofobních žlučových kyselin a stimuluje sekreci žlučí několika odlišnými mechanismy.[18][19]
- Hematin Zdá se, že snižuje nadměrnou produkci protoporfyrinu v kostní dřeni. Podává se pacientům s EPP (3–4 mg / kg iv), u kterých se po transplantaci jater objeví krize.[20]
- Plazmaferéza může také snížit hladinu protoporfyrinu v plazmě, jeho použití při léčbě akutních epizod je však kontroverzní.[21]
- Cholestyramin je podáván orálně pryskyřice který redukuje cirkulující hladiny protoporfyrinu vazbou na protoporfyrin ve střevě, a tím přerušuje enterohepatální cirkulaci. Obvykle se používá v kombinaci s jinými přístupy k léčbě.[22]
- Aktivní uhlíse podobně jako cholestyramin váže na protoporfyrin ve střevě a brání jeho absorpci. Je levný a snadno dostupný. Zdá se, že je efektivní při snižování cirkulujících hladin protoporfyrinu.[23]
Transplantace kostní dřeně, transplantace jater, acetylcystein extrakorporální albumin dialýza, parenterální podávání železa a transfuze erytrocytů jsou alternativní plány léčby EEP.
OTC doplňky
Některé doplňky dostupné na prodej mohou pomoci:
- Proferrin je orální doplněk hemu, který může fungovat podobně jako Hematin.
- B. subtilis (grampozitivní půdní probiotikum) produkuje ferrochelatasu,[24] který může být schopen převést část protoporfyrinu ve střevě na hem.
- Beta karoten, ačkoli nedávná metaanalýza léčby karotenem zpochybnila jeho účinnost.[25]
Epidemiologie
Případové zprávy naznačují, že EPP je celosvětově převládající. The prevalence se odhaduje někde mezi 1 ze 75 000 a 1 z 200 000[26] bylo však poznamenáno, že prevalence EPP se může zvyšovat kvůli lepšímu pochopení nemoci a lepší diagnostice.[27] Odhaduje se, že na celém světě má EPP 5 000–10 000 osob.[nutná lékařská citace ] EPP je považována za nejběžnější formu porfyrie u dětí.[28] Prevalence ve Švédsku byla publikována jako 1: 180 000.[29]
Dějiny
Erytropoetická protoporfyrie byla poprvé popsána v roce 1953 Kosenowem a Treibsem[30] a dokončena v roce 1960 Magnusem et al. na St John's Dermatology Institute v Londýně.[31]
Viz také
Reference
- ^ VYHRAZENO, VLOŽTE NÁS 14-- VŠECHNA PRÁVA. „Orphanet: Autosomal erythropoietic protoporphyria“. orpha.net. Citováno 17. dubna 2019.
- ^ A b Casanova-González, María José; Trapero-Marugán, María; Jones, E. Anthony; Moreno-Otero, Ricardo (2010-09-28). „Onemocnění jater a erytropoetická protoporfyrie: stručný přehled“. World Journal of Gastroenterology. 16 (36): 4526–4531. doi:10,3748 / wjg.v16.i36.4526. ISSN 2219-2840. PMC 2945483. PMID 20857522.
- ^ Seager, M. J .; Whatley, S. D .; Anstey, A. V .; Millard, T. P. (2014). „Dominantní protoporfyrie vázaná na X: Nová porfyrie“. Klinická a experimentální dermatologie. 39 (1): 35–7. doi:10.1111 / ced.12202. PMID 24131146.
- ^ A b C Tsuboi, Hiromi; Yonemoto, Kohzoh; Katsuoka, Kensei (01.11.2007). „Erytropoetická protoporfyrie s očními komplikacemi“. The Journal of Dermatology. 34 (11): 790–794. doi:10.1111 / j.1346-8138.2007.00386.x. ISSN 0385-2407. PMID 17973823.
- ^ Poh-Fitzpatrick, M. B. (01.06.186). "Molekulární a buněčné mechanismy fotosenzitizace porfyrinu". Fotodermatologie. 3 (3): 148–157. ISSN 0108-9684. PMID 3529055.
- ^ 12-160 d. na Příručka společnosti Merck pro diagnostiku a terapii Domácí edice
- ^ Špalda, JM; De Rooij, FW; Wilson, JH; Zandbergen, AA (2010). "Nedostatek vitaminu D u pacientů s erytropoetickou protoporfyrií". Journal of Inherited Metabolic Disease. 33 Suppl 3: S1–4. doi:10.1007 / s10545-008-1037-0. PMID 24137761. S2CID 22847583.
- ^ Wahlin, S .; Marschall, H.-U .; Fischler, B. (2013). „Výsledek pro matku a plod u švédských žen s erytropoetickou protoporfyrií“. British Journal of Dermatology. 168 (6): 1311–5. doi:10.1111 / bjd.12242. PMID 23738640.
- ^ Blagojevic, Daniel; Schenk, Thomas; Haas, Oskar; Zierhofer, Brigitte; Konnaris, Christophoros; Trautinger, Franz (2009). „Získaná erytropoetická protoporfyrie“. Annals of Hematology. 89 (7): 743–4. doi:10.1007 / s00277-009-0859-7. PMID 19902211. S2CID 36170513.
- ^ Kong, Xiao-Fei; Ye, Jing; Gao, De-Yong; Gong, Qi-Ming; Zhang, Dong-Hua; Lu, Zhi-Meng; Lu, Yi-Ming; Zhang, Xin-Xin (2008-02-01). "Identifikace mutace ferrochelatázy v čínské rodině s erytropoetickou protoporfyrií". Journal of Hepatology. 48 (2): 375–379. doi:10.1016 / j.jhep.2007.09.013. ISSN 0168-8278. PMID 18160121.
- ^ A b Holme, S. Alexander; Worwood, Mark; Anstey, Alexander V .; Elder, George H .; Badminton, Michael N. (01.12.2007). "Erytropoéza a metabolismus železa v dominantní erytropoetické protoporfyrii". Krev. 110 (12): 4108–4110. doi:10.1182 / krev-2007-04-088120. ISSN 0006-4971. PMID 17804693.
- ^ Magnus, I. A. (únor 1968). „Fotobiologické aspekty porfyrie“. Sborník Královské lékařské společnosti. 61: 196–198. doi:10.1177/003591576806100233. PMID 5688974.
- ^ A b Lecha, Mario; Puy, Hervé; Deybach, Jean-Charles (01.01.2009). "Erythropoietic protoporphyria". Orphanet Journal of Rare Diseases. 4: 19. doi:10.1186/1750-1172-4-19. ISSN 1750-1172. PMC 2747912. PMID 19744342.
- ^ Bruguera, M .; Herrero, C. (2005-12-01). "[Onemocnění jater v erytropoetické protoporfyrii]". Gastroenterología y Hepatología. 28 (10): 632–636. doi:10.1016 / s0210-5705 (05) 71529-6. ISSN 0210-5705. PMID 16373015.
- ^ Anstey, A. V .; Hift, R. J. (01.07.2007). „Onemocnění jater v erytropoetické protoporfyrii: pohledy a důsledky pro management“. Střevo. 56 (7): 1009–1018. doi:10.1136 / gut.2006.097576. ISSN 0017-5749. PMC 1994365. PMID 17360790.
- ^ "Oxid zinečnatý - fyzikální UVA + UVB opalovací krém / krém". smartskincare.com. Citováno 2019-04-02.
- ^ „Registr humánních léčivých přípravků ve Společenství“. http://ec.europa.eu. Evropská komise. Citováno 24. prosince 2014. Externí odkaz v
| web =(Pomoc) - ^ Pirlich, M .; Lochs, H .; Schmidt, H. H. (2001-12-01). „Cirhóza jater v erytropoetické protoporfyrii: zlepšení funkce jater kyselinou ursodeoxycholovou“. The American Journal of Gastroenterology. 96 (12): 3468–3469. ISSN 0002-9270. PMID 11774991.
- ^ Paumgartner, Gustav; Beuers, Ulrich (01.09.2002). „Kyselina ursodeoxycholová při cholestatickém onemocnění jater: mechanismy účinku a terapeutické použití znovu navštíveny“. Hepatologie. 36 (3): 525–531. doi:10.1053 / jhep.2002.36088. ISSN 0270-9139. PMID 12198643.
- ^ Potter, C .; Tolaymat, N .; Bobo, R .; Sharp, H .; Rank, J .; Bloomer, J. (01.11.1996). "Hematinová terapie u dětí s protoporfyrickým onemocněním jater". Journal of Pediatric Gastroenterology and Nutrition. 23 (4): 402–407. doi:10.1097/00005176-199611000-00006. ISSN 0277-2116. PMID 8956175.
- ^ Tung, B. Y .; Farrell, F. J .; McCashland, T. M .; Gish, R. G .; Bacon, B. R .; Keeffe, E. B .; Kowdley, K.V. (1999-09-01). „Dlouhodobé sledování po transplantaci jater u pacientů s přetížením železa v játrech“. Transplantace jater a chirurgie. 5 (5): 369–374. doi:10,1002 / lt. 5 00050503. ISSN 1074-3022. PMID 10477837.
- ^ McCullough, A. J .; Barron, D .; Mullen, K. D .; Petrelli, M .; Park, M. C .; Mukhtar, H .; Bickers, D. R. (01.01.1988). „Fekální vylučování protoporfyrinu v erytropoetické protoporfyrii: účinek podávání cholestyraminu a žlučových kyselin“. Gastroenterologie. 94 (1): 177–181. doi:10.1016/0016-5085(88)90627-0. ISSN 0016-5085. PMID 3335288.
- ^ Gorchein, A .; Foster, G. R. (01.03.1999). „Selhání jater v protoporfyrii: dlouhodobá léčba perorálním uhlím“. Hepatologie. 29 (3): 995–996. doi:10,1002 / hep 510290314. ISSN 0270-9139. PMID 10189233.
- ^ Hansson, M .; Hederstedt, L. (1994-02-15). "Čištění a charakterizace ve vodě rozpustné ferrochelatázy z Bacillus subtilis". European Journal of Biochemistry. 220 (1): 201–208. doi:10.1111 / j.1432-1033.1994.tb18615.x. ISSN 0014-2956. PMID 8119288.
- ^ Minder, EI; Schneider-Yin, X; Steurer, J; Bachmann, LM (2009). "Systematický přehled možností léčby dermální fotocitlivosti v erytropoetické protoporfyrii". Buněčná a molekulární biologie. 55 (1): 84–97. PMID 19268006.
- ^ Arceci, Robert .; Hann, Ian M .; Smith, Owen P. (2006). Dětský hematolog. Malden, Massachusetts: Blackwell Pub. ISBN 978-1-4051-3400-2.[stránka potřebná ]
- ^ Elder, George; Harper, Pauline; Badminton, Michael; Sandberg, Sverre; Deybach, Jean-Charles (2012). „Výskyt zděděných porfyrií v Evropě“. Journal of Inherited Metabolic Disease. 36 (5): 849–57. doi:10.1007 / s10545-012-9544-4. PMID 23114748. S2CID 20442163.
- ^ Michaels, BD; Del Rosso, JQ; Mobini, N; Michaels, JR (2010). „Erytropoetická protoporfyrie: kazuistika a přehled literatury“. The Journal of Clinical and Esthetic Dermatology. 3 (7): 44–8. PMC 2921755. PMID 20725556.
- ^ Wahlin, S .; Floderus, Y .; Stål, P .; Harper, P. (2011). „Erytropoetická protoporfyrie ve Švédsku: Demografické, klinické, biochemické a genetické vlastnosti“. Journal of Internal Medicine. 269 (3): 278–88. doi:10.1111 / j.1365-2796.2010.02236.x. PMID 20412370.
- ^ Kosenow, W; Treibs, A (1953). "Přecitlivělost na světlo a porfyrinémie". Zeitschrift für Kinderheilkunde. 73 (1): 82–92. doi:10.1007 / BF00438257. PMID 13103364. S2CID 46459771.
- ^ Magnus, já; Jarrett, A; Prankerd, TA; Rimington, C (1961). „Erythropoietic protoporphyria. New porphyria syndrom with solar urticaria due to protoporphyrinæmia“. Lancet. 278 (7200): 448–51. doi:10.1016 / S0140-6736 (61) 92427-8. PMID 13765301.
externí odkazy
- Erytropoetická protoporfyrie na NLM Genetická domácí reference
| Klasifikace | |
|---|---|
| Externí zdroje |
