Diethylazodikarboxylát - Diethyl azodicarboxylate
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Diethyl diazendikarboxylát | |
| Ostatní jména | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.016.202 |
| Číslo ES |
|
PubChem CID | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C6H10N2Ó4 | |
| Molární hmotnost | 174.156 g · mol−1 |
| Vzhled | Oranžová až červená až oranžová kapalina[2] |
| Hustota | 1,11 g / cm3[3] |
| Bod tání | 6 ° C (43 ° F; 279 K)[4] |
| Bod varu | 104,5 ° C (220,1 ° F; 377,6 K) při 12 mm Hg[3] |
Index lomu (nD) | 1,420 (20 ° C)[3] |
| Nebezpečí | |
| Bezpečnostní list | Externí bezpečnostní list |
| Piktogramy GHS |   |
| Signální slovo GHS | Nebezpečí |
| H240, H302, H312, H315, H319, H332, H335 | |
| P210, P220, P234, P261, P264, P270, P271, P280, P301 + 312, P302 + 352, P304 + 312, P304 + 340, P305 + 351 + 338, P312, P321, P322, P330, P332 + 313, P337 + 313, P362, P363, P370 + 378, P370 + 380 + 375, P403 + 233, P403 + 235 | |
| Bod vzplanutí | 85 ° C (185 ° F; 358 K)[5] |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
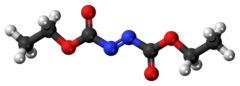
Diethylazodikarboxylát, obvykle zkráceně DEAD a někdy DEADCAT,[6][7] je organická sloučenina se strukturním vzorcem CH3CH2Ó2CN = NCO2CH2CH3. Jeho molekulární struktura se skládá z centrální azo funkční skupina, RN = NR, lemovaný dvěma ethyly ester skupiny. Tato oranžově červená kapalina je cenné činidlo, ale také velmi nebezpečné a při zahřívání exploduje. Proto je komerční přeprava čistého diethylazodikarboxylátu ve Spojených státech zakázána a provádí se buď v roztoku, nebo polystyren částice.
DEAD je aza-dienophile a účinné dehydrogenační činidlo konvertující alkoholy na aldehydy, thioly do disulfidy a hydrazoskupiny do azoskupiny; je také dobrým akceptorem elektronů. Zatímco DEAD se používá v mnoha chemických reakcích, je většinou známý jako klíčová složka Mitsunobuova reakce, společná strategie pro přípravu aminu, azidu, etheru, thioetheru nebo esteru z odpovídajícího alkoholu.[8] Používá se při syntéze různých přírodních produktů a léčiv, jako je zidovudin, an AIDS lék; FdUMP silné protinádorové činidlo; a prokarbazin, lék na chemoterapii.
Vlastnosti
DEAD je oranžovo-červená kapalina, která po zředění nebo chemické reakci zeslabuje svou barvu na žlutou nebo bezbarvou. Tato změna barvy se běžně používá pro vizuální sledování syntézy. DEAD se rozpouští ve většině běžných organických rozpouštědel, jako je toluen, chloroform, ethanol,[9] tetrahydrofuran a dichlormethan[3][10] ale má nízkou rozpustnost ve vodě nebo chlorid uhličitý; rozpustnost ve vodě je vyšší pro příbuznou azosloučeninu dimethyl azodikarboxylát.[4]
DEAD je silný akceptor elektronů a snadno oxiduje roztok jodid sodný v ledové octová kyselina. Rovněž energicky reaguje s hydrazin hydrát výroba diethylhydrazodikarboxylátu a vývoj dusíku. Lineární kombinace molekulárních orbitálních metod atomových orbitalů Výpočty (LCAO-MO) naznačují, že molekula DEAD je neobvyklá v tom, že má vysoko položenou prázdnou vazebnou dráhu, a proto má tendenci odebírat atomy vodíku z různých donorů vodíku. Fotoasistované odstraňování vodíku pomocí DEAD bylo prokázáno pro isopropylalkohol, což má za následek pinacol a tetraethyl tetrazanetetrakarboxylát, a pro acetaldehyd poddajný diacetyl a diethylhydrazodikarboxylát. Podobně reakce DEAD s ethanolem a cyklohexanol abstrahuje od výroby vodíku acetaldehyd a cyklohexanon. Tyto reakce také probíhají bez světla, i když při mnohem nižších výtěžcích.[9]DEAD je tedy obecně aza-dienophile a dehydrogenační činidlo, konvertující alkoholy na aldehydy, thioly na disulfidy a hydrazo skupiny do azoskupiny.[11] Také prochází pericyklické reakce s alkeny a dienes přes Ene a Diels – Olše mechanismy.[12]
Příprava
I když je komerčně dostupný, diethylazodikarboxylát lze připravit čerstvý v laboratoři, zejména je-li to nutné v čisté, neředěné formě. Dvoustupňová syntéza začíná od hydrazin, nejprve alkylace s ethylchlorformiát s následným zpracováním výsledného diethylhydrazodikarboxylátu s chlór (probublávání roztokem), kyselina chlorná, koncentrovaný kyselina dusičná nebo červená dýmavá kyselina dusičná. Reakce se provádí v ledové lázni a reakční činidla se přidávají po kapkách, aby teplota nezvýšila nad 20 ° C. Diethylhydrazodikarboxylát je pevná látka s teplotou tání 131–133 ° C, která se izoluje jako zbytek; je výrazně stabilnější vůči zahřátí než DEAD a běžně se suší při teplotě přibližně 80 ° C.[4][13]
Aplikace
Mitsunobuova reakce
DEAD je a činidlo v Mitsunobuova reakce kde tvoří adukt s fosfiny (obvykle trifenylfosfin ) a podporuje syntézu esterů, etherů, aminů a thioetherů z alkoholů. Reakce obvykle vedou k inverze molekulární symetrie.
DEAD byl použit v původním článku z roku 1967 Oyo Mitsunobu,[14] a jeho recenze z roku 1981 o použití diethylazodikarboxylátu je nejlépe citovaným článkem o chemii.[15][16] Mitsunobuova reakce má několik aplikací při syntéze přírodních produktů a farmaceutik.
Ve výše uvedené reakci, které je nápomocen buď DEAD nebo DIAD (diisopropylazodikarboxylát), thymidin 1 transformuje na derivát 2. Ten se snadno převádí na zidovudin 4 (také známý jako azidothymidin nebo AZT), důležitý antivirový lék, používaný mimo jiné při léčbě AIDS.[17][18][19] Dalším příkladem farmaceutické aplikace DEIT-asistované Mitsunobuovy reakce je syntéza bis [(pivaloyloxy) methyl [PIVz] derivátu 2’-deoxy-5-fluorouridinu 5’-monofosfátu (FdUMP), který je silným protinádorovým činidlem.[20]
Michaelova reakce
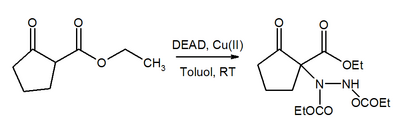
Azo skupina v DEAD je Michael akceptor. Za přítomnosti měďnatého katalyzátoru pomáhá DEAD konverzi β-ketoesterů na odpovídající deriváty hydrazinu.[21]
Nahrazení kyselina boritá estery probíhají podobně:[22]

Další reakce
DEAD je efektivní součást v Diels-Alderovy reakce a v klikněte na chemii například syntéza bicyklo [2.1.0] pentanu, který pochází z Otto Diels.[23] Používá se také ke generování aza-Baylis-Hillman adukty s akryláty.[24]
DEAD lze použít pro syntézu heterocyklické sloučeniny. Tím pádem, pyrazolin deriváty převádějí do kondenzace na α, β-nenasycené ketony:[25]

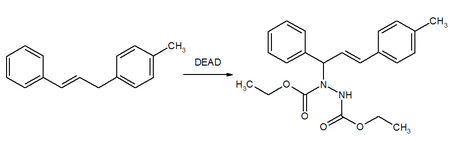
Další aplikací je použití DEAD jako enophile v ene reakcích:
Bezpečnost
DEAD je toxický, nárazový a citlivý na světlo; může prudce explodovat, když se jeho neředěná forma zahřeje nad 100 ° C.[2][3][26] Letecká přeprava čistého diethylazodikarboxylátu je ve Spojených státech zakázána a provádí se v roztoku, obvykle asi 40% DEAD v toluenu.[27] Alternativně je DEAD přepravován a skladován na 100–300 pletivo polystyren částice v koncentraci asi 1 mmol /G.[3] Časem vážený průměr prahová hodnota pro expozici DEAD během typického 40hodinového pracovního týdne je 50 dílů na milion; to znamená, že DEAD je z poloviny tak toxický jako např. kysličník uhelnatý.[28] Bezpečnostní rizika vedla k rychlému poklesu používání DEAD a jeho nahrazení DIAD a další podobné sloučeniny.
Reference
- ^ Diethylazodiformát. Webbook.nist.gov (1972-07-28). Citováno 2011-03-15.
- ^ A b Bezpečnostní údaje pro diethylazodikarboxylát. Msds.chem.ox.ac.uk. Citováno 2011-03-15.
- ^ A b C d E F W. L. F. Armarego; Christina Li Lin Chai (22. května 2009). Čištění laboratorních chemikálií. Butterworth-Heinemann. str. 124–. ISBN 978-1-85617-567-8. Citováno 12. března 2011.
- ^ A b C Kauer, J. C. "Diethylazodikarboxylát". Organické syntézy.; Kolektivní objem, 4, str. 411
- ^ L19348 Diethylazodikarboxylát, 97% - Alfa Aesar - A Johnson Matthey Company. Alfa.com (1972-07-28). Citováno 2011-03-15.
- ^ Caroline Cooper (23. července 2010). Referenční příručka pro organické chemiky. CRC Press. str. 109–. ISBN 978-1-4398-1164-1. Citováno 12. března 2011.
- ^ DEAD se někdy používá pro jinou chemickou látku, diethylacetylendikarboxylát. P. N. Preston (1980). Benzimidazoly a kongenerové tricyklické sloučeniny. John Wiley and Sons. str. 475–. ISBN 978-0-471-08189-0. Citováno 12. března 2011.
- ^ Barbara., Czakó (2009). Strategické aplikace pojmenovaných reakcí v organické syntéze: pozadí a podrobné mechanismy; 250 pojmenovaných reakcí. Elsevier. ISBN 9780123694836. OCLC 634820219.
- ^ A b Yoneda, Fumio; Suzuki, Kunio; Nitta, Yoshihiro (1967). "Nová reakce odcházející od vodíku s diethylazodikarboxylátem". The Journal of Organic Chemistry. 32 (3): 727–729. doi:10.1021 / jo01278a049. ISSN 0022-3263.
- ^ Kelmara K. Kelly (2009) Nové izotopové efekty a organické reakční mechanismy, Disertační práce, Texas A&M University, s. 81
- ^ Fumio Yoneda; Kunio Suzuki; Yoshihiro Nitta (1966). "Nová reakce abstrahující vodík s diethylazodikarboxylátem". J. Am. Chem. Soc. 88 (10): 2328. doi:10.1021 / ja00962a051.
- ^ Eric J. Stoner Amy C. Hart (2010). "Diethylazodikarboxylát". Encyclopedia of Reagents for Organic Synthesis, 8 Volume Set. Encyklopedie činidel pro organickou syntézu. doi:10.1002 / 047084289X.rd176.pub2. ISBN 978-0471936237.CS1 maint: používá parametr autoři (odkaz)
- ^ Rabjohn, N. (1948). "Diethylazodikarboxylát". Organické syntézy. 28: 58. doi:10.15227 / orgsyn.028.0058.
- ^ Mitsunobu, O .; Yamada, Y. (1967). „Příprava esterů karboxylových a fosforečných kyselin pomocí kvartérních fosfoniových solí“. Býk. Chem. Soc. Jpn. 40 (10): 2380–2382. doi:10,1246 / bcsj.40.2380.
- ^ Mitsunobu, Oyo (1981). „Využití diethylazodikarboxylátu a trifenylfosfinu při syntéze a přeměně přírodních produktů“. Syntéza. 1981: 1–28. doi:10.1055 / s-1981-29317.
- ^ Více než 4 300 citací do března 2011 podle Web vědy
- ^ Czernecki, Stanislas a Valery, Jean-marc „Proces přípravy AZT (3'-azido-3'-deoxythymidinu) a příbuzných sloučenin“ US patent 5,124,442 vydáno 23. června 1992
- ^ Czernecki, Stanislas; Valéry, Jean-Marc (1991). "Efektivní syntéza 3'-azido-3'-deoxythymidinu (AZT)". Syntéza. 1991 (3): 239. doi:10,1055 / s-1991-26434.
- ^ Dueholm, Kim L .; Aly, Youssef L .; Jørgensen, Per T .; El-Barbary, Ahmed A .; Pedersen, Erik B .; Nielsen, Claus (1993). "Konvergentní syntéza 2 ', 3'-dideoxy-3'-methylthio a 2', 3'-dideoxy-3'-merkapto nukleosidů a jejich disulfidových analogů - potenciální anti-HIV činidla". Monatshefte für Chemie - chemický měsíčník. 124: 37–53. doi:10.1007 / BF00808508.
- ^ Farquhar, David; Khan, Saeed; Srivastva, Devendra N .; Saunders, Priscilla P. (1994). „Syntéza a protinádorové hodnocení bis [(pivaloyloxy) methyl] 2'-deoxy-5-fluoruridin-5'-monofosfátu (FdUMP): Strategie zavedení nukleotidů do buněk“. Journal of Medicinal Chemistry. 37 (23): 3902–9. doi:10.1021 / jm00049a009. PMID 7966151.
- ^ Comelles, C .; et al. (2004). „Iontové a kovalentní měď (II) katalyzátory pro Michaelovy doplňky. Mechanismus“. J. Org. Chem. 69 (20): 6834–42. doi:10.1021 / jo049373z. PMID 15387609.
- ^ Takeshi Uemura; Naoto Chatani (2005). „Přidání arylboronových kyselin do azodikarboxylátů katalyzované solí mědi“. J. Org. Chem. 70 (21): 8631. doi:10.1021 / jo051387x. PMID 16209627.
- ^ Gassman PG, Mansfield KT (1969). „BICYKLO [2.1.0] PENTAN“. Organické syntézy. 49: 1. doi:10.15227 / orgsyn.049.0001. ISSN 0078-6209.
- ^ Shi, Min; Zhao, Gui-Ling (2004). „Aza-Baylis – Hillmanovy reakce diisopropylazodikarboxylátu nebo diethylazodikarboxylátu s akryláty a akrylonitrilem“. Čtyřstěn. 60 (9): 2083–2089. doi:10.1016 / j.tet.2003.12.059.
- ^ Vijay Nair; Smitha C. Mathew; Akkattu T. Biju; Eringathodi Suresh (2007). „Nová reakce„ Huisgen Zwitterion “s chalkony a dienony: efektivní strategie syntézy pyrazolinu a derivátů pyrazolopyridazinu. Angew. Chem. Int. Vyd. 46 (12): 2070–2073. doi:10.1002 / anie.200604025. PMID 17286329.
- ^ G. C. Barrett (1999). Deriváty aminokyselin: praktický přístup. Oxford University Press. str. 119–. ISBN 978-0-19-855853-8. Citováno 12. března 2011.
- ^ Diethylazodikarboxylát v chemické syntéze. Sigmaaldrich.com. Citováno 2011-03-15.
- ^ Livius Cotarca; Heiner Eckert (2004). Fosgenations - příručka. Wiley-VCH. p. 42. ISBN 978-3-527-29823-5. Citováno 12. března 2011.



