Zachycení konformace chromozomu - Chromosome conformation capture

Tento vědecký článek potřebuje další citace na sekundární nebo terciární zdroje (Dubna 2016) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
Zachycení konformace chromozomu techniky (často zkráceno na technologie 3C nebo metody založené na 3C[1]) jsou souborem metod molekulární biologie používaných k analýze prostorových organizace z chromatin v cele. Tyto metody kvantifikují počet interakcí mezi genomickými loci které jsou poblíž ve 3D prostoru, ale mohou být odděleny mnoha nukleotidy v lineárním genomu.[2] Takové interakce mohou být výsledkem biologických funkcí, jako jsou promotér -zesilovač interakce, nebo z náhodných polymerních smyček, kde neřízený fyzický pohyb chromatinu způsobí srážku lokusů.[3] Frekvence interakcí lze analyzovat přímo,[4] nebo mohou být převedeny na vzdálenosti a použity k rekonstrukci 3-D struktur.[5]
Hlavním rozdílem mezi metodami založenými na 3C je jejich rozsah. Například při použití PCR k detekci interakce v experimentu 3C jsou kvantifikovány interakce mezi dvěma specifickými fragmenty. Naproti tomu Hi-C kvantifikuje interakce mezi všemi možnými páry fragmentů současně. Hluboké sekvenování materiálu produkovaného 3C také vytváří mapy interakcí v celém genomu.
Dějiny
Historicky, mikroskopie byla primární metoda vyšetřování jaderná organizace,[6] který lze datovat do roku 1590.[7]

- V roce 1879 Walther Flemming vytvořil termín chromatin.[8]
- V roce 1883 August Weismann spojil chromatin s dědičností.
- V roce 1884 Albrecht Kossel objevené histony.
- V roce 1888 Sutton a Boveri navrhl teorii kontinuity chromatinu během buněčného cyklu [9]
- V roce 1889 Wilhelm von Waldemeyer vytvořil termín „chromozóm ".[10]
- V roce 1928 Emil Heitz vytvořil termín Heterochromatin a Euchromatin.[11]
- V roce 1942 Conrad Waddington postuloval epigenetické krajiny.[12]
- V roce 1948 Rollin Hotchkiss objevila methylaci DNA.[13]
- V roce 1953 Watson a Crick objevili strukturu dvojité šroubovice DNA.[14]
- V roce 1961 Mary Lyon postuloval princip X-inaktivace.
- V letech 1973/1974 bylo objeveno chromatinové vlákno.[12]
- V roce 1975 Pierre Chambon vytvořil termín nukleosomy.[12]
- V roce 1982 Chromozomová území byly objeveny.[15]
- V roce 1984 John T. Lis inovoval Chromatinová imunoprecipitace technika.
- V roce 1993 byl publikován Nuclear Ligation Assay, metoda, která mohla určit cirkulační frekvence DNA v roztoku. Tento test byl použit k prokázání toho estrogen vyvolává interakci mezi prolaktin promotor genů a blízký zesilovač.[16]
- V roce 2002 Job Dekker představil novou myšlenku, že k odvození prostorové organizace genomů lze použít husté matice frekvencí interakce mezi lokusy. Tato myšlenka byla základem pro jeho vývoj testu chromosomového konformačního zachycení (3C), publikovaného v roce 2002 Jobem Dekkerem a kolegy v laboratoři Kleckner v Harvardská Univerzita.[17][18]
- V roce 2003 Projekt lidského genomu byl hotový.
- V roce 2006 vynalezla Marieke Simonis 4C,[19] Dostie v laboratoři Dekker vynalezl 5C.[20]
- V roce 2007 inovoval B. Franklin Pugh techniku ChIP-seq.[21]
- V roce 2009 vynalezli Lieberman-Aiden a Job Dekker Hi-C,[22] Melissa J. Fullwood a Yijun Ruan vynalezli ChIA-PET.[23]
- V roce 2012 objevili skupina The Ren a skupiny vedené Edith Heardovou a Jobem Dekkerem topologicky sdružující domény (TAD) u savců.[24][25]
- V roce 2013 představili Takashi Nagano a Peter Fraser ligaci nukleů pro Hi-C a jednobuněčný Hi-C.[26]
Experimentální metody
Všechny metody 3C začínají podobnou sadou kroků prováděných na vzorku buněk.
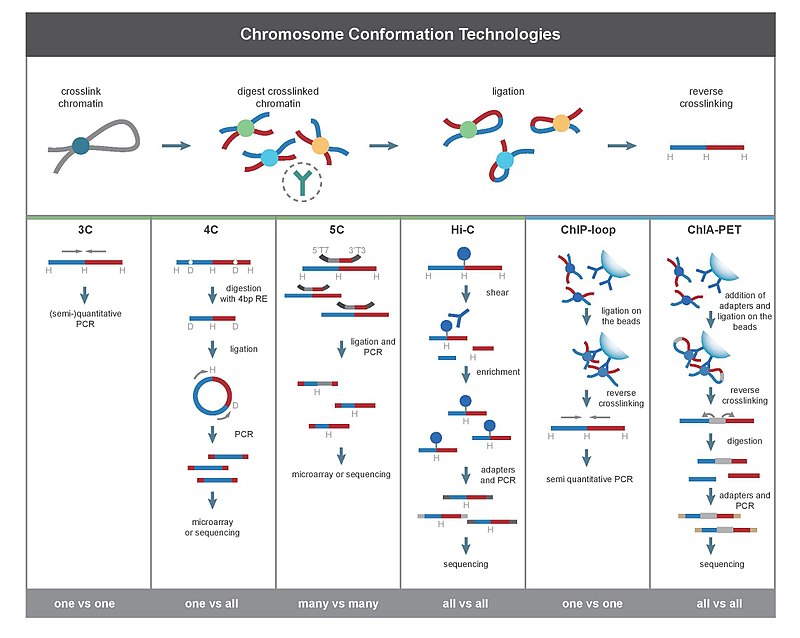
Za prvé, buněčné genomy jsou zesítěný s formaldehyd,[27] který zavádí vazby, které „zmrazí“ interakce mezi genomovými lokusy. Zpracování buněk 1-3% formaldehydem po dobu 10-30 minut při teplotě místnosti je nejběžnější, je však nezbytná standardizace pro prevenci vysokého zesítění protein-DNA, protože to může negativně ovlivnit účinnost restrikčního štěpení v následujícím kroku.[28] Genom je poté rozřezán na fragmenty pomocí a restrikční endonukleáza. Velikost restrikčních fragmentů určuje rozlišení mapování interakce. Restrikční enzymy (RE), které provádějí řezy na 6bp rozpoznávacích sekvencích, jako je např EcoR1 nebo HindIII, se k tomuto účelu používají, protože genom štěpí jednou za 4000 bp, což v lidském genomu dává ~ 1 milion fragmentů.[28][29] Pro přesnější mapování interakce lze také použít RE rozpoznávající 4 bp. Dalším krokem je, založené na blízkosti ligace. K tomu dochází při nízkých koncentracích DNA nebo v neporušených, permeabilizovaných jádrech[26] v přítomnosti T4 DNA ligáza,[30] taková, že je upřednostňována ligace mezi zesítěnými interagujícími fragmenty před ligací mezi fragmenty, které nejsou zesítěny. Následně jsou interagující lokusy kvantifikovány amplifikací ligovaných spojení metodami PCR.[28][30]
Originální metody
3C (jedna proti jedné)
Experiment se zachycením konformace chromozomu (3C) kvantifikuje interakce mezi jedinou dvojicí genomových lokusů. Například 3C lze použít k testování kandidátní interakce promotor-zesilovač. Ligované fragmenty jsou detekovány pomocí PCR se známým primery.[2][17] Proto tato technika vyžaduje předchozí znalost interagujících oblastí.
4C (jeden proti všem)
Chromozomová konformace capture-on-chip (4C) zachycuje interakce mezi jedním lokusem a všemi ostatními genomovými lokusy. Zahrnuje druhý ligační krok k vytvoření samooběžných fragmentů DNA, které se používají k provedení inverzní PCR. Inverzní PCR umožňuje použít známou sekvenci k amplifikaci neznámé sekvence k ní ligované.[31][2][19] Na rozdíl od 3C a 5C nevyžaduje technika 4C předchozí znalost obou interagujících chromozomálních oblastí. Výsledky získané pomocí 4C jsou vysoce reprodukovatelné s většinou interakcí, které jsou detekovány mezi oblastmi proximálně k sobě. Na jedné microarray lze analyzovat přibližně milion interakcí.[Citace je zapotřebí ]
5C (mnoho proti mnoha)
Uhlíková kopie zachycující konformaci chromozomu (5C) detekuje interakce mezi všemi restrikčními fragmenty v dané oblasti, přičemž velikost této oblasti obvykle není větší než megabáze.[2][20] To se provádí ligací univerzálních primerů ke všem fragmentům. 5C má však relativně nízké pokrytí. Technika 5C překonává spojovací problémy v kroku intramolekulární ligace a je užitečná pro konstrukci složitých interakcí konkrétních zajímavých míst. Tento přístup je nevhodný pro provádění komplexních interakcí v genomu, protože to bude vyžadovat použití milionů 5C primerů.[Citace je zapotřebí ]
Hi-C (všichni proti všem)
Hi-C použití vysoce výkonné sekvenování najít nukleotidovou sekvenci fragmentů[2][22] a použití spárované koncové sekvenování, který načte krátkou sekvenci z každého konce každého ligovaného fragmentu. Jako takové by pro daný ligovaný fragment měly dvě získané sekvence představovat dva různé restrikční fragmenty, které byly ligovány společně v ligačním kroku založeném na proximitě. Dvojice sekvencí je individuálně srovnána s genomem, čímž jsou určeny fragmenty účastnící se této ligační události. Proto jsou testovány všechny možné párové interakce mezi fragmenty.
Metody založené na zachycení sekvence
Řada metod se používá oligonukleotid zachycení k obohacení knihoven 3C a Hi-C o konkrétní zájmová místa.[32][33] Mezi tyto metody patří Capture-C,[34] NG Capture-C,[35] Capture-3C,[34] , HiCap[32][36]a Capture Hi-C.[37] Tyto metody jsou schopné produkovat vyšší rozlišení a citlivost než metody založené na 4C.[38]
Jednobuněčné metody
K vyšetřování interakcí vyskytujících se v jednotlivých buňkách lze použít jednobuněčné adaptace těchto metod, jako je ChIP-seq a Hi-C.[39][40]
Metody založené na imunoprecipitaci
ChIP smyčka
ChIP smyčka kombinuje 3C s ChIP-sekv detekovat interakce mezi dvěma sledovanými lokusy zprostředkovanými sledovaným proteinem.[2][41] Smyčka ChIP může být užitečná při identifikaci dlouhého dosahu cis-interakce a trans interakce zprostředkovaná proteiny, protože nedojde k častým kolizím DNA.[Citace je zapotřebí ]
Metody celé genomu
ChIA-PET kombinuje Hi-C s ChIP-seq k detekci všech interakcí zprostředkovaných požadovaným proteinem.[2][23] HiChIP byl navržen tak, aby umožňoval podobnou analýzu jako ChIA-PET s menším vstupním materiálem.[42]
Biologický dopad
Metody 3C vedly k řadě biologických poznatků, včetně objevení nových strukturních rysů chromozomů, katalogizace chromatinových smyček a lepšího porozumění transkripční regulace mechanismy (jejichž narušení může vést k onemocnění).[6]
Metody 3C prokázaly význam prostorové blízkosti regulačních prvků ke genům, které regulují. Například v tkáních, které exprimují globin genů tvoří oblast kontroly lokusu β-globinu smyčku s těmito geny. Tato smyčka se nenachází v tkáních, kde není gen exprimován.[43] Tato technologie dále pomohla genetickým a epigenetický studium chromozomů jak v modelových organismech, tak u lidí.[není ověřeno v těle ]
Tyto metody odhalily rozsáhlou organizaci genomu do topologicky přidružit domény (TAD), které korelují s epigenetickými markery. Některé TAD jsou transkripčně aktivní, zatímco jiné jsou potlačovány.[44] Mnoho TAD bylo nalezeno u D. melanogaster, myší a lidských.[45] Navíc, CTCF a kohesin hrají důležitou roli při určování interakcí TAD a zesilovačů s promotory. Výsledek ukazuje, že orientace vazebných motivů CTCF ve smyčce zesilovače-promotoru by měla směřovat k sobě, aby zesilovač mohl najít svůj správný cíl.[46]
Lidská nemoc
Existuje několik onemocnění způsobených vadami v interakcích promotor-zesilovač, které jsou shrnuty v tomto článku.[47]
Beta talasémie je určitý typ krevních poruch způsobených delecí prvku zesilujícího LCR.[48][49]
Holoprosencefalie je cefalická porucha způsobená mutací v prvku zesilovače SBE2, což následně oslabilo produkci genu SHH.[50]
PPD2 (polydaktylie trifalangeálního palce) je způsobena mutací ZRS enhanceru, který zase posílil produkci genu SHH.[51][52]
Adenokarcinom plic může být způsobena duplikací zesilovacího prvku pro gen MYC.[53]
Akutní lymfoblastická leukémie T-buněk je způsobeno zavedením nového vylepšovače.[54]
Analýza dat
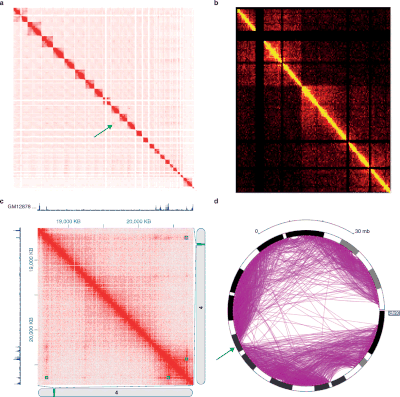
Různé experimenty ve stylu 3C vytvářejí data s velmi odlišnými strukturami a statistickými vlastnostmi. Jako takové existují pro každý typ experimentu specifické analytické balíčky.[33]
Data Hi-C se často používají k analýze organizace chromatinu v celém genomu, jako je například topologicky přidružit domény (TADs), lineárně sousedící oblasti genomu, které jsou asociovány v 3D prostoru.[44] Pro identifikaci TAD z dat Hi-C bylo vyvinuto několik algoritmů.[4][59]
Hi-C a jeho následné analýzy se vyvíjejí. Fit-Hi-C [3] je metoda založená na diskrétním binningovém přístupu s úpravami přidání vzdálenosti interakce (počáteční spline fitování, aka spline-1) a zdokonalení nulového modelu (spline-2). Výsledkem Fit-Hi-C je seznam párových intrachromozomálních interakcí s jejich p-hodnotami a q-hodnotami.[58]
3-D organizaci genomu lze také analyzovat pomocí vlastní složení kontaktní matice. Každý vlastní vektor odpovídá množině lokusů, které nemusí být nutně lineárně sousedící a které sdílejí strukturní rysy.[60]
Významným matoucím faktorem v technologiích 3C jsou časté nespecifické interakce mezi genomovými lokusy, ke kterým dochází v důsledku náhodných polymer chování. Interakce mezi dvěma lokusy musí být potvrzena jako specifická testováním statistické významnosti.[3]
Normalizace mapy kontaktů Hi-C
Existují dva hlavní způsoby normalizace surových Hi-C kontaktních tepelných map. Prvním způsobem je předpokládat stejnou viditelnost, což znamená, že pro každou chromozomální pozici existuje stejná šance na interakci. Pravý signál Hi-C kontaktní mapy by proto měl být vyvážená matice (vyvážená matice má konstantní součty řádků a součty sloupců). Příkladem algoritmů, které předpokládají stejnou viditelnost, je Algoritmus Sinkhorn-Knopp, který škáluje surovou mapu kontaktů Hi-C do vyvážené matice.
Druhým způsobem je předpokládat, že existuje zkreslení spojené s každou chromozomální pozicí. Hodnota mapy kontaktu na každé souřadnici bude skutečným signálem v dané poloze a zkreslení spojenému s těmito dvěma polohami kontaktů. Příkladem algoritmů, které mají za cíl vyřešit tento model zkreslení, je iterativní korekce, která iterativně regresovala zkreslení řádků a sloupců ze surové mapy kontaktů Hi-C. Existuje řada softwarových nástrojů pro analýzu dat Hi-C.[61]
Analýza DNA motivu
DNA motivy jsou specifické krátké sekvence DNA, často 8-20 nukleotidů dlouhé[62] které jsou statisticky nadměrně zastoupeny v sadě sekvencí se společnou biologickou funkcí. V současné době nebyly regulační motivy na interakcích chromatinu s dlouhým dosahem rozsáhle studovány. Několik studií se zaměřilo na objasnění dopadu DNA motivů v interakcích promotor-zesilovač.
Bailey a kol. zjistil, že motiv ZNF143 v promotorových oblastech poskytuje sekvenční specificitu pro interakce promotor-enhancer.[63] Mutace motivu ZNF143 snížila frekvenci interakcí promotor-zesilovač, což naznačuje, že ZNF143 je nový faktor chromatinové smyčky.
Pro analýzu motivů v genomovém měřítku v roce 2016 Wong et al. zveřejnil seznam 19 491 párů DNA motivů pro buněčnou linii K562 na interakcích promotor-zesilovač.[64] Ve výsledku navrhli, aby multiplicita párování motivů (počet motivů spárovaných s daným motivem) byla spojena s interakční vzdáleností a typem regulační oblasti. V příštím roce Wong publikoval další článek, který uvádí 18 879 párů motivů v 6 lidských buněčných liniích.[65] Novým příspěvkem této práce je MotifHyades, a objev motivu nástroj, který lze přímo použít na spárované sekvence.
Analýza genomu rakoviny
Techniky založené na 3C mohou poskytnout pohled na chromozomální přesmyky v genomech rakoviny.[66] Kromě toho mohou ukázat změny prostorové blízkosti regulačních prvků a jejich cílových genů, které přinášejí hlubší pochopení strukturní a funkční základny genomu.[67]
Reference
- ^ de Wit E, de Laat W (leden 2012). „Desetiletí technologií 3C: pohledy na jadernou organizaci“. Geny a vývoj. 26 (1): 11–24. doi:10.1101 / gad.179804.111. PMC 3258961. PMID 22215806.
- ^ A b C d E F G Hakim O, Misteli T (březen 2012). „SnapShot: Chromozomové potvrzení“. Buňka. 148 (5): 1068.e1–2. doi:10.1016 / j.cell.2012.02.019. PMC 6374129. PMID 22385969.
- ^ A b C Ay F, Bailey TL, Noble WS (červen 2014). „Statistický odhad spolehlivosti pro data Hi-C odhaluje regulační kontakty chromatinu“. Výzkum genomu. 24 (6): 999–1011. doi:10,1101 / gr. 160374.113. PMC 4032863. PMID 24501021.
- ^ A b C Rao SS, Huntley MH, Durand NC, Stamenova EK, Bochkov ID, Robinson JT, Sanborn AL, Machol I, Omer AD, Lander ES, Aiden EL (prosinec 2014). „3D mapa lidského genomu v rozlišení kilobáze odhaluje principy smyčky chromatinu“. Buňka. 159 (7): 1665–80. doi:10.1016 / j.cell.2014.11.021. PMC 5635824. PMID 25497547.
- ^ Varoquaux N, Ay F, Noble WS, Vert JP (červen 2014). „Statistický přístup k odvození 3D struktury genomu“. Bioinformatika. 30 (12): i26–33. doi:10.1093 / bioinformatika / btu268. PMC 4229903. PMID 24931992.
- ^ A b Denker A, de Laat W (červen 2016). „Druhé desetiletí technologií 3C: detailní pohledy na jadernou organizaci“. Geny a vývoj. 30 (12): 1357–82. doi:10.1101 / gad.281964.116. PMC 4926860. PMID 27340173.
- ^ „Kdo vynalezl mikroskop? Kompletní historie mikroskopu“. Vision Engineering Ltd. Archivováno od originál dne 22. dubna 2018.
- ^ „Fotografie Benjamina Saura Tübingena Walthera Flemminga, německého lékaře“. Course Hero, Inc.
- ^ Martins LA (1999). „Navrhli Sutton a Boveri takzvanou hypotézu Sutton-Boveriho chromozomu?“. Genet. Mol. Biol. 22 (2): 261–272. doi:10.1590 / S1415-47571999000200022.
- ^ „Geny a genetika: jazyk vědeckých objevů“. Oxfordský anglický slovník. Oxford University Press. 16. 8. 2012.
- ^ Harris M (2015-02-05). „Heterochromatin a euchromatin mains“.
- ^ A b C Deichmann U (srpen 2016). „Epigenetika: počátky a vývoj módního tématu“. Vývojová biologie. 416 (1): 249–254. doi:10.1016 / j.ydbio.2016.06.005. PMID 27291929.
- ^ Lu H, Liu X, Deng Y, Qing H (prosinec 2013). „Methylace DNA, ruka za neurodegenerativními chorobami“. Frontiers in Aging Neuroscience. 5: 85. doi:10.3389 / fnagi.2013.00085. PMC 3851782. PMID 24367332.
- ^ „The Francis Crick Papers: The Discovery of the Double Helix, 1951–1953“.
- ^ Cremer T, Cremer M (březen 2010). „Chromozomová území“. Perspektivy Cold Spring Harbor v biologii. 2 (3): a003889. doi:10.1101 / cshperspect.a003889. PMC 2829961. PMID 20300217.
- ^ Cullen KE, poslanec Kladde, Seyfred MA (červenec 1993). "Interakce mezi regulačními oblastmi transkripce prolaktin chromatinu". Věda. 261 (5118): 203–6. Bibcode:1993Sci ... 261..203C. doi:10.1126 / science.8327891. PMID 8327891.
- ^ A b Dekker J, Rippe K, Dekker M, Kleckner N (únor 2002). "Zachycení konformace chromozomu". Věda. 295 (5558): 1306–11. Bibcode:2002Sci ... 295.1306D. doi:10.1126 / science.1067799. PMID 11847345. S2CID 3561891.
- ^ Osborne CS, Ewels PA, Young AN (leden 2011). „Seznamte se sousedy: nástroje k pitvě jaderné struktury a funkce“. Briefings in Functional Genomics. 10 (1): 11–7. doi:10.1093 / bfgp / elq034. PMC 3080762. PMID 21258046.
- ^ A b Simonis M, Klous P, Splinter E, Moshkin Y, Willemsen R, de Wit E, van Steensel B, de Laat W (listopad 2006). "Jaderná organizace aktivních a neaktivních domén chromatinu nezjištěných chromosomovou konformační chybou na čipu (4C)". Genetika přírody. 38 (11): 1348–54. doi:10.1038 / ng1896. PMID 17033623. S2CID 22787572.
- ^ A b Dostie J, Richmond TA, Arnaout RA, Selzer RR, Lee WL, Honan TA a kol. (Říjen 2006). „Chromozomová konformace Capture Carbon Copy (5C): masivně paralelní řešení pro mapování interakcí mezi genomovými prvky“. Výzkum genomu. 16 (10): 1299–309. doi:10,1101 / gr. 5571506. PMC 1581439. PMID 16954542.
- ^ Albert I, Mavrich TN, Tomsho LP, Qi J, Zanton SJ, Schuster SC, Pugh BF (březen 2007). "Translační a rotační nastavení nukleosomů H2A.Z napříč genomem Saccharomyces cerevisiae". Příroda. 446 (7135): 572–6. Bibcode:2007 Natur.446..572A. doi:10.1038 / nature05632. PMID 17392789. S2CID 4416890.
- ^ A b Lieberman-Aiden E, van Berkum NL, Williams L, Imakaev M, Ragoczy T, Telling A a kol. (Říjen 2009). „Komplexní mapování interakcí na velké vzdálenosti odhaluje základní principy lidského genomu“. Věda. 326 (5950): 289–93. Bibcode:2009Sci ... 326..289L. doi:10.1126 / science.1181369. PMC 2858594. PMID 19815776.
- ^ A b Fullwood MJ, Liu MH, Pan YF, Liu J, Xu H, Mohamed YB a kol. (Listopad 2009). „Interaktivní lidský chromatin vázaný na estrogen-receptor-alfa. Příroda. 462 (7269): 58–64. Bibcode:2009Natur.462 ... 58F. doi:10.1038 / nature08497. PMC 2774924. PMID 19890323.
- ^ Dixon JR, Selvaraj S, Yue F, Kim A, Li Y, Shen Y, Hu M, Liu JS, Ren B (duben 2012). "Topologické domény v savčích genomech identifikované analýzou chromatinových interakcí". Příroda. 485 (7398): 376–80. Bibcode:2012Natur.485..376D. doi:10.1038 / příroda11082. PMC 3356448. PMID 22495300.
- ^ Nora EP, Lajoie BR, Schulz EG, Giorgetti L, Okamoto I, Servant N, Piolot T, van Berkum NL, Meisig J, Sedat J, Gribnau J, Barillot E, Blüthgen N, Dekker J, Heard E (duben 2012). „Prostorové rozdělení regulačního prostředí centra X-inaktivace“. Příroda. 485 (7398): 381–5. Bibcode:2012Natur.485..381N. doi:10.1038 / příroda11049. PMC 3555144. PMID 22495304.
- ^ A b Nagano, Takashi; Lubling, Yaniv; Stevens, Tim J .; Schoenfelder, Stefan; Yaffe, Eitan; Dean, Wendy; Laue, Ernest D .; Tanay, Amos; Fraser, Peter (říjen 2013). „Jednobuněčný Hi-C odhaluje variabilitu struktury chromozomů mezi buňkami“. Příroda. 502 (7469): 59–64. Bibcode:2013Natur.502 ... 59N. doi:10.1038 / příroda12593. PMC 3869051. PMID 24067610.
- ^ Gavrilov A, Eivazova E, Priozhkova I, Lipinski M, Razin S, Vassetzky Y (2009). "Zachycení konformace chromozomu (od 3 ° C do 5 ° C) a jeho modifikace založená na ChIP". Chromatinové imunoprecipitační testy. Posouzení. Metody v molekulární biologii. 567. str. 171–88. doi:10.1007/978-1-60327-414-2_12. ISBN 978-1-60327-413-5. PMID 19588093.
- ^ A b C Naumova N, Smith EM, Zhan Y, Dekker J (listopad 2012). „Analýza interakcí chromatinu s dlouhým dosahem pomocí Chromosome Conformation Capture“. Metody. 58 (3): 192–203. doi:10.1016 / j.ymeth.2012.07.022. PMC 3874837. PMID 22903059.
- ^ Belton JM, Dekker J (červen 2015). "Zachycení chromosomové konformace (3C) v nadějných kvasnicích". Cold Spring Harbor Protocols. 2015 (6): 580–6. doi:10.1101 / pdb.prot085175. PMID 26034304.
- ^ A b Gavrilov AA, Golov AK, Razin SV (2013-03-26). „Aktuální frekvence ligace v postupu zachycení konformace chromozomu“. PLOS ONE. 8 (3): e60403. Bibcode:2013PLoSO ... 860403G. doi:10.1371 / journal.pone.0060403. PMC 3608588. PMID 23555968.
- ^ Zhao, Zhihu; Tavoosidana, Gholamreza; Sjolinder, Mikael; Gondor, Anita; Mariano, Piero; Wang, Sha; Kanduri, Chandrasekhar; Lezcano, Magda; Sandhu, Kuljeet Singh; Singh, Umashankar; Pant, Vinod; Tiwari, Vijay; Kurukuti, Sreenivasulu; Ohlsson, Rolf (2006). „Zachycení konformace kruhového chromozomu (4C) odkrývá rozsáhlé sítě epigeneticky regulovaných intra- a interchromozomálních interakcí“. Genetika přírody. 38 (11): 1341–7. doi:10.1038 / ng1891. PMID 17033624. S2CID 2660843.
- ^ A b US patent 10287621
- ^ A b Schmitt AD, Hu M, Ren B (prosinec 2016). "Mapování celého genomu a analýza architektury chromozomů". Nature Reviews Molecular Cell Biology. 17 (12): 743–755. doi:10.1038 / nrm.2016.104. PMC 5763923. PMID 27580841.
- ^ A b Hughes JR, Roberts N, McGowan S, Hay D, Giannoulatou E, Lynch M a kol. (Únor 2014). „Analýza stovek cis-regulačních krajin ve vysokém rozlišení v jediném experimentu s vysokou propustností“. Genetika přírody. 46 (2): 205–12. doi:10,1038 / ng.2871. PMID 24413732. S2CID 205348099.
- ^ Davies JO, Telenius JM, McGowan SJ, Roberts NA, Taylor S, Higgs DR, Hughes JR (leden 2016). „Multiplexovaná analýza konformace chromozomů při výrazně vylepšené citlivosti“. Přírodní metody. 13 (1): 74–80. doi:10.1038 / nmeth.3664. PMC 4724891. PMID 26595209.
- ^ Sahlén, Pelin; Abdullayev, Ilgar; Ramsköld, Daniel; Matsková, Liudmila; Rilakovic, Nemanja; Lötstedt, Britta; Albert, Thomas J .; Lundeberg, Joakim; Sandberg, Rickard (03.08.2015). „Mapování interakcí ukotvených promotorem v celém genomu s rozlišením blízkým jednomu zesilovači“. Genome Biology. 16: 156. doi:10.1186 / s13059-015-0727-9. ISSN 1474-760X. PMC 4557751. PMID 26313521.
- ^ Jäger R, Migliorini G, Henrion M, Kandaswamy R, Speedy HE, Heindl A, Whiffin N, Carnicer MJ, Broome L, Dryden N, Nagano T, Schoenfelder S, Enge M, Yuan Y, Taipale J, Fraser P, Fletcher O , Houlston RS (únor 2015). „Capture Hi-C identifikuje chromatinový interakční lokus s rizikem kolorektálního karcinomu“. Příroda komunikace. 6: 6178. Bibcode:2015NatCo ... 6.6178J. doi:10.1038 / ncomms7178. PMC 4346635. PMID 25695508.
- ^ Davies JO, Oudelaar AM, Higgs DR, Hughes JR (leden 2017). „Jak nejlépe identifikovat chromozomální interakce: srovnání přístupů“. Přírodní metody. 14 (2): 125–134. doi:10.1038 / nmeth.4146. PMID 28139673. S2CID 4136037.
- ^ Nagano T, Lubling Y, Stevens TJ, Schoenfelder S, Yaffe E, Dean W a kol. (Říjen 2013). „Jednobuněčný Hi-C odhaluje variabilitu struktury chromozomů mezi buňkami“. Příroda. 502 (7469): 59–64. Bibcode:2013Natur.502 ... 59N. doi:10.1038 / příroda12593. PMC 3869051. PMID 24067610.
- ^ Schwartzman O, Tanay A (prosinec 2015). "Jednobuněčná epigenomika: techniky a nové aplikace". Genetika hodnocení přírody. 16 (12): 716–26. doi:10.1038 / nrg3980. PMID 26460349. S2CID 10326803.
- ^ Horike S, Cai S, Miyano M, Cheng JF, Kohwi-Shigematsu T (leden 2005). "Ztráta smyčky tichého chromatinu a zhoršený otisk DLX5 u Rettova syndromu". Genetika přírody. 37 (1): 31–40. doi:10.1038 / ng1491. PMID 15608638. S2CID 2884412.
- ^ Mumbach MR, Rubin AJ, Flynn RA, Dai C, Khavari PA, Greenleaf WJ, Chang HY (listopad 2016). „HiChIP: efektivní a citlivá analýza architektury genomu zaměřené na proteiny“. Přírodní metody. 13 (11): 919–922. doi:10.1038 / nmeth.3999. PMC 5501173. PMID 27643841.
- ^ Tolhuis B, Palstra RJ, Splinter E, Grosveld F, de Laat W (prosinec 2002). „Smyčka a interakce mezi hypersenzitivními místy v aktivním lokusu beta-globinu“. Molekulární buňka. 10 (6): 1453–65. doi:10.1016 / S1097-2765 (02) 00781-5. PMID 12504019.
- ^ A b Cavalli G, Misteli T (březen 2013). „Funkční důsledky topologie genomu“. Přírodní strukturní a molekulární biologie. 20 (3): 290–9. doi:10.1038 / nsmb.2474. PMC 6320674. PMID 23463314.
- ^ Dekker J, Marti-Renom MA, Mirny LA (červen 2013). „Zkoumání trojrozměrné organizace genomů: interpretace dat interakce chromatinu“. Genetika hodnocení přírody. 14 (6): 390–403. doi:10.1038 / nrg3454. PMC 3874835. PMID 23657480.
- ^ Guo Y, Xu Q, Canzio D, Shou J, Li J, Gorkin DU a kol. (Srpen 2015). „CRISPR Inverze stránek CTCF mění topologii genomu a funkci Enhancer / Promoter“. Buňka. 162 (4): 900–10. doi:10.1016 / j.cell.2015.07.038. PMC 4642453. PMID 26276636.
- ^ Krijger PH, de Laat W (prosinec 2016). "Regulace genové exprese spojené s onemocněním v 3D genomu". Nature Reviews Molecular Cell Biology. 17 (12): 771–782. doi:10.1038 / nrm.2016.138. PMID 27826147. S2CID 11484886.
- ^ Fritsch EF, Lawn RM, Maniatis T (červen 1979). "Charakterizace delecí, které ovlivňují expresi genů globinu plodu u člověka". Příroda. 279 (5714): 598–603. Bibcode:1979Natur.279..598F. doi:10.1038 / 279598a0. PMID 450109. S2CID 4243029.
- ^ Van der Ploeg LH, Konings A, Oort M, Roos D, Bernini L, Flavell RA (únor 1980). „studie gama-beta-talasémie, které ukazují, že delece genů gama a delta ovlivňuje expresi genu beta-globinu u člověka“. Příroda. 283 (5748): 637–42. Bibcode:1980 Natur.283..637V. doi:10.1038 / 283637a0. PMID 6153459. S2CID 4371542.
- ^ Jeong Y, El-Jaick K, Roessler E, Muenke M, DJ Epstein (únor 2006). „Funkční obrazovka pro regulační prvky sonických ježků v intervalu 1 Mb identifikuje zesilovače ventrálního předního mozku na velké vzdálenosti“. Rozvoj. 133 (4): 761–72. doi:10.1242 / dev.02239. PMID 16407397.
- ^ Lettice LA, Heaney SJ, Purdie LA, Li L, de Beer P, Oostra BA a kol. (Červenec 2003). „Zesilovač Shh s dlouhým dosahem reguluje expresi ve vyvíjející se končetině a ploutve a je spojen s preaxiální polydaktylií“. Lidská molekulární genetika. 12 (14): 1725–35. doi:10,1093 / hmg / ddg180. PMID 12837695.
- ^ Wieczorek D, Pawlik B, Li Y, Akarsu NA, Caliebe A, May KJ a kol. (Leden 2010). „Specifická mutace v cis-regulátoru vzdáleného sonického ježka (SHH) (ZRS) způsobuje Wernerův mezomelický syndrom (WMS), zatímco úplné duplikace ZRS jsou základem polysyndaktylie typu Haas a preaxiální polydaktylie (PPD) s nebo bez trifalangeálního palce“. Lidská mutace. 31 (1): 81–9. doi:10,1002 / humu.21142. PMID 19847792. S2CID 1715146.
- ^ Zhang X, Choi PS, Francis JM, Imielinski M, Watanabe H, Cherniack AD, Meyerson M (únor 2016). "Identifikace fokálně zesílených liniových specifických super-enhancerů u lidských epiteliálních rakovin". Genetika přírody. 48 (2): 176–82. doi:10.1038 / ng.3470. PMC 4857881. PMID 26656844.
- ^ Mansour MR, Abraham BJ, Anders L, Berezovskaya A, Gutierrez A, Durbin AD a kol. (Prosinec 2014). „Regulace onkogenu. Onkogenní super-zesilovač vytvořený somatickou mutací nekódujícího intergenního prvku“. Věda. 346 (6215): 1373–7. doi:10.1126 / science.1259037. PMC 4720521. PMID 25394790.
- ^ Lajoie BR, van Berkum NL, Sanyal A, Dekker J (říjen 2009). „My5C: webové nástroje pro studie zachycení konformace chromozomů“. Přírodní metody. 6 (10): 690–1. doi:10.1038 / nmeth1009-690. PMC 2859197. PMID 19789528.
- ^ Deng X, Ma W, Ramani V, Hill A, Yang F, Ay F a kol. (Srpen 2015). „Bipartitní struktura neaktivního myšího chromozomu X“. Genome Biology. 16 (1): 152. doi:10.1186 / s13059-015-0728-8. PMC 4539712. PMID 26248554.
- ^ Zhou X, Lowdon RF, Li D, Lawson HA, Madden PA, Costello JF, Wang T (květen 2013). „Zkoumání interakcí genomu na velké vzdálenosti pomocí prohlížeče WashU Epigenome Browser“. Přírodní metody. 10 (5): 375–6. doi:10.1038 / nmeth.2440. PMC 3820286. PMID 23629413.
- ^ A b Yardımcı GG, Noble WS (únor 2017). „Softwarové nástroje pro vizualizaci dat Hi-C“. Genome Biology. 18 (1): 26. doi:10.1186 / s13059-017-1161-r. PMC 5290626. PMID 28159004.
- ^ Dixon JR, Selvaraj S, Yue F, Kim A, Li Y, Shen Y a kol. (Duben 2012). "Topologické domény v savčích genomech identifikované analýzou chromatinových interakcí". Příroda. 485 (7398): 376–80. Bibcode:2012Natur.485..376D. doi:10.1038 / příroda11082. PMC 3356448. PMID 22495300.
- ^ Imakaev M, Fudenberg G, McCord RP, Naumova N, Goloborodko A, Lajoie BR a kol. (Říjen 2012). „Iterační korekce dat Hi-C odhaluje charakteristické znaky organizace chromozomů“. Přírodní metody. 9 (10): 999–1003. doi:10.1038 / nmeth.2148. PMC 3816492. PMID 22941365.
- ^ Imakaev M, Fudenberg G, McCord RP, Naumova N, Goloborodko A, Lajoie BR, Dekker J, Mirny LA (říjen 2012). „Iterační korekce dat Hi-C odhaluje charakteristické znaky organizace chromozomů“. Přírodní metody. 9 (10): 999–1003. doi:10.1038 / nmeth.2148. PMC 3816492. PMID 22941365.
- ^ Zambelli F, Pesole G, Pavesi G (březen 2013). „Místa pro objevování motivů a transkripční faktory před a po éře sekvenování příští generace“. Briefings in Bioinformatics. 14 (2): 225–37. doi:10.1093 / bib / bbs016. PMC 3603212. PMID 22517426.
- ^ Bailey, S. D., Zhang, X., Desai, K., Aid, M., Corradin, O., Cowper-Sal·lari, R., ... Lupien, M. (2015). ZNF143 poskytuje sekvenční specificitu k zajištění chromatinových interakcí na genových promotorech. Nature Communications, 2, 6186. Citováno z https://doi.org/10.1038/ncomms7186
- ^ K. Wong, Y. Li a C. Peng, „Identifikace vazebných párů DNA motivů na interakcích chromatinu s dlouhým dosahem u člověka,“ sv. 32, č. Září 2015, s. 321–324, 2016.
- ^ Ka-Chun Wong; MotifHyades: maximalizace očekávání pro objev páru motivů DNA de novo na párových sekvencích, Bioinformatika, svazek 33, číslo 19, 1. října 2017, strany 3028–3035, https://doi.org/10.1093/bioinformatics/btx381
- ^ Harewood L, Kishore K, Eldridge MD, Wingett S, Pearson D, Schoenfelder S, Collins VP, Fraser P (červen 2017). „Hi-C jako nástroj pro přesnou detekci a charakterizaci chromozomálních přeskupení a změnu počtu kopií v lidských nádorech“. Genome Biology. 18 (1): 125. doi:10.1186 / s13059-017-1253-8. PMC 5488307. PMID 28655341.
- ^ Taberlay PC, Achinger-Kawecka J, Lun AT, Buske FA, Sabir K, Gould CM a kol. (Červen 2016). „Trojrozměrná dezorganizace rakovinového genomu nastává současně s genetickými a epigenetickými změnami dlouhého dosahu“. Výzkum genomu. 26 (6): 719–31. doi:10.1101 / gr.201517.115. PMC 4889976. PMID 27053337.
Další čtení
- Barutcu AR, Fritz AJ, Zaidi SK, van Wijnen AJ, Lian JB, Stein JL, Nickerson JA, Imbalzano AN, Stein GS (leden 2016). „C-ing the Genome: A Compendium of Chromosome Conformation Capture Methods to Study High-order Chromatin Organization“. Journal of Cellular Physiology. 231 (1): 31–5. doi:10,1002 / jcp.25062. PMC 4586368. PMID 26059817.
- Marbouty M, Koszul R (prosinec 2015). „Analýza metagenomu využívající data pro zachycení konformace chromozomu s vysokou propustností (3C)“. Posouzení. Trendy v genetice. 31 (12): 673–682. doi:10.1016 / j.tig.2015.10.003. PMC 6831814. PMID 26608779.
- Dekker J (25. listopadu 2014). „Dva způsoby, jak složit genom během buněčného cyklu: poznatky získané zachycením konformace chromozomu“. Epigenetika a chromatin. 7 (1): 25. doi:10.1186/1756-8935-7-25. PMC 4247682. PMID 25435919.
- O'Sullivan JM, Hendy MD, Pichugina T, Wake GC, Langowski J (září – říjen 2013). „Statistická mechanika zachycování konformace chromozomů“. Jádro. 4 (5): 390–8. doi:10,4161 / nucl.26513. PMC 3899129. PMID 24051548.
- Umbarger MA (listopad 2012). "Testy na zachycení konformace chromozomu v bakteriích". Posouzení. Metody. 58 (3): 212–20. doi:10.1016 / j.ymeth.2012.06.017. PMID 22776362.
- Parelho V, Merkenschlager M (září 2005). „Genová exprese: společné vyrůstání může genům pomoci jít každý svou cestou“. novinky a komentáře. European Journal of Human Genetics. 13 (9): 993–4. doi:10.1038 / sj.ejhg.5201464. PMID 15999115. S2CID 29714576.
- Marvin M, Tan-Wong SM (2016-04-23). "Zachycení konformace chromozomu" (komerční metoda). Abcam PLC. Citováno 23. dubna 2016.
