Centrální tolerance - Central tolerance
Centrální tolerance, známý také jako negativní výběr, je proces eliminace jakékoli rozvíjející se T nebo B lymfocyty které reagují na sebe.[1] Díky eliminaci autoreaktivních lymfocytů tolerance zajišťuje, že imunitní systém neútočí na vlastní peptidy.[2] K zrání lymfocytů (a centrální toleranci) dochází v primární lymfoidní orgány tak jako kostní dřeň a brzlík. U savců B buňky dozrávají v kostní dřeni a T buňky dozrávají v brzlíku.[1]
Centrální tolerance není dokonalá, takže periferní tolerance existuje jako sekundární mechanismus zajišťující, že T a B buňky nejsou samy reaktivní, jakmile opustí primární lymfoidní orgány.[3] Periferní tolerance je odlišný od centrální tolerance v tom, že k němu dochází, jakmile vyvíjející se imunitní buňky opustí primární lymfoidní orgány (brzlík a kostní dřeň), před jejich exportem do periferií.[1]
Funkce centrální tolerance
Centrální tolerance je nezbytná pro správné fungování imunitních buněk, protože pomáhá zajistit, aby zralé B buňky a T buňky nerozpoznaly vlastní antigeny jako cizí mikroby.[2] Přesněji řečeno, centrální tolerance je nutná, protože receptory T buněk (TCR) a receptory B buněk (BCR) jsou vytvářeny buňkami náhodným somatickým přesmykem.[1] Tento proces, známý jako V (D) J rekombinace, je důležité, protože zvyšuje rozmanitost receptorů, což zvyšuje pravděpodobnost, že B buňky a T buňky budou mít receptory pro nové antigeny.[1] Spojovací rozmanitost dochází během rekombinace a slouží k dalšímu zvýšení diverzity BCR a TCR.[1] Produkce náhodných TCR a BCR je důležitou metodou obrany proti mikrobům kvůli jejich vysoké rychlosti mutace. Tento proces také hraje důležitou roli při podpoře přežití druhu, protože v rámci druhu bude existovat celá řada přeskupení receptorů, což znamená, že existuje velmi vysoká šance, že alespoň jeden člen druhu bude mít receptory pro nový antigen.[1]
Zatímco proces somatické rekombinace je nezbytný pro úspěšnou imunitní obranu, může vést k autoreaktivitě. Například nedostatek funkčnosti RAG1 / 2, enzymy nezbytné pro somatickou rekombinaci, je spojován s vývojem imunitních cytopenie, ve kterých jsou vytvářeny protilátky proti krevním buňkám pacienta.[4] Vzhledem k povaze náhodné rekombinace receptoru budou vytvořeny některé BCR a TCR, které rozpoznávají vlastní antigeny jako cizí.[2] To je problematické, protože tyto B a T buňky by, pokud jsou aktivovány, vyvolaly útok imunitního systému proti sobě, pokud by nebyly zabity nebo inaktivovány mechanismy centrální tolerance.[2] Bez centrální tolerance by tedy imunitní systém mohl zaútočit na sebe, což není udržitelné a mohlo by to vést k autoimunitní poruše.[2][3]
Mechanismy centrální tolerance
Konečným výsledkem tolerance je populace lymfocytů, které nereagují na vlastní antigeny, ale mohou rozpoznávat cizí, jiné než vlastní antigeny v závislosti na náhodně uspořádaném receptoru.[2] Důležité je, že lymfocyty mohou vyvinout toleranci pouze k antigenům, které jsou přítomny v kostní dřeni (pro B buňky) a brzlíku (pro T buňky).
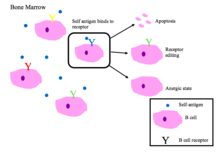
Tolerance B buněk
Nezralé B buňky v kostní dřeni procházejí negativní selekcí, když se vážou na vlastní peptidy.[2]
Správně fungující receptory B buněk rozpoznávají jiné než vlastní antigeny nebo patogeny spojené s molekulárními proteiny (PAMP ).[1]
Hlavní výsledky autoreaktivity BCR [1][2]
- Apoptóza (klonální vypuštění)
- Úpravy receptoru: reaktivní B buňka mění specificitu přeskupením genů a vyvíjí nový BCR, který na sebe nereaguje. Tento proces dává B buňce šanci upravit BCR předtím, než je signalizována apoptóza nebo anergie.
- Indukce anergie (stav nereaktivity)

Tolerance T buněk
Centrální tolerance T buněk se vyskytuje v brzlíku.[1] T buňky procházejí pozitivní a negativní selekcí.[2]
Receptory T buněk musí mít schopnost rozpoznávat sebe hlavní komplex histokompatibility (MHC) molekuly s navázaným ne-vlastním peptidem.[1]
Kroky tolerance T buněk [2][5]
- Během pozitivní selekce se T buňky kontrolují na svou schopnost vázat afinitu peptid-MHC komplexy. Pokud T buňka nemůže vázat MHC třída I nebo MHC třídy II komplex, nepřijímá signály o přežití, takže umírá prostřednictvím apoptózy. Receptory T buněk s dostatečnou afinitou k komplexům peptid-MHC jsou vybrány pro přežití.
- Během negativní selekce se T buňky testují na svou afinitu k sobě samému. Pokud se vážou na vlastní peptid, pak jsou signalizováni k apoptóze (proces klonální delece).
- Buňky thymického epitelu vykazují vlastní antigen vůči T buňkám, aby se otestovala jejich afinita k sobě.
- Regulátory transkripce UŽ a Fezf2 hrají důležitou roli v expresi antigenů vlastní tkáně na buňkách epitelu brzlíku v brzlíku.
- Negativní selekce se vyskytuje v kortiko-medulární spojce a v dřeni brzlíku.
- T buňky, které se neváží samostatně, ale rozpoznávají komplexy antigen / MHC a jsou buď CD4 + nebo CD8 +, migrují do sekundárních lymfoidních orgánů jako zralé naivní T buňky.
Regulační T buňky jsou dalším typem T buněk, které dozrávají v brzlíku. Selekce T reg buněk probíhá v dřeně brzlíku a je doprovázena transkripcí Foxp3. T reg buňky jsou důležité pro regulaci autoimunity potlačením imunitního systému, když by neměl být aktivní.[6]

Genetická onemocnění způsobená poruchami centrální tolerance
Genetické vady centrální tolerance mohou vést k autoimunitě.
- Syndrom autoimunitní polyendokrinopatie typu I. je způsobena mutacemi v lidském genu UŽ. To vede k nedostatečné expresi periferních antigenů v brzlíku, a tedy k nedostatečné negativní selekci vůči klíčovým periferním proteinům, jako je inzulín.[7][8] Výsledkem je několik autoimunitních příznaků.
Historie centrální tolerance
První použití centrální tolerance provedl Ray Owen v roce 1945, když si všiml, že dvojvaječný skot nevytváří protilátky, když bylo jednomu z dvojčat injekčně podána krev ostatním.[9] Jeho zjištění byla potvrzena pozdějšími experimenty Haška a Billinghama.[9] Výsledky vysvětlil Buret's klonální výběr hypotéza.[10] Burnet a Medawar získali v roce 1960 Nobelovu cenu za práci vysvětlující, jak funguje imunitní tolerance.[10][11]
Viz také
Reference
- ^ A b C d E F G h i Owen JA, Punt J, Stranford SA, Jones PP, Kuby J (2013). Kuby imunologie (7. vydání). New York: W.H. Freemane. ISBN 978-1-4292-1919-8. OCLC 820117219.
- ^ A b C d E F G h Romagnani S (2006). "Imunologická tolerance a autoimunita". Interní a urgentní medicína. 1 (3): 187–96. doi:10.1007 / bf02934736. PMID 17120464.
- ^ A b Janeway C (2011). Immunobiology 5: The Immune System in Health and Disease (5. vydání). New York: Garland. ISBN 978-0-8153-3642-6. OCLC 45708106.
- ^ Chen K, Wu W, Mathew D, Zhang Y, Browne SK, Rosen LB, McManus MP, Pulsipher MA, Yandell M, Bohnsack JF, Jorde LB, Notarangelo LD, Walter JE (březen 2014). „Autoimunita způsobená nedostatkem RAG a odhadovaným výskytem onemocnění u mutací RAG1 / 2“. The Journal of Allergy and Clinical Immunology. 133 (3): 880–2.e10. doi:10.1016 / j.jaci.2013.11.038. PMC 4107635. PMID 24472623.
- ^ Sprent J, Kishimoto H (květen 2001). "Brzlík a centrální tolerance". Filozofické transakce Královské společnosti v Londýně. Série B, Biologické vědy. 356 (1409): 609–16. doi:10.1098 / rstb.2001.0846. PMC 1088448. PMID 11375064.
- ^ Bettelli E, Carrier Y, Gao W, Korn T, Strom TB, Oukka M, Weiner HL, Kuchroo VK (květen 2006). "Reciproční vývojové dráhy pro generování patogenního efektoru TH17 a regulačních T buněk". Příroda. 441 (7090): 235–8. doi:10.1038 / příroda04753. PMID 16648838.
- ^ Anderson MS, Venanzi ES, Klein L, Chen Z, Berzins SP, Turley SJ, von Boehmer H, Bronson R, Dierich A, Benoist C, Mathis D (listopad 2002). "Projekce imunologického vlastního stínu uvnitř brzlíku aire proteinem". Věda. 298 (5597): 1395–401. doi:10.1126 / science.1075958. PMID 12376594.
- ^ Liston A, Lesage S, Wilson J, Peltonen L, Goodnow CC (duben 2003). "Aire reguluje negativní výběr orgánově specifických T buněk". Přírodní imunologie. 4 (4): 350–4. doi:10.1038 / ni906. PMID 12612579.
- ^ A b Schwartz RH (duben 2012). "Historický přehled imunologické tolerance". Perspektivy Cold Spring Harbor v biologii. 4 (4): a006908. doi:10.1101 / cshperspect.a006908. PMC 3312674. PMID 22395097.
- ^ A b Liston A (leden 2011). „Imunologická tolerance 50 let po Nobelově ceně Burneta“. Imunologie a buněčná biologie. 89 (1): 14–5. doi:10.1038 / icb.2010.138. PMID 21209621.
- ^ Silverstein AM (březen 2016). „Zvláštní případ Nobelovy ceny pro Burneta a Medawara z roku 1960“. Imunologie. 147 (3): 269–74. doi:10.1111 / imm.12558. PMC 4754613. PMID 26790994.

