Bioorthogonální chemie - Bioorthogonal chemistry
Termín bioorthogonální chemie odkazuje na jakoukoli chemická reakce které se mohou objevit uvnitř živé systémy bez zásahu do nativních biochemických procesů.[1][2][3] Termín vytvořil Carolyn R. Bertozzi v roce 2003.[4] Od svého zavedení umožnil koncept bioorthogonální reakce studium biomolekul jako např glykany, bílkoviny,[5] a lipidy[6] v reálném čase v živých systémech bez buněčné toxicity. Byla vyvinuta řada strategií chemické ligace, které splňují požadavky bioorthogonality, včetně 1,3-dipolární cykloadice mezi azidy a cyklooktyny (také nazývané chemie klikání bez mědi ),[7] mezi nitrony a cyklooktyny,[8] oxim /hydrazon formace z aldehydy a ketony,[9] the tetrazin ligace,[10] the isokyanid reakce na základě kliknutí,[11] a nejnověji kvadricyklanová ligace.[12]
Využití bioorthogonální chemie obvykle probíhá ve dvou krocích. Nejprve je buněčný substrát modifikován bioorthogonální funkční skupinou (chemický reportér) a zaveden do buňky; substráty zahrnují metabolity, enzymové inhibitory atd. Chemický reportér nesmí dramaticky měnit strukturu substrátu, aby nedošlo k ovlivnění jeho bioaktivity. Za druhé se zavede sonda obsahující komplementární funkční skupinu, aby reagovala a označila substrát.
Ačkoli byly vyvinuty účinné bioorthogonální reakce, jako je chemie klikání bez mědi, vývoj nových reakcí nadále generuje ortogonální metody značení, které umožňují použití více metod značení ve stejných biosystémech.
Požadavky na bioorthogonalitu
Aby mohla být reakce považována za bioortogonální, musí splňovat řadu požadavků:
- Selektivita: Reakce musí být selektivní mezi endogenními funkčními skupinami, aby se zabránilo vedlejším reakcím s biologickými sloučeninami
- Biologická inertnost: Reaktivní partneři a výsledná vazba by neměli mít žádný způsob reaktivity schopný narušit nativní chemickou funkčnost studovaného organismu.
- Chemická inertnost: Kovalentní vazba by měla být silná a inertní vůči biologickým reakcím.
- Kinetika: Reakce musí být rychlá, aby se dosáhlo kovalentní ligace před metabolizací a odstraněním sondy. Reakce musí být rychlá, v časovém měřítku buněčných procesů (minut), aby se zabránilo konkurenci v reakcích, které mohou snížit malé signály méně hojných druhů. Rychlé reakce také nabízejí rychlou reakci nezbytnou pro přesné sledování dynamických procesů.
- Biokompatibilita reakce: Reakce musí být netoxické a musí fungovat v biologických podmínkách s ohledem na pH, vodné prostředí a teplotu. Vzhledem k tomu, že se bioortogonální chemie rozšiřuje na živé zvířecí modely, je farmakokinetika stále větší obavou.
- Přístupné inženýrství: Chemický reportér musí být schopen začlenit se do biomolekul prostřednictvím určité formy metabolického nebo proteinového inženýrství. Optimálně je jedna z funkčních skupin také velmi malá, aby nenarušila nativní chování.
Staudingerova ligace
The Staudingerova ligace je reakce vyvinutá skupinou Bertozzi v roce 2000, která je založena na klasice Staudingerova reakce azidů s triarylfosfiny.[13] Zahájila pole bioorthogonální chemie jako první reakci s úplně abiotickými funkčními skupinami, i když již není tak široce používána. Staudingerova ligace byla použita jak v živých buňkách, tak v živých myších.[4]
Bioorthogonality
Azid může působit jako měkký elektrofil který dává přednost měkkým nukleofilům, jako je fosfiny. To je na rozdíl od většiny biologických nukleofilů, kterými jsou obvykle tvrdé nukleofily. Reakce probíhá selektivně za podmínek snášenlivosti s vodou za vzniku stabilního produktu.
Fosfiny v živých systémech zcela chybí a nesnižují disulfidové vazby navzdory mírnému redukčnímu potenciálu. Ukázalo se, že azidy jsou biokompatibilní v lécích schválených FDA, jako je azidothymidin, a při jiných použitích jako síťovadla. Jejich malá velikost navíc umožňuje jejich snadné začlenění do biomolekul buněčnými metabolickými cestami.
Mechanismus
Tato sekce smět bloudit od tématu článku. (Září 2014) |
Klasická Staudingerova reakce

Nukleofilní fosfin napadá azid na elektrofilním koncovém dusíku. Prostřednictvím čtyřčlenného přechodového stavu N2 se ztrácí za vzniku aza-ylidu. Nestabilní ylid se hydrolyzuje za vzniku fosfinoxidu a primárního aminu. Tato reakce však není okamžitě bioortogonální, protože hydrolýza rozbije kovalentní vazbu v aza-ylidu.
Staudingerova ligace

Reakce byla upravena tak, aby zahrnovala esterovou skupinu kolmo k atomu fosforu na jednom z arylových kruhů, aby nasměrovala aza-ylid novou cestou reaktivity, aby se vyhnula okamžité hydrolýze umístěním esteru ke zvýšení místní koncentrace. Počáteční nukleofilní útok na azid je krokem omezujícím rychlost. Ylid reaguje s elektrofilním lapačem esterů intramolekulární cyklizací za vzniku pětičlenného kruhu. Tento kruh podléhá hydrolýze za vzniku stáje amide pouto.
Omezení
Fosfinová činidla pomalu procházejí oxidací vzduchu v živých systémech. Navíc je pravděpodobné, že jsou metabolizovány in vitro podle cytochrom P450 enzymy.
Kinetika reakcí je pomalá s rychlostními konstantami druhého řádu kolem 0,0020 M−1• s−1. Pokusy o zvýšení rychlosti nukleofilních útoků přidáním skupin poskytujících elektrony k fosfinům zlepšily kinetiku, ale také zvýšily rychlost oxidace vzduchu.
Špatná kinetika vyžaduje použití vysokých koncentrací fosfinu, což vede k problémům s vysokým signálem pozadí při zobrazovacích aplikacích. Byly učiněny pokusy bojovat proti problému vysokého pozadí prostřednictvím vývoje fluorogenních fosfinových činidel založených na fluorescein a luciferin, ale vnitřní kinetika zůstává omezením.[14]
Chemie klikání bez mědi
Chemie klikání bez mědi je bioorthogonální reakce, kterou poprvé vyvinula Carolyn Bertozzi jako aktivovaná varianta an azidalkýn Huisgen cykloadice, na základě práce od Karl Barry Sharpless et al. Na rozdíl od CuAAC byla chemie klikání bez obsahu Cu upravena tak, aby byla bioortogonální, a to odstraněním cytotoxického měděného katalyzátoru, což umožňuje rychlou reakci bez toxicity živých buněk. Místo mědi je reakcí kmínem podporovaná alkinyazidová cykloadice (SPAAC). Byl vyvinut jako rychlejší alternativa k ligaci Staudinger, přičemž první generace reagovaly více než šedesátkrát rychleji. Neuvěřitelná bioorthogonalita reakce umožnila aplikaci klikání bez obsahu Cu v kultivovaných buňkách, živých zebrafish a myších.

Toxicita mědi
Klasická cykloadice azidu a alkynu katalyzovaná mědí byla extrémně rychlou a účinnou klikovou reakcí pro biokonjugaci, ale není vhodná pro použití v živých buňkách kvůli toxicitě iontů Cu (I). Toxicita je způsobena oxidačním poškozením reaktivních forem kyslíku tvořených měděnými katalyzátory. Bylo také zjištěno, že komplexy mědi vyvolávají změny v buněčném metabolismu a jsou přijímány buňkami.
Došlo k určitému vývoji ligandů, které zabraňují poškození biomolekul a usnadňují jejich odstraňování in vitro aplikace. Bylo však zjištěno, že různá ligandová prostředí komplexů mohou stále ovlivňovat metabolismus a absorpci, což přináší nežádoucí narušení buněčné funkce.[15]
Bioorthogonality
Azidová skupina je zvláště bioortogonální, protože je extrémně malá (příznivá pro buněčnou propustnost a vyhýbá se poruchám), metabolicky stabilní a v buňkách přirozeně neexistuje, a proto nemá žádné konkurenční biologické vedlejší reakce. Ačkoli azidy nejsou nejreaktivnějším 1,3-dipólem dostupným pro reakci, jsou výhodné pro relativní nedostatek vedlejších reakcí a stabilitu v typických syntetických podmínkách.[16] The alkyn není tak malý, ale stále má potřebnou stabilitu a ortogonálnost in vivo Značení. Cyklooktyny jsou tradičně nejběžnějším cykloalkynem pro etiketovací studie, protože se jedná o nejmenší stabilní alkynový kruh.
Mechanismus
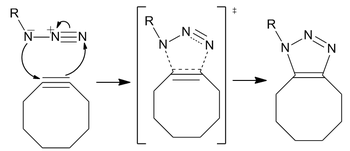
Reakce probíhá jako standardní 1,3-dipolární cykloadice, typ asynchronní, koordinované pericyklický posun. The ambivalentní povaha 1,3-dipólu by měla znemožnit identifikaci elektrofilního nebo nukleofilního centra na azidu tak, že směr toku cyklického elektronu nemá smysl. [p] Výpočet však ukázal, že distribuce elektronů mezi dusíky způsobuje, že největší atom dusíku nese největší záporný náboj.[17]
Regioselektivita
Ačkoli reakce produkuje regioisomerní směs triazolů, nedostatek regioselektivita v reakci není hlavním problémem pro většinu současných aplikací. Více regiospecifickým a méně bioorthogonálním požadavkům nejlépe vyhovuje Hloadgenova cykloadice katalyzovaná mědí, zejména s ohledem na syntetickou náročnost (ve srovnání s přidáním koncového alkynu) při syntéze napjatého cyklooktynu.
Vývoj cyklooktynů
| Cyklooktyn | Konstanta rychlosti druhého řádu (M−1s−1) |
|---|---|
| ŘÍJEN | 0.0024 |
| ALO | 0.0013 |
| MOFO | 0.0043 |
| DIFO | 0.076 |
| DIBO | 0.057 |
| BARAC | 0.96 |
| DIBAC (ADIBO) | 0.31 |
| DIMAC | 0.0030 |

ŘÍJEN byl první cyklooktyn vyvinutý pro chemii klikání bez obsahu Cu. Zatímco lineární alkyny jsou nereaktivní při fyziologických teplotách, OCT byl schopen snadno reagovat s azidy v biologických podmínkách, aniž by vykazoval toxicitu. Bylo však špatně rozpustné ve vodě a kinetika se stěhováním Staudingerovou ligací stěží zlepšila. ALO (aryl-méně oktyn) byl vyvinut pro zlepšení rozpustnosti ve vodě, ale stále měl špatnou kinetiku.
Monofluorované (MOFO) a difluorované (DIFO) cyklooktyny byly vytvořeny ke zvýšení rychlosti přidáním fluor-substituentů přitahujících elektrony na propargylic pozice. Fluor je dobrá skupina přitahující elektrony, pokud jde o syntetickou dostupnost a biologickou inertnost. Zejména nemůže tvořit elektrofilní Michael akceptor které mohou bočně reagovat s biologickými nukleofily.[7]DIBO (dibenzocyklokoktyn) byl vyvinut jako fúze se dvěma arylovými kruhy, což vedlo k velmi vysokému napětí a snížení energií zkreslení. Bylo navrženo, že biarylová substituce zvyšuje napětí v kruhu a poskytuje konjugaci s alkynem za účelem zlepšení reaktivity. Ačkoli výpočty předpovídaly, že mono-arylová substituce poskytne optimální rovnováhu mezi stérickým střetem (s azidovou molekulou) a kmenem,[18] monoarylované produkty se ukázaly jako nestabilní.
BARAC (biarylazacyclooctynone) následovalo přidání amidové vazby, která přidává sp2- jako střed pro zvýšení rychlosti zkreslením. Amide rezonance přispívá k dalšímu napětí, aniž by došlo k dalšímu nenasycení, které by vedlo k nestabilní molekule. Navíc přidání heteroatomu do cyklooktynového kruhu zlepšuje jak rozpustnost, tak farmakokinetiku molekuly. BARAC má dostatečnou rychlost (a citlivost) do té míry, že odplavování přebytečné sondy není nutné pro snížení pozadí. Díky tomu je velmi užitečný v situacích, kdy není možné mytí, jako při zobrazování v reálném čase nebo zobrazování celých zvířat. Ačkoli je BARAC mimořádně užitečný, jeho nízká stabilita vyžaduje, aby byl skladován při teplotě 0 ° C, chráněn před světlem a kyslíkem.[19]

Další úpravy variace na BARAC k výrobě DIBAC / ADIBO byly provedeny za účelem přidání kmene distálního kruhu a snížení sterických hodnot kolem alkinu k dalšímu zvýšení reaktivity. Keto-DIBO, ve kterém byla hydroxylová skupina převedena na keton, má trojnásobné zvýšení rychlosti v důsledku změny konformace kruhu. Pokusy o výrobu difluorbenzocyklooktynu (DIFBO) byly kvůli nestabilitě neúspěšné.
Problémy s DIFO s in vivo myší studie ilustrují obtížnost produkce bioorthogonálních reakcí. Ačkoli DIFO byl extrémně reaktivní při značení buněk, ve studiích na myších fungoval špatně kvůli vazbě na sérum albumin. Hydrofobicita cyklooktynu podporuje sekvestraci membránami a sérovými proteiny a snižuje biologicky dostupné koncentrace. V odpověď, DIMAC (dimethoxyazacyklooktyn) byl vyvinut za účelem zvýšení rozpustnosti, polarity a farmakokinetiky ve vodě,[20] ačkoli úsilí o bioortogonální označování myších modelů je stále ve vývoji.
Reaktivita
Výpočtové úsilí bylo zásadní při vysvětlování termodynamiky a kinetiky těchto cykloadičních reakcí, což hrálo zásadní roli při dalším zlepšování reakce. Existují dva způsoby aktivace alkynů bez ztráty stability: snížení energie přechodového stavu nebo snížení stability reaktantů.

Snížení stability reaktantů: Houk [21] navrhuje, aby rozdíly v energii (napřd ‡) potřebné k narušení azidu a alkynu do přechodových stavových geometrií řídí výšky bariéry pro reakci. Aktivační energie (E. ‡) je součet destabilizujících zkreslení a stabilizujících interakcí (E.i ‡). Nejvýznamnější zkreslení je u azidové funkční skupiny s menším příspěvkem zkreslení alkinu. Je to však pouze cyklooktyn, který lze snadno upravit pro vyšší reaktivitu. Vypočtené bariéry reakce pro fenylazid a acetylén (16,2 kcal / mol) versus cyklooktyn (8,0 kcal / mol) vede k předpokládanému zvýšení rychlosti o 106. Cyklooktyn vyžaduje méně energie zkreslení (1,4 kcal / mol oproti 4,6 kcal / mol), což má za následek nižší aktivační energii navzdory menší energii interakce.

Snižování energie přechodového stavu: Skupiny odebírající elektrony, jako je fluor, zvyšují rychlost snižováním LUMO energie a mezera HOMO-LUMO. To vede k většímu přenosu náboje z azidu na fluorovaný cyklooktyn v přechodovém stavu, zvýšení energie interakce (nižší záporná hodnota) a celkové energie aktivace.[22] Snížení LUMO je výsledkem hyperkonjugace mezi orbitály donoru alkinu π a akceptory CF σ *. Tyto interakce zajišťují stabilizaci především v přechodném stavu v důsledku zvýšených schopností dárců / akceptorů vazeb při jejich zkreslení. Výpočty NBO ukázaly, že zkreslení přechodového stavu zvyšuje energii interakce o 2,8 kcal / mol.
Hyperkonjugace mezi mimoplošnými π vazbami je větší, protože π vazby v rovině jsou špatně zarovnány. Ohyb přechodového stavu však umožňuje, aby vazby v rovině π měly více antiperiplanární uspořádání, které usnadňuje interakci. Dodatečné stabilizace energie hyperkonjugativní interakce je dosažena zvýšením elektronické populace σ * v důsledku formující se vazby CN. Negativní hyperkonjugace s vazbami σ * CF zvyšuje tuto stabilizující interakci.[17]
Regioselektivita
Ačkoli regioselektivita není velkým problémem v současných zobrazovacích aplikacích klikové chemie bez obsahu mědi, je to problém, který brání budoucím aplikacím v oblastech, jako je design léčiv nebo peptidomimetika.[23]
V současné době většina cyklooktynů reaguje za vzniku regioizomerních směsí. [m] Výpočtová analýza zjistila, že zatímco se regioselektivita v plynné fázi počítá tak, že zvýhodňuje 1,5 přídavku oproti 1,4 přídavku až o 2,9 kcal / mol v aktivační energii, solvatační korekce vedou ke stejným energetickým bariérám pro oba regioizomery. Zatímco 1,4 izomer v cykloadici DIFO je znevýhodněn svým větším dipólovým momentem, solvatace ho stabilizuje silněji než 1,5 izomer, což narušuje regioselektivitu.[22]

Symetrické cyklooktyny jako např BCN (bicyklo [6.1.0] nonyn) tvoří po cykloadici jeden regioizomer[24] a může sloužit k řešení tohoto problému v budoucnu.
Aplikace
Nejrozšířenější aplikací chemie kliknutí bez mědi je v biologickém zobrazování v živých buňkách nebo zvířatech za použití biomolekuly označené azidem a cyklooktynu nesoucího zobrazovací činidlo.
Fluorescenční keto a oximové varianty DIBO se používají při cvakávacích reakcích s fluoro-switchem, ve kterých je fluorescence cyklooktynu uhasena triazolem, který se tvoří při reakci.[25] Na druhou stranu, kumarinem konjugované cyklooktyny jako např coumBARAC byly vyvinuty tak, že alkyn potlačuje fluorescenci, zatímco tvorba triazolu zvyšuje fluorescenci kvantový výnos desetkrát.[26]

Prostorová a časová kontrola značení substrátu byla zkoumána pomocí fotoaktivovatelných cyklooktynů. To umožňuje ekvilibraci alkynu před reakcí, aby se snížily artefakty v důsledku koncentračních gradientů. Maskované cyklooktyny nejsou schopny reagovat s azidy ve tmě, ale po ozáření světlem se stávají reaktivními alkyny.[27]

Chemie kliknutí bez mědi je zkoumána pro použití při syntéze Zobrazování PET činidla, která musí být rychle připravena s vysokou čistotou a výtěžkem, aby se minimalizoval izotopový rozpad před podáním sloučenin. Konstanty vysoké rychlosti a bioorthogonalita SPAAC jsou přístupné chemii PET.[28]
Jiné bioorthogonální reakce
Nitronová dipólová cykloadice
Chemie klikání bez mědi byla přizpůsobena k použití nitronů jako 1,3-dipólu spíše než azidů a byla použita při modifikaci peptidů.[8]

Tato cykloadice mezi nitronem a cyklooktynem tvoří N-alkylované isoxazoliny. Rychlost reakce je zvýšena vodou a je extrémně rychlá s rychlostními konstantami druhého řádu v rozmezí od 12 do 32 M−1• s−1, v závislosti na substituci nitronu. I když je reakce extrémně rychlá, čelí problémům se začleněním nitronu do biomolekul prostřednictvím metabolického značení. Značení bylo dosaženo pouze posttranslační modifikací peptidu.
Norbornenová cykloadice
1,3 dipolární cykloadice byly vyvinuty jako bioorthogonální reakce za použití nitriloxidu jako 1,3-dipólu a norbornene jako dipolarofil. Jeho primární použití bylo při značení DNA a RNA v automatizovaných syntetizátorech oligonukleotidů.[29]

Norborneny byly vybrány jako dipolarofily kvůli jejich rovnováze mezi kmenem podporovanou reaktivitou a stabilitou. Nevýhody této reakce zahrnují zkříženou reaktivitu nitriloxidu kvůli silné elektrofilitě a pomalé kinetice reakce.
Cykloadice oxanorbornadienu
The oxanorbornadien cykloadice je 1,3-dipolární cykloadice následovaná retro-Diels Alder reakce za vzniku konjugátu vázaného na triazol s eliminací a furan molekula.[30] Předběžná práce prokázala jeho užitečnost v experimentech s označováním peptidů a byla také použita při generování peptidů SPECT zobrazovací sloučeniny.[31] V poslední době bylo použití oxanorbornadienu popsáno v reakci „iClick“ při pokojové teplotě bez katalyzátoru, ve které je modelová aminokyselina spojena s kovovou částí, v novém přístupu k bioorthogonálním reakcím.[32]

Kmen kruhu a nedostatek elektronů v oxanorbornadienu zvyšují reaktivitu vůči kroku omezujícímu rychlost cykloadice. Reakce retro-Dielse Olše nastává rychle poté a tvoří stabilní 1,2,3 triazol. Mezi problémy patří špatná tolerance vůči substituentům, které mohou měnit elektroniku oxanorbornadienu a nízké rychlosti (rychlostní konstanty druhého řádu řádově 10−4).
Ligace tetrazinem
The ligace tetrazinu je reakce trans-cyklooktenu a s-tetrazin v reakci Diels Alder s inverzní poptávkou následovanou reakcí retro-Diels Alder k odstranění plynného dusíku.[33] Reakce je extrémně rychlá s rychlostní konstantou druhého řádu 2 000 M.−1–S−1 (v methanolu / vodě 9: 1) umožňující úpravy biomolekul při extrémně nízkých koncentracích.

Na základě výpočtové práce Bacha je deformační energie pro Z-cyklookteny 7,0 kcal / mol ve srovnání s 12,4 kcal / mol pro cyklooktan kvůli ztrátě dvou transanulárních interakcí. E-cyklookten má vysoce zkroucenou dvojnou vazbu, což vede k deformační energii 17,9 kcal / mol.[34] Jako takový se vysoce reaktivní trans-cyklookten používá jako reaktivní dienophile. The dien je 3,6-diaryl-s-tetrazin, který byl substituován, aby odolal okamžité reakci s vodou. Reakce probíhá počáteční cykloadicí, po které následuje reverzní Diels Alder k eliminaci N2 a zabránit reverzibilitě reakce.[10]
Nejenže je reakce tolerantní k vodě, ale bylo zjištěno, že rychlost se zvyšuje ve vodném prostředí. Byly také provedeny reakce s použitím norbornenů jako dienofilů při rychlostech druhého řádu řádově 1 M−1• s−1 ve vodném médiu. Reakce byla použita při označování živých buněk[35] a polymerní kopulace.[36]
[4 + 1] Cykloadice
Tato izokyanidová kliková reakce je [4 + 1] cykloadicí následovanou retro-Diels Alderovou eliminací N2.[11]

Reakce probíhá s počáteční [4 + 1] cykloadicí následovanou reverzí, aby se eliminoval termodynamický propad a zabránilo reverzibilitě. Tento produkt je stabilní, pokud se použije terciární amin nebo isokyanopropanoát. Pokud se použije sekundární nebo primární isokyanid, produkt bude tvořit já těžím který se rychle hydrolyzuje.
Isocyanid je oblíbeným chemickým reportérem kvůli své malé velikosti, stabilitě, netoxičnosti a nepřítomnosti v savčích systémech. Reakce je však pomalá, s rychlostními konstantami druhého řádu řádově 10−2 M−1• s−1.
Chemie fotokliků na tetrazol
Chemie Photoclick využívá k uvolnění dusíku fotoindukovanou cykloverzi2. To generuje krátkodobý 1,3-nitril-iminový meziprodukt ztrátou plynného dusíku, který prochází 1,3-dipolární cykloadicí s alkenem za vzniku pyrazolinových cykloaduktů.[11]

Fotoindukce probíhá krátkým vystavením světlu (vlnová délka je závislá na tetrazolu), aby se minimalizovalo fotodamage buněk. Reakce je zesílena za vodných podmínek a vytváří jediný regioizomer.
Přechodný nitrilimin je vysoce reaktivní pro 1,3-dipolární cykloadici díky ohnuté struktuře, která snižuje energii zkreslení. Substituce skupinami poskytujícími elektrony na fenylových kruzích zvyšuje energii HOMO, pokud je umístěna na 1,3 nitriliminu, a zvyšuje rychlost reakce.
Mezi výhody tohoto přístupu patří schopnost prostorově nebo časově řídit reakci a schopnost začlenit jak alkeny, tak tetrazoly do biomolekul pomocí jednoduchých biologických metod, jako je genetické kódování.[37] Kromě toho může být tetrazol navržen tak, aby byl fluorogenní, aby bylo možné sledovat průběh reakce.[38]
Ligace čtyřkolky
The ligace čtyřkolky využívá vysoce napjatý kvadricyklan pro podstoupení [2 + 2 + 2] cykloadice se systémy π.[12]
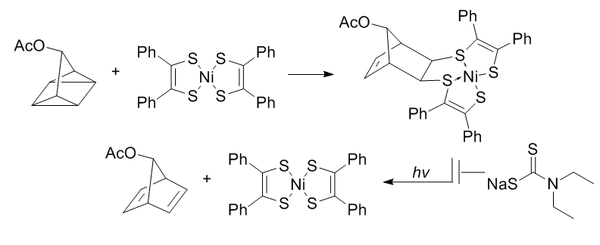
Quadricyclane je abiotický, nereaktivní s biomolekulami (kvůli úplné saturaci), relativně malý a velmi napjatý (~ 80 kcal / mol). Je však vysoce stabilní při teplotě místnosti a ve vodných podmínkách při fyziologickém pH. Je selektivně schopen reagovat s elektronově chudými systémy π, ale ne s jednoduchými alkeny, alkyny nebo cyklooktyny.
Bis (dithiobenzil) nikl (II) byl vybrán jako reakční partner z kandidátního screeningu na základě reaktivity. Aby se zabránilo reverzi vyvolané světlem na norbornadien, přidá se diethyldithiokarbamát k chelataci niklu ve výrobku.

Tyto reakce jsou zesíleny vodnými podmínkami s rychlostní konstantou druhého řádu 0,25 M−1• s−1. Obzvláště zajímavé je, že bylo prokázáno, že je bioortogonální jak pro tvorbu oximů, tak pro chemii klikání bez obsahu mědi.
Použití
Bioorthogonální chemie je atraktivní nástroj pro předběžné cílení experimentů v jaderné zobrazování a radioterapie.[39]
Reference
- ^ Sletten, Ellen M .; Bertozzi, Carolyn R. (2009). „Bioorthogonal Chemistry: Fishing for Selectivity in the Sea of Functionality“. Angewandte Chemie International Edition. 48 (38): 6974–98. doi:10.1002 / anie.200900942. PMC 2864149. PMID 19714693.
- ^ Prescher, Jennifer A .; Dube, Danielle H .; Bertozzi, Carolyn R. (2004). "Chemická remodelace buněčných povrchů u živých zvířat". Příroda. 430 (7002): 873–7. Bibcode:2004 Natur.430..873P. doi:10.1038 / nature02791. PMID 15318217. S2CID 4371934.
- ^ Prescher, Jennifer A; Bertozzi, Carolyn R (2005). "Chemie v živých systémech". Přírodní chemická biologie. 1 (1): 13–21. doi:10.1038 / nchembio0605-13. PMID 16407987. S2CID 40548615.
- ^ A b Sletten, Ellen M .; Bertozzi, Carolyn R. (2011). „Od mechanismu k myši: Příběh dvou bioorthogonálních reakcí“. Účty chemického výzkumu. 44 (9): 666–676. doi:10.1021 / ar200148z. PMC 3184615. PMID 21838330.
- ^ Plass, Tilman; Milles, Sigrid; Koehler, Christine; Schultz, Carsten; Lemke, Edward A. (2011). „Geneticky kódovaná chemie klikání bez obsahu mědi“. Angewandte Chemie International Edition. 50 (17): 3878–3881. doi:10,1002 / anie.201008178. PMC 3210829. PMID 21433234.
- ^ Neef, Anne B .; Schultz, Carsten (2009). "Selektivní fluorescenční značení lipidů v živých buňkách". Angewandte Chemie International Edition. 48 (8): 1498–500. doi:10.1002 / anie.200805507. PMID 19145623.
- ^ A b Baskin, J. M .; Prescher, J. A .; Laughlin, S. T .; Agard, N.J .; Chang, P. V .; Miller, I. A .; Lo, A .; Codelli, J. A .; Bertozzi, C. R. (2007). „Chemie klikání bez mědi pro dynamické zobrazování in vivo“. Sborník Národní akademie věd. 104 (43): 16793–7. Bibcode:2007PNAS..10416793B. doi:10.1073 / pnas.0707090104. PMC 2040404. PMID 17942682.
- ^ A b Ning, Xinghai; Temming, Rinske P .; Dommerholt, Jan; Guo, červen; Blanco-Ania, Daniel; Debets, Marjoke F .; Wolfert, Margreet A .; Boons, Geert-Jan; Van Delft, Floris L. (2010). „Modifikace bílkovin pomocí cykloadice Alkyne-Nitrone podporované kmenem“. Angewandte Chemie International Edition. 49 (17): 3065–8. doi:10,1002 / anie.201000408. PMC 2871956. PMID 20333639.
- ^ Yarema, K. J .; Mahal, LK; Bruehl, RE; Rodriguez, EC; Bertozzi, ČR (1998). "Metabolické dodávání ketonových skupin zbytkům kyseliny sialové. APLIKACE NA CELKOVÝ POVRCH GLYCOFORMOVÉ INŽENÝRSTVÍ". Journal of Biological Chemistry. 273 (47): 31168–79. doi:10.1074 / jbc.273.47.31168. PMID 9813021.
- ^ A b Blackman, Melissa L .; Royzen, Maksim; Fox, Joseph M. (2008). „Tetrazinová ligace: Rychlá biokonjugace založená na Diels-Alderově reaktivitě s inverzní elektronovou poptávkou“. Journal of the American Chemical Society. 130 (41): 13518–9. doi:10.1021 / ja8053805. PMC 2653060. PMID 18798613.
- ^ A b C Stöckmann, Henning; Neves, André A .; Schody, Shaun; Brindle, Kevin M .; Leeper, Finian J. (2011). „Exploring isonitril-based chemistry click for ligation with biomolecules“. Organická a biomolekulární chemie. 9 (21): 7303–5. doi:10.1039 / C1OB06424J. PMID 21915395.
- ^ A b Sletten, Ellen M .; Bertozzi, Carolyn R. (2011). „Bioorthogonal Quadricyclane Ligation“. Journal of the American Chemical Society. 133 (44): 17570–3. doi:10.1021 / ja2072934. PMC 3206493. PMID 21962173.
- ^ Saxon, E .; Bertozzi, ČR (2000). "Cell Surface Engineering pomocí modifikované Staudingerovy reakce". Věda. 287 (5460): 2007–10. Bibcode:2000Sci ... 287.2007S. doi:10.1126 / science.287.5460.2007. PMID 10720325. S2CID 19720277.
- ^ Pamela, Chang .; Prescher, Jennifer A .; Hangauer, Matthew J .; Bertozzi, Carolyn R. (2008). „Zobrazování glykanů na povrchu buněk s bioorthogonálními chemickými reportéry“. J Am Chem Soc. 129 (27): 8400–8401. doi:10.1021 / ja070238o. PMC 2535820. PMID 17579403.
- ^ Kennedy, David C .; McKay, Craig S .; Legault, Marc C. B .; Danielson, Dana C .; Blake, Jessie A .; Pegoraro, Adrian F .; Stolow, Albert; Mester, Zoltan; Pezacki, John Paul (2011). "Buněčné důsledky komplexů mědi používaných k katalyzování bioorthogonálních reakcí kliknutí". Journal of the American Chemical Society. 133 (44): 17993–8001. doi:10.1021 / ja2083027. PMID 21970470.
- ^ Huisgen, Rolf. (1976). „1,3-Dipolární cykloadice. 76. Souhrnná povaha 1,3-dipolárních cykloadic a otázka diradikálních meziproduktů.“. The Journal of Organic Chemistry. 41 (3): 403–419. doi:10.1021 / jo00865a001.
- ^ A b Zlato, Brian; Ševčenko, Nikolay E .; Bonus, Natalie; Dudley, Gregory B .; Alabugin, Igor V. (2011). „Selektivní stabilizace přechodového stavu pomocí hyperkonjugativní a konjugativní pomoci: Stereoelektronický koncept pro chemii klikání bez mědi“. The Journal of Organic Chemistry. 77 (1): 75–89. doi:10.1021 / jo201434w. PMID 22077877.
- ^ Chenoweth, Kimberly; Chenoweth, David; Goddard Iii, William A. (2009). „Činidla na bázi cyklooktynů pro nekatalyzovanou chemii klikání: výpočetní průzkum“ (PDF). Organická a biomolekulární chemie. 7 (24): 5255–8. doi:10.1039 / B911482C. PMID 20024122.
- ^ Jewett, John C .; Sletten, Ellen M .; Bertozzi, Carolyn R. (2010). „Rychlá chemie kliknutí bez obsahu Cu s snadno syntetizovanými biarylazacyklooktynony“. Journal of the American Chemical Society. 132 (11): 3688–90. doi:10.1021 / ja100014q. PMC 2840677. PMID 20187640.
- ^ Sletten, Ellen M .; Bertozzi, Carolyn R. (2008). „Hydrofilní azacyklooktyn pro chemii klikání bez obsahu Cu“. Organické dopisy. 10 (14): 3097–9. doi:10.1021 / ol801141k. PMC 2664610. PMID 18549231.
- ^ Ess, Daniel H .; Jones, Gavin O .; Houk, K.N. (2008). „Transition States of Strain-promoted Metal-Free Click Chemistry: 1,3-Dipolar Cycloaditionss of Fenyl Azide and Cyclooctynes“. Organické dopisy. 10 (8): 1633–6. doi:10.1021 / ol8003657. PMID 18363405.
- ^ A b Schoenebeck, Franziska; Ess, Daniel H .; Jones, Gavin O .; Houk, K.N. (2009). „Reaktivita a regioselektivita v 1,3-dipolárních cykloadicích azidů na napjaté alkyny a alkeny: výpočetní studie“. Journal of the American Chemical Society. 131 (23): 8121–33. doi:10.1021 / ja9003624. PMID 19459632.
- ^ Lutz, Jean-François (2008). „Cycloaditions Azide Alkyne Cycloaditions: New Insights and Perspectives“. Angewandte Chemie International Edition. 47 (12): 2182–4. doi:10.1002 / anie.200705365. PMID 18264961.
- ^ Dommerholt, Jan; Schmidt, Samuel; Temming, Rinske; Hendriks, Linda J. A .; Rutjes, Floris P. J. T .; Van Hest, Jan C. M .; Lefeber, Dirk J .; Friedl, Peter; Van Delft, Floris L. (2010). „Snadno dostupné cyklonony pro bioorthogonální značení a trojrozměrné zobrazování živých buněk“. Angewandte Chemie International Edition. 49 (49): 9422–5. doi:10,1002 / anie.201003761. PMC 3021724. PMID 20857472.
- ^ Mbua, Ngalle Eric; Guo, červen; Wolfert, Margreet A .; Steet, Richard; Boons, Geert-Jan (2011). „Kmenem podporované cyklizační cykly Alkyně-Azide (SPAAC) odhalují nové vlastnosti biosyntézy glykokonjugátu“. ChemBioChem. 12 (12): 1912–21. doi:10.1002 / cbic.201100117. PMC 3151320. PMID 21661087.
- ^ Jewett, John C .; Bertozzi, Carolyn R. (2011). „Syntéza fluorogenního cyklooktynu aktivovaného klikáním bez obsahu Cu“. Organické dopisy. 13 (22): 5937–9. doi:10.1021 / ol2025026. PMC 3219546. PMID 22029411.
- ^ Poloukhtine, Andrei A .; Mbua, Ngalle Eric; Wolfert, Margreet A .; Boons, Geert-Jan; Popik, Vladimir V. (2009). „Selektivní značení živých buněk reakcí na kliknutí vyvolanou fotografií“. Journal of the American Chemical Society. 131 (43): 15769–76. doi:10.1021 / ja9054096. PMC 2776736. PMID 19860481.
- ^ Carpenter, Richard D .; Hausner, Sven H .; Sutcliffe, Julie L. (2011). „Click-Free-Click for PET: Rapid 1,3-Dipolar Cycloaditions with a Fluorine-18 Cyclooctyne“. Dopisy ACS pro léčivou chemii. 2 (12): 885–889. doi:10,1021 / ml200187j. PMC 4018166. PMID 24900276.
- ^ Gutsmiedl, Katrin; Wirges, Christian T .; Ehmke, Veronika; Carell, Thomas (2009). „Copper-Free“ Click „Modifikace DNA pomocí nitril-oxid norbornen 1,3-dipolární cykloadice“. Organické dopisy. 11 (11): 2405–8. doi:10.1021 / ol9005322. PMID 19405510.
- ^ Van Berkel, Sander S .; Dirks, A. (Ton) J .; Debets, Marjoke F .; Van Delft, Floris L .; Cornelissen, Jeroen J. L. M .; Nolte, Roeland J. M .; Rutjes, Floris P. J. T. (2007). „Tvorba triazolu bez kovů jako nástroj pro biokonjugaci“. ChemBioChem. 8 (13): 1504–8. doi:10.1002 / cbic.200700278. PMID 17631666.
- ^ Van Berkel, Sander S .; Dirks, A. (Ton) J .; Meeuwissen, Silvie A .; Pingen, Dennis L. L .; Boerman, Otto C .; Laverman, Peter; Van Delft, Floris L .; Cornelissen, Jeroen J. L. M .; Rutjes, Floris P. J. T. (2008). „Aplikace tvorby triazolu bez kovů při syntéze cyklických konjugátů RGD DTPA“. ChemBioChem. 9 (11): 1805–15. doi:10.1002 / cbic.200800074. PMID 18623291.
- ^ Henry, Lucas; Schneider, Christopher; Mützel, Benedikt; Simpson, Peter V .; Nagel, Christoph; Fucke, Katharina; Schatzschneider, Ulrich (2014). „Aminokyselinová biokonjugace pomocí iClick reakce oxanorbornadienem maskovaného alkinu s MnI (bpy) (CO) 3 koordinovaným azidem“ (PDF). ChemComm. 50 (99): 15692–95. doi:10.1039 / C4CC07892F. PMID 25370120.
- ^ Row, R. David; Prescher, Jennifer A. (2016). „Tetrazin označuje místo“. ACS Central Science. 2 (8): 493–494. doi:10.1021 / acscentsci.6b00204. PMC 4999966. PMID 27610408.
- ^ Bach, Robert D. (2009). „Prstencová kmenová energie v cyklooktylovém systému. Vliv kmenové energie na [3 + 2] cykloadiční reakce s azidy“. Journal of the American Chemical Society. 131 (14): 5233–43. doi:10.1021 / ja8094137. PMID 19301865.
- ^ Devaraj, Neal K .; Weissleder, Ralph; Hilderbrand, Scott A. (2008). „Cykloadice založené na tetrazinu: aplikace pro předem cílené zobrazování živých buněk“. Biokonjugovaná chemie. 19 (12): 2297–9. doi:10.1021 / bc8004446. PMC 2677645. PMID 19053305.
- ^ Hansell, Claire F .; Espeel, Pieter; Stamenovic, Milan M .; Barker, Ian A .; Dove, Andrew P .; Du Prez, Filip E .; o Reilly, Rachel K. (2011). „Kliknutí bez aditiv pro funkčnost polymeru a vazbu tetrazin norbornenovou chemií“. Journal of the American Chemical Society. 133 (35): 13828–31. doi:10.1021 / ja203957h. PMID 21819063.
- ^ Lim, Reyna K. V .; Lin, Qing (2011). „Photoinducible Bioorthogonal Chemistry: A Spatiotemporally Controllable Tool to Visualize and Perturb Proteins in live Cells“. Účty chemického výzkumu. 44 (9): 828–839. doi:10.1021 / ar200021p. PMC 3175026. PMID 21609129.
- ^ Song, Wenjiao; Wang, Yizhong; Qu, červen; Lin, Qing (2008). "Selektivní funkcionalizace geneticky kódovaného proteinu obsahujícího alken pomocí" Photoclick Chemistry "v bakteriálních buňkách". Journal of the American Chemical Society. 130 (30): 9654–5. doi:10.1021 / ja803598e. PMID 18593155.
- ^ Knight, James C .; Cornelissen, Bart (2014). „Bioorthogonal chemistry: implications for pretargeted nuclear (PET / SPECT) imaging and therapy“. American Journal of Nuclear Medicine and Molecular Imaging. 4 (2): 96–113. ISSN 2160-8407. PMC 3992206. PMID 24753979.
