Tsuji – Trostova reakce - Tsuji–Trost reaction
The Tsuji – Trostova reakce (nazývané také Trost allylová alkylace nebo allylová alkylace) je palladium -katalyzovaný substituční reakce zahrnující substrát, který obsahuje a opouštějící skupina v allylický pozice. Palladiový katalyzátor nejprve koordinuje s allylovou skupinou a poté podstoupí oxidační přísada, tvořící π- ally komplex. Tento allylový komplex pak může být napaden a nukleofil, což má za následek substituovaný produkt.[1]

Tato práce byla poprvé propagována Jiro Tsuji v roce 1965[2] a později adaptován Barry Trost v roce 1973 zavedením fosfin ligandy.[3] Rozsah této reakce byl rozšířen na mnoho různých nukleofilů na bázi uhlíku, dusíku a kyslíku, mnoho různých odstupujících skupin, mnoho různých ligandů na bázi fosforu, dusíku a síry a mnoho různých kovů (i když palladium je stále výhodné).[4] Zavedení fosfinových ligandů vedlo ke zlepšení reaktivity a četným strategiím asymetrické allylové alkylace. Mnoho z těchto strategií je poháněno příchodem chirální ligandy, které jsou často schopny poskytovat vysoké enantioselektivita a vysoká diastereoselektivita za mírných podmínek. Tato modifikace značně rozšiřuje užitečnost této reakce pro mnoho různých syntetických aplikací. Schopnost za těchto podmínek tvořit vazby uhlík-uhlík, uhlík-dusík a uhlík-kyslík činí tuto reakci velmi lákavou pro oblasti medicínské chemie i syntézy přírodních produktů.
Dějiny
V roce 1962 publikoval Smidt práci na oxidaci katalyzované palladiem alkeny na karbonyl skupiny. V této práci bylo zjištěno, že palladiový katalyzátor aktivoval alken pro nukleofilní útok hydroxid.[5] Tsuji získal vhled z této práce a předpokládal, že k podobné aktivaci může dojít za vzniku vazeb uhlík-uhlík. V roce 1965 Tsuji oznámil práci, která potvrdila jeho hypotézu. Reakcí chloridu allylpalladia dimer se sodnou solí diethyl malonát, skupina byla schopna vytvořit směs monoalkylovaný a dialkylovaný produkt.[6]
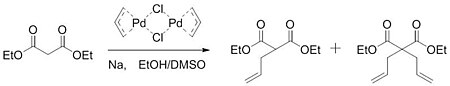
Rozsah reakce se rozšiřoval jen postupně, dokud Trost neobjevil další velký průlom v roce 1973. Při pokusu o syntézu acyklických seskviterpenových homologů narazil Trost na počáteční postup a nebyl schopen alkylovat jeho substráty. Tyto problémy byly překonány přidáním trifenylfosfin do reakční směsi.

Tyto podmínky byly poté testovány na jiné substráty a některé vedly k „v podstatě okamžité reakci při teplotě místnosti“. Brzy poté vyvinul způsob, jak tyto ligandy použít pro asymetrickou syntézu.[7] Není divu, že to podnítilo mnoho dalších zkoumání této reakce a vedlo k důležité roli, kterou tato reakce nyní hraje v syntetické chemii.
Mechanismus
Počínaje a nulový druh palladia a substrát obsahující odstupující skupinu v allylové poloze probíhá reakce Tsuji – Trost přes katalytický cyklus zvýrazněný níže.

Nejprve se palladium koordinuje s alkenem a tvoří a η2 π-allyl-Pd0 Π komplex. Dalším krokem je oxidační přísada ve kterém je odcházející skupina vyloučena inverze konfigurace a a η3 π-allyl-PdII je vytvořen (také nazývaný ionizace). Nukleofil se poté přidá k allylové skupině regenerující η2 π-allyl-Pd0 komplex. Po dokončení reakce se palladium oddělí od alkenu a může začít znovu v katalytický cyklus.[8]
„Tvrdý“ versus „měkký“ nukleofil
Použité nukleofily jsou obvykle generovány z prekurzorů (pronukleofilů) in situ po jejich deprotonace se základnou.[9] Tyto nukleofily se poté dělí na „tvrdé“ a „měkké“ nukleofily pomocí paradigmatu pro popis nukleofilů, které do značné míry spočívají na pKas Jejich konjugované kyseliny. „Tvrdé" nukleofily mají obvykle konjugované kyseliny s pKas vyšší než 25, zatímco „měkké" nukleofily mají obvykle konjugované kyseliny s pKas menší než 25.[10] Tento deskriptor je důležitý z důvodu dopadu těchto nukleofilů na stereoselektivita produktu. Stabilizované nebo „měkké“ nukleofily převrátit stereochemii z π- ally komplex. Tato inverze ve spojení s inverzí ve stereochemii spojené s oxidačním přídavkem palladia vede k čisté retenci stereochemie. Nestabilizované nebo "tvrdé" nukleofily si naopak zachovávají stereochemii π-allylový komplex, což vede k čisté inverzi stereochemie.[11]
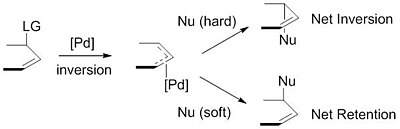
Tento trend je vysvětlen zkoumáním mechanismů nukleofilního útoku. „Měkké“ nukleofily útočí na uhlík allylové skupiny, zatímco „tvrdé“ nukleofily útočí na kovové centrum, následuje redukční eliminace.[12]
Fosfinové ligandy
Fosfinové ligandy, jako je trifenylfosfin nebo Trost ligand, byly použity k výraznému rozšíření rozsahu reakce Tsuji-Trost. Tyto ligandy mohou modulovat vlastnosti palladiového katalyzátoru, jako je sterický objem stejně jako elektronické vlastnosti. Důležité je, že tyto ligandy mohou také vnášet chiralitu do konečného produktu, což umožňuje provádět tyto reakce asymetricky Jak je ukázáno níže.
Allylická asymetrická substituce
Enantioselektivní verze reakce Tsuji-Trost se nazývá Trost asymetrická allylová alkylace (Trost AAA) nebo jednoduše asymetrická allylová alkylace (AAA). Tyto reakce se často používají při asymetrické syntéze.[13][14][15] Reakce byla původně vyvinuta s palladiovým katalyzátorem podporovaným Trost ligand, i když se od té doby velmi rozšířily vhodné podmínky. Enantioselektivitu lze reakci předat během kteréhokoli z kroků kromě dekomplexace palladia z alkenu od stereocentrum je již v tomto bodě nastavena. Bylo konceptualizováno pět hlavních způsobů, jak využít těchto kroků a získat enantioselektivní reakční podmínky. Tyto metody enantiodiskriminace byly dříve přezkoumány společností Trost:
- Preferenční ionizace prostřednictvím enantioselektivní komplexace olefinů
- Enantiotopická ionizace odcházejících skupin
- Útok na Enantiotopic Termini Allyl Complex
- Enantioface Exchange v π- Allyl Complex
- Diferenciace prochirálních nukleofilních tváří
Upřednostňovaná metoda pro enantiodiskriminaci je do značné míry závislá na sledovaném substrátu a v některých případech může být enantioselektivita ovlivněna několika z těchto faktorů.
Rozsah
Nukleofily
Bylo popsáno, že pro tuto reakci je účinných mnoho různých nukleofilů. Mezi nejběžnější nukleofily patří malonáty, enoláty, primární alkoxidy, karboxyláty, fenoxidy, aminy, azidy, sulfonamidy, imides, a sulfony.
Opouštíme skupiny
Rozsah odstupujících skupin byl také rozšířen, aby zahrnoval řadu různých odstupujících skupin uhličitany, fenoly, fosfáty, halogenidy a karboxyláty jsou nejpoužívanější.
„Tvrdé“ a „měkké“ nukleofily
Nedávná práce prokázala, že rozsah „měkkých“ nukleofilů lze rozšířit tak, aby zahrnoval některé pronukleofily, které mají mnohem vyšší pKas než ~ 25. Některé z těchto „měkkých“ nukleofilů mají pKas v rozmezí až 32,[16] a ještě více základních pronukleofilů (~ 44) bylo prokázáno, že působí jako měkké nukleofily s přidáním Lewisovy kyseliny které pomáhají usnadnit deprotonaci.[17]Vylepšený rozsah pKa „měkkých“ nukleofilů je zásadní, protože tyto nukleofily jsou jediné, které byly prozkoumány[18][19] pro enantioselektivní reakce až do nedávné doby[20] (ačkoli neenantioselektivní reakce „tvrdých“ nukleofilů jsou již nějakou dobu známy[21]). Zvýšením rozsahu pronukleofilů, které působí jako „měkké“ nukleofily, lze tyto substráty také začlenit do enantioselektivních reakcí pomocí dříve popsaných a dobře charakterizovaných metod.
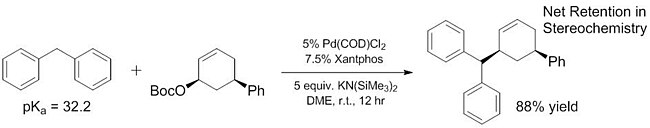
Ligandy
V návaznosti na reaktivitu trifenylfosfinového ligandu se struktura ligandů použitých pro reakci Tsuji-Trost rychle stala složitější. Dnes mohou tyto ligandy obsahovat fosfor, síru, dusík nebo nějakou kombinaci těchto prvků, ale většina studií se soustředila na mono- a difosfinové ligandy. Tyto ligandy lze dále klasifikovat na základě povahy jejich chirality, přičemž některé ligandy obsahují centrální chirality na atomech fosforu nebo uhlíku, některé obsahují biaryl axiální chirality a další obsahující planární chirality. Difosfinové ligandy s centrální chiralitou se ukázaly jako účinný typ ligandu (zejména pro postupy asymetrické allylické alkylace), přičemž jedním z takových příkladů je Trost Ligand.[22]Fosfinooxazoliny (PHOX) ligandy byly použity v AAA, zejména s nukleofily na bázi uhlíku.[23]
Další podklady
Reakční substrát byl také rozšířen na alleny. V tomto konkrétním rozšíření kruhu reakce AAA je také doprovázena a Wagner – Meerweinův přesmyk:[24][25]
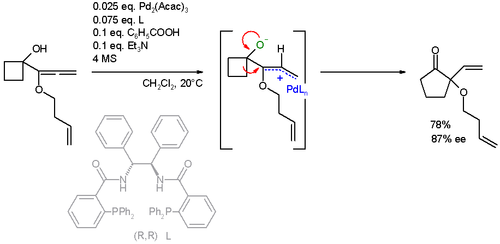
Aplikace
Syntéza farmaceutických / přírodních produktů
Schopnost enantioselektivně tvořit vazby uhlík-uhlík, uhlík-dusík a uhlík-kyslík za mírných podmínek činí Trostovou asymetrickou allylickou alkylaci extrémně přitažlivou pro syntézu komplexních molekul.
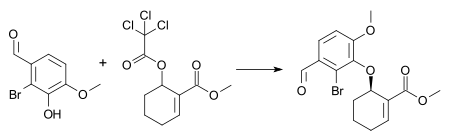
Příkladem této reakce je syntéza středně pokročilí v kombinaci celková syntéza galantaminu a morfium[26] s 1 mol% [dimer pi-allylpalladium chloridu], 3 mol% (S, S) Trost ligand, a triethylamin v dichlormethan na pokojová teplota. Tyto podmínky vedou k tvorbě (-) - enantiomeru aryletheru v 72% chemický výtěžek a 88% enantiomerní přebytek.
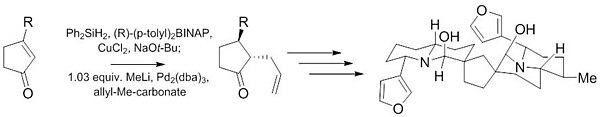
Další reakce Tsuji – Trost byla použita během počátečních fází syntézy (-) - neothiobinupharidinu. Tato nedávná práce ukazuje schopnost této reakce poskytnout vysoce diastereoselektivní (10: 1) a enantioselektivní (97,5: 2,5) produkty z achirál výchozí materiál pouze s malým množstvím katalyzátoru (1% ).[27]
Detekce palladia
Kromě praktického použití této reakce v medicinální chemii a syntéze přírodních produktů používá nedávná práce také reakci Tsuji-Trost k detekci palladia v různých systémech. Tento detekční systém je založen nafluorescenční fluorescein -odvozený senzor (senzory s delší vlnovou délkou byly nedávno vyvinuty také pro jiné aplikace[28]), která se stává fluorescenční pouze v přítomnosti palladia nebo platiny. Tato schopnost snímat palladium / platinu je způsobena reakcí Tsuji – Trost. Senzor obsahuje allylovou skupinu s fluoresceinem fungujícím jako odstupující skupina. The π- vytvoří se allyl komplex a po nukleofilních útokech se uvolní fluorescein, čímž se získá výrazné zvýšení fluorescence.[29][30]

Tento jednoduchý, vysoce výkonná metoda Ukázalo se, že detekce palladia monitorováním fluorescence je užitečná při monitorování hladin palladia v roce 2006 kovové rudy,[31] farmaceutické výrobky,[32] a dokonce i dovnitř živé buňky.[33] Se stále rostoucí popularitou katalýza palladiem by tento typ rychlé detekce měl být velmi užitečný při snižování kontaminace farmaceutických produktů a při prevenci znečištění životního prostředí palladiem a platinou.
externí odkazy
- Org. Synth. 1989, 67, 105
- Org. Synth. 2009, 86, 47
- příklad reakce tsuji-trost v celkové syntéze viz: http://www.biocis.u-psud.fr/IMG/pdf/concise_total_synthesis_of_Minfiensine.pdf druhá reakce nalezená na webových stránkách týmu biocis: http://www.biocis.u-psud.fr/spip.php?article332
Reference
- ^ Strategické aplikace pojmenovaných reakcí v organické syntéze (brožovaný výtisk) autor: Laszlo Kurti, Barbara Czako ISBN 0-12-429785-4
- ^ Organické syntézy pomocí sloučenin vzácných kovů XVII. Reakce π-allylpalladiumchlorid s nukleofily Čtyřstěn dopisy, Díl 6, číslo 49, 1965, strany 4387-4388 Jiro Tsuji, Hidetaka Takahashi, Masanobu Morikawa doi:10.1016 / S0040-4039 (00) 71674-1
- ^ Trost, B. M.; Fullerton, T. J. "Nové syntetické reakce. Allylová alkylace." J. Am. Chem. Soc. 1973, 95, 292–294. doi:10.1021 / ja00782a080.
- ^ Rios, Itzel Guerrero; Rosas-Hernandez, Alonso; Martin, Erika; „Nedávné pokroky v aplikaci chirálních fosfinových ligandů v Pd-katalyzované asymetrické allylové alkylaci.“ Molekuly, 2011, 16 970–1010. doi:10,3390 / molekuly 16010970
- ^ Smidt, J., Hafner, W., Jira, R., Sieber, R., Sedlmeier, J. a Sabel, A. (1962), Olefinoxydation mit Palladiumchlorid-Katalysatoren. Angewandte Chemie, 74: 93–102. doi:10,1002 / ange.19620740302
- ^ Organické syntézy pomocí sloučenin vzácných kovů XVII. Reakce π-allylpalladiumchlorid s nukleofily Čtyřstěn dopisy, Svazek 6, číslo 49, 1965, strany 4387–4388 Jiro Tsuji, Hidetaka Takahashi, Masanobu Morikawa doi:10.1016 / S0040-4039 (00) 71674-1
- ^ Asymetrické přechody Allylic Alkylations katalyzované kovem Barry M. Trost David L. Van Vranken Chem. Rev., 1996, 96 (1), str. 395–422 doi:10.1021 / cr9409804
- ^ Trost, Barry M .; Zhang, Ting; Sieber, Joshua D .; „Katalytická asymetrická allylová alkylace s využitím heteroatomových nukleofilů: mocná metoda pro tvorbu vazeb C-X.“ Chem. Sci. 2010, 1, 427–440.
- ^ Strategické aplikace pojmenovaných reakcí v organické syntéze (brožovaný výtisk) autor: Laszlo Kurti, Barbara Czako ISBN 0-12-429785-4
- ^ Trost, B. M .; Thaisrivongs, D. A. J. Am. Chem. Soc. 2008, 130, 14092
- ^ Luparia, Marco; Oliverira, Maria Teresa; Audisio, Davide; Frebault, Frederic; Goddard, Richard; Maulide, Nuno; „Katalytická asymetrická diastereodivergentní derakemizace.“ Angew. Chem. Int. Vyd. 2011, 50, 12631–12635.
- ^ B. M. Trost, T. R. Verhoeven, J. M. Fortunak, Tetrahedron Lett. 1979, 20, 2301 - 2304
- ^ Trost, B. M.; Dietsch, T. J. "Nové syntetické reakce. Asymetrická indukce v allylových alkylacích." J. Am. Chem. Soc. 1973, 95, 8200–8201. doi:10.1021 / ja00805a056.
- ^ Trost, B. M.; Strege, P. E. "Asymetrická indukce v katalytické allylové alkylaci." J. Am. Chem. Soc. 1977, 99, 1649–1651. doi:10.1021 / ja00447a064.
- ^ Asymetrické Allylické alkylace katalyzované přechodem na kov: Aplikace v celkové syntéze Trost, B. M .; Crawley, M. L. Chem. Rev.; (Posouzení); 2003; 103(8); 2921–2944. doi:10.1021 / cr020027w
- ^ Sha, Sheng-Chun; Zhang, Jiadi; Carroll, Patrick J .; Walsh, Patrick J .; „Zvýšení limitu pKa„ měkkých “nukleofilů v alylických substitucích katalyzovaných palladiem: aplikace diarylmethanových nukleofilů.“ JACS. 2013, 135, 17602–17609. doi: 10,1021 / ja409511n
- ^ Zhang, J .; Stanciu, C .; Wang, B .; Hussain, M. M .; Da, C.-S .; Carroll, P. J .; Dreher, S. D .; Walsh, P. J. Palladium-Catalyzed Allylic Substitution with (η6-Arene – CH2Z) Cr (CO) 3-Based Nucleophiles, J. Am. Chem. Soc. 2011, 133, 20552.
- ^ Trost, B. M .; Toste, F. D. J. Am. Chem. Soc. 1999, 121, 4545.
- ^ Trost, B. M .; Macháček, M. R.; Aponick, A. Acc. Chem. Res. 2006, 39, 747.
- ^ Li, Xiao-Hui; Zheng, Bao-Hui; Ding, Chang-Hua; Hou, Xue-Long; „Enantioselektivní syntéza 2,3-disubstituovaných indanonů prostřednictvím Pd-katalyzované intramolekulární asymetrické alylické alkylace ketonů.“ Org. Lett. CO NEJDŘÍVE. doi: 10,1021 / ol402980v
- ^ Castanet, Y .; Petit, F. Tetrahedron Lett. 1979, 20, 3221.
- ^ Lu, Zhan; Ma, Shengming; „Metal-Catalyzed Enantioselective Allylation in Asymetric Synthesis.“ Angew. Chem. Int. Vyd. 2008, 47, 258–297. doi: 10,1002 / anie.200605113
- ^ Behenna, D. C .; Stoltz, B. M., Shengming; „Enantioselektivní Tsuji Allylation.“ J. Am. Chem. Soc. 2004, 126, 15044–15045. doi: 10,1021 / ja044812x
- ^ Trost, B. M.; Xie, J. „Palladiem katalyzovaná asymetrická kruhová expanze allenylcyklobutanolu: asymetrický Wagner – Meerweinův posun.“ J. Am. Chem. Soc. 2006, 128, 6044–6045. doi:10.1021 / ja0602501.
- ^ Kokatalyzátory jsou kyselina benzoová a triethylamin. Molekulární síta (MS) zabraňují hydrolýze.
- ^ Trost, B. M.; Tang, W .; Toste, F. D. "Divergentní enantioselektivní syntéza (-) - galantaminu a (-) - morfinu." J. Am. Chem. Soc. 2005, 127, 14785–14803. doi:10.1021 / ja054449 +.
- ^ Jansen, Daniel J .; Shenvi, Ryan A .; "Syntéza (-) - neothiobinupharidinu." JACS. 2013, 135, 1209–1212. doi: 10,1021 / ja310778t
- ^ Wang, Zhifei; Zheng, Shuang; Cai, Jin; Wang, Peng; Feng, Jie; Yang, Xia; Zhang, vápnění; Ji, Min; Wu, Fugen; On, Nongyue; Wan, Neng; „Fluorescenční umělý enzymový imunoanalytický systém založený na Pd / C nanokatalyzátoru a fluorescenčním chemodosimetru.“ Anální. Chem. CO NEJDŘÍVE. doi: 10,1021 / ac403001y
- ^ Garner, Amanda L .; Koide, Kazunori; „Studie fluorogenní sondy pro palladium a platinu vedoucí k metodě detekce specifické pro palladium.“ Chem. Commun. 2009, 86–88. doi: 10.1039 / b814197e
- ^ Píseň, Fengling; Garner, Amanda L .; Koide, Kazunori; „Vysoce citlivý fluorescenční senzor pro palladium založený na mechanismu allylického oxidačního zavádění.“ JACS. 2007, 129, 12354–12355. doi: 10,1021 / ja073910q
- ^ Williams, Jessica M .; Koide, Kazunori; „Vysoce výkonná metoda pro detekci palladia v rudách.“ Ind. Eng. Chem. Res. 2013, 52, 8612–8615. doi: 10,1021 / ie400959z
- ^ Bu, Xiaodong; Koide, Kazunori; Carder, Evan J .; Welch, Christopher J .; „Rychlá analýza zbytkového palladia ve farmaceutickém vývoji pomocí fluorometrické metody založené na katalýze.“ Org. Process Res. Dev. 2013, 17, 108–113. doi: 10,1021 / op3003008
- ^ Zhu, Baocun; Gao, Chenchen; Zhao, Yunzhou; Liu, Caiyun; Li, Yamin; Wei, Qin; Ma, Zhenmin; Du, Bin; Zhang, Xiaoling; „Poměrný fluorescenční chemodosimetr odvozený od 4-hydroxynaftalimidu pro zobrazování palladia v živých buňkách.“ Chem. Commun. 2011, 47, 8656–8658. doi: 10.1039 / c1cc13215f
