Nadrodina dělení odpor-nodulace-buněčné dělení - Resistance-nodulation-cell division superfamily - Wikipedia
| RND permease superrodina | |
|---|---|
 Krystalizovaná AcrB: HAE-RND podtřída protein zapojený do léku a amfifilní výtok | |
| Identifikátory | |
| Symbol | RND_Prosím |
| Pfam klan | CL0322 |
| TCDB | 2.A.6 |
| OPM nadčeleď | 16 |
| OPM protein | 2gif |
Odpor-nodulační dělení (RND) rodinné transportéry jsou kategorií bakteriální efluxní pumpy, zvláště identifikováno v Gramnegativní bakterie a nachází se v cytoplazmatické membráně aktivně přepravovat substráty. RND nadčeleď zahrnuje sedm rodin: odliv těžkých kovů (HME), hydrofob / amfifilní eflux-1 (gramnegativní bakterie), skupina vývozců nodulačních faktorů (NFE), rodina doplňkových proteinů sekrece proteinů SecDF, rodina hydrofobů / amfifilních efluxů-2, eukaryotický sterol homeostáza rodina a rodina hydrofobů / amfifilních efluxů-3.[1] Tyto systémy RND se podílejí na údržbě homeostáza buňky, odstranění toxické sloučeniny a export determinanty virulence.[2] Mají široké substrátové spektrum a při nadměrné expresi mohou vést ke snížení aktivity nesouvisejících tříd léčiv. První zprávy o odolnosti vůči lékům bakteriální infekce byly hlášeny ve čtyřicátých letech po první hromadné výrobě antibiotika.[3] Většina transportních systémů nadrodiny RND je vyrobena z velkých polypeptidových řetězců.[4] RND proteiny existují primárně v gramnegativních bakteriích, ale lze je také najít v grampozitivní bakterie, archaea, a eukaryoty.
Funkce
Protein RND určuje substrát pro dokončené transportní systémy, včetně: ionty kovů, xenobiotika nebo léky. Přeprava hydrofobní a amfifilní sloučeniny jsou prováděny podrodinou HAE-RND. Zatímco odliv těžké kovy jsou předtvarované HME-RND.[5]

Mechanismus a struktura
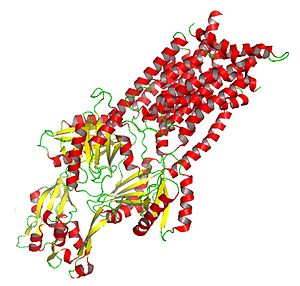
RND proteiny jsou velké a mohou obsahovat více než 1000 aminokyselina zbytky. Obvykle se skládají ze dvou homologní podjednotky (což naznačuje, že vznikly v důsledku nitrogenní tandemové duplikace, ke které došlo v pravěku před divergencí členů rodiny), z nichž každá obsahuje periplazmatický smyčka sousedící s 12 transmembránami šroubovice. Z dvanácti šroubovic je na transmembránovém klíči (TMS) jeden N-konec následuje velká extracytoplazmatická doména, poté šest dalších TMS, druhá velká extracytoplazmatická doména a pět konečných C-koncových TMS. TM4 řídí specificitu pro konkrétní substrát v daném proteinu RND. TM4 proto může být indikátorem specificity RND bez výslovné znalosti zbytku proteinu.[6]
RND pumpy jsou cytoplazmatickou rezidenční částí kompletního tripartitního komplexu (obr. 1), který se šíří přes vnější membránu a vnitřní membránu gramnegativních bakterií, také běžně označovaných jako efluxní systém CBA. Protein RND se asociuje s kanálem vnější membrány a a periplazmatický adaptační protein a spojení všech tří proteinů umožňuje systému exportovat substráty do externího média, což poskytuje obrovskou výhodu pro bakterie.[7]
CusA protein, transportér členů HME-RND, mohl být vykrystalizoval poskytující cenné strukturní informace o pumpách HME-RND. CusA existuje jako homotrimer přičemž každá jednotka se skládá z 12 transmembránový šroubovice (TM1-TM12). Periplazmatická doména se skládá ze dvou šroubovic, TM2 a TM8. Periplazmatická doména je navíc tvořena šesti subdoménami, PN1, PN2, PC1, PC2, DN, DC, které tvoří centrální pórovou a dokovací doménu. Centrální póry jsou tvořeny PN1, PN2, PC1, PC2 a společně stabilizují trimerní organizaci homotrimer.[8]
Odtok kovových iontů (HME-RND)
Rodina HME-RND funguje jako ústředna proteinová pumpa v odtoku kovových iontů napájeném protonovým substrátem antiport. Tato rodina zahrnuje čerpadla, která vyvážejí jednomocné kovy - systém Cus, a čerpadla, která vyvážejí dvojmocné kovy - systém Czc.[5]
Těžký kov odpor rodiny RND byl poprvé objeven v R. metallidurans prostřednictvím CzcA a později CnrA proteinu. Mezi nejlépe charakterizované proteiny RND patří CzcCBA (Cd2+, Zn2+a spol2+), CnrCBA (Ni2+ a spol2+) a NccCBA (Ni2+Co2+ a Cd2+) v Cupriavidus, Czr (CD2+ a Zn2+ odpor) v Pseudomonas aeruginosa, a Czn (Cd2+, Zn2+a Ni2+ odpor) v Helicobacter pylori.[9] Bylo navrženo, že odtok kovových iontů nastává z cytoplazma a periplazma na základě umístění více vazebných míst pro substrát na proteinu RND.[6]
CznCBA
Systém Czn udržuje homeostázu Kadmium, Zinek, a Nikl odpor; je zapojen do Ureáza modulace a žaludeční kolonizace pomocí H. pylori. Proteiny CznC a CznA hrají dominantní roli v homeostáze niklu.[10]
CzcCBA
ČR uděluje odpor Kobalt, Zinek, a Kadmium. Operon CzcCBA zahrnuje: CzcA (protein specifický pro rodinu RND), membrána fúzního proteinu (MFP) CzcB a proteinu vnějšího membránového faktoru (OMF) CzcC, které všechny tvoří aktivní tripartitní komplex, a czcoperon. Vyjádření operon je regulován kovovými ionty.[6]
Léková rezistence (HAE-RND)
Rodina RND hraje důležitou roli při produkci vnitřní a zvýšené rezistence vůči více léčivům u gramnegativních bakterií. Vývoz amfifilní a hydrofobní substráty se řídí rodinou HAE-RND. v E-coli konkrétně bylo identifikováno pět čerpadel RND: AcrAB, AcrAD, AcrEF, MdtEF a MdtAB. Ačkoli není jasné, jak tripartitní komplex funguje v bakteriích, byly navrženy dva mechanismy: Model přemostění adaptéru a Model balení adaptéru.
Zapojení HAE-RND do detoxikace a export organických substrátů umožnil nedávnou charakterizaci konkrétních pump kvůli jejich rostoucímu lékařskému významu. Polovina rezistence vůči antibiotikům prokázaná v in vivo nemocniční kmeny Pseduomonas aeruginosa byl přičítán efluxním proteinům RND. P. aeruginosa obsahují 13 transportních systémů RND, včetně jednoho HME-RND a zbývajících HAE-RND. Mezi nejlépe identifikované patří proteiny Mex: MexB, MexD a MexF, které detoxikují organické látky. Navrhuje se, aby systémy MexB prokázaly specifičnost substrátu pro beta-laktamy; zatímco systém MexD vyjadřuje specificitu pro cefémové sloučeniny.[6]
E-coli - AcrB
v E-coli rezistence vůči více lékům se vyvíjí z různých mechanismů. Zejména jde o schopnost efluxních mechanismů propůjčit širokopásmový odpor. Odtoková čerpadla RND zajišťují vytlačování řady sloučenin. Pět transportérů proteinů dovnitř E-coli buňky, které patří do podrodiny HAE-RND, byly klasifikovány,[11] včetně multidrogového efluxního proteinu AcrB, proteinu vnější membrány TolC a periplazmatického adaptorového proteinu AcrA.[12] Proteiny TolC a AcrA se také používají v tripartitním komplexu v jiných identifikovaných efluxních proteinech RND.[11] Odtokový systém AcrAB-TolC je zodpovědný za odtok antimikrobiálních léčiv, jako je penicilin G., kloxacilin, nafcilin, makrolidy, novobiocin, linezolid, a kyselina fusidová antibiotika. Mezi další substráty patří barviva, detergenty, některé organická rozpouštědla, a steroidní hormony. Způsoby, kterými lipofilní domény substrátu a pumpy RND nejsou zcela definovány.
Krystalizovaný protein AcrB poskytuje pohled na mechanismus působení proteinů HAE-RND a dalších proteinů rodiny RND.[6]
Průtok více drog (Mdt)
Mdt (A) je efluxní pumpa, která propůjčuje odolnost vůči různým lékům. Vyjadřuje se v L. lactis, E-coli a různé další bakterie. Na rozdíl od jiných proteinů RND obsahuje Mdt (A) domnělé vazebné místo pro ATP a dva C-motivy konzervované ve svém pátém TMS. Mdt je účinný při zajišťování odolnosti bakterií tetracyklin, chloramfenikol, linkosamidy a streptomycin. Zdroj energie pro aktivní odtok Mdt (A) není v současné době znám.[13]
Reference
- ^ Tseng TT, Gratwick KS, Kollman J, Park D, Nies DH, Goffeau A, Saier MH (srpen 1999). „Nadrodina permeázy RND: starodávná, všudypřítomná a různorodá rodina, která zahrnuje lidské nemoci a vývojové proteiny“. Journal of Molecular Microbiology and Biotechnology. 1 (1): 107–25. PMID 10941792.
- ^ Coyne S, Rosenfeld N, Lambert T, Courvalin P, Périchon B (říjen 2010). „Nadměrná exprese pumpy rezistence-nodulační-buněčné dělení AdeFGH propůjčuje u Acinetobacter baumannii multirezistenci. Antimikrobiální látky a chemoterapie. 54 (10): 4389–93. doi:10.1128 / AAC.00155-10. PMC 2944555. PMID 20696879.
- ^ Routh, Mathew David, „Struktura, funkce a regulace multidrogových exportních proteinů mezi nadrodinou RND u gramnegativních bakterií“ (2010). Diplomové práce a disertační práce. Papír 11401.http://lib.dr.iastate.edu/etd/11401
- ^ „2.A.6 Nadčeleď Resistance-Nodulation-Cell Division (RND). Databáze klasifikace transportérů.
- ^ A b Moraleda-Muñoz A, Pérez J, Extremera AL, Muñoz-Dorado J (září 2010). „Diferenciální regulace šesti efluxních systémů těžkých kovů v reakci Myxococcus xanthus na měď“. Aplikovaná a environmentální mikrobiologie. 76 (18): 6069–76. doi:10.1128 / AEM.00753-10. PMC 2937488. PMID 20562277.
- ^ A b C d E Nies DH (červen 2003). „Odtokem zprostředkovaná rezistence těžkých kovů u prokaryot“. Recenze mikrobiologie FEMS. 27 (2–3): 313–39. doi:10.1016 / s0168-6445 (03) 00048-2. PMID 12829273.
- ^ Nikaido H (2011). "Struktura a mechanismus víceúčelových efluxních čerpadel typu RND". Pokroky v enzymologii a souvisejících oblastech molekulární biologie. Pokroky v enzymologii a souvisejících oblastech molekulární biologie. 77. s. 1–60. doi:10.1002 / 9780470920541.ch1. ISBN 9780470920541. PMC 3122131. PMID 21692366.
- ^ Long F, Su CC, Zimmermann MT, Boyken SE, Rajashankar KR, Jernigan RL, Yu EW (září 2010). „Krystalové struktury efluxní pumpy CusA naznačují transport kovu zprostředkovaný methioninem“. Příroda. 467 (7314): 484–8. doi:10.1038 / nature09395. PMC 2946090. PMID 20865003.
- ^ Valencia EY, Braz VS, Guzzo C, Marques MV (duben 2013). „Dva proteiny RND podílející se na odtoku těžkých kovů v Caulobacter crescentus patří do samostatných klastrů v proteobakteriích“. Mikrobiologie BMC. 13: 79. doi:10.1186/1471-2180-13-79. PMC 3637150. PMID 23578014.
- ^ Stähler FN, Odenbreit S, Haas R, Wilrich J, Van Vliet AH, Kusters JG, Kist M, Bereswill S (červenec 2006). „Nová kovová efluxní pumpa Helicobacter pylori CznABC je vyžadována pro odolnost vůči kadmiu, zinku a niklu, modulaci ureázy a kolonizaci žaludku“. Infekce a imunita. 74 (7): 3845–52. doi:10.1128 / IAI.02025-05. PMC 1489693. PMID 16790756.
- ^ A b Anes J, McCusker MP, Fanning S, Martins M (2015). „Vstupy a výstupy efluxních čerpadel RND v Escherichia coli“. Hranice v mikrobiologii. 6: 587. doi:10.3389 / fmicb.2015.00587. PMC 4462101. PMID 26113845.
- ^ Nikaido H, Takatsuka Y (květen 2009). "Mechanismy víceúčelových vývěv RND RND". Biochimica et Biophysica Acta (BBA) - bílkoviny a proteomika. 1794 (5): 769–81. doi:10.1016 / j.bbapap.2008.10.004. PMC 2696896. PMID 19026770.
- ^ Perreten V, Schwarz FV, Teuber M, Levy SB (duben 2001). „Mdt (A), nový efluxní protein propůjčující mnohonásobnou rezistenci na antibiotika u Lactococcus lactis a Escherichia coli“. Antimikrobiální látky a chemoterapie. 45 (4): 1109–14. doi:10.1128 / AAC.45.4.1109-1114.2001. PMC 90432. PMID 11257023.
