Pyramidová karbokace - Pyramidal carbocation
tento článek může být pro většinu čtenářů příliš technická na to, aby tomu rozuměli. Prosím pomozte to vylepšit na aby to bylo srozumitelné pro neodborníky, aniž by byly odstraněny technické podrobnosti. (Února 2017) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |

A pyramidová karbokace je typ karbokace se specifickou konfigurací. Tento ion existuje jako třetí třída, kromě klasických a neklasické ionty. V těchto iontech se jeden atom uhlíku vznáší nad čtyřmi nebo pěti stranami polygon, ve skutečnosti tvořící a pyramida. Čtyřstranný pyramidový iont bude mít náboj 1+ a pětistranný pyramid bude mít 2+. Na obrázcích (vpravo nahoře), černá skvrna na svislé čáře představuje vznášející se atom uhlíku.
Zdánlivé koordinační číslo pět, nebo dokonce šest, spojené s atomem uhlíku v horní části pyramidy, je ve srovnání s obvyklým maximem čtyř vzácností.
Dějiny
Studium těchto kationů bylo v té době zapáleno úžasnými výsledky výpočetní chemie. Při výpočtu optimální geometrie monokationtu, který vzniká extrakcí chloridu z 3-chlortricyklo [2.1.0.02,5] pentan, předpokládalo se, že se tyto tři mosty budou orientovat v prostoru s úhly zhruba 120 °. Výpočty však ukázaly, že čtyřstranná pyramida je nejstabilnější konfigurací. V horní části této pyramidy se nachází atom uhlíku, stále připojený k vodíku. Ukázalo se, že původní očekávaná struktura ani zdaleka nedosahovala energetického minima: představovala maximum.[1]
- Obrázek 1: Několik možností pro (CH)5 kation.

- 1a výchozí situace ve výpočtech: chloridový iont právě odešel.
- 1b očekávaná struktura. Náboj byl delokalizován na tři atomy uhlíku
- 1c reprezentace pyramidového iontu.
V závislosti na použité metodě, iontu 1c na obrázku 1 je absolutní nebo jen relativní minimum.
Teoretické základy
Kompletní teoretická diskuse využije všechny orbitaly všech přispívajících atomů. První aproximace může použít a LCAO z molekulární orbitaly v polygon tvořící základnu pyramidy a orbitalů na apikální atom, jako atom uhlíku v horní části pyramidy. Tato aproximace poskytne vhled do vnitřní stability struktur.
Apikální atom uhlíku
The apikální atom uhlíku je připojen pouze k jednomu dalšímu substituent, takže sp-hybridizace lze očekávat. Substituent bude orientován nahoru. Směrem k základnímu polygonu jsou k dispozici tři orbitaly:
- Druhý sp-orbitál. Tento orbitál má relativně nízkou energii díky příspěvku s-orbitálu. S ohledem na uzlové roviny ve zbývajících p-orbitálech lze symetrii tohoto orbitálu zapsat jako SXSy,[2] symetrické vzhledem k oběma rovinám. Orbitál má poměrně nízkou energii, pokud jde o Hückel metoda jeho hodnotu nelze snadno odhadnout, i když bude nižší než α, protože orbitální bude mít značný s-charakter.
- Dva p-orbitaly. Tyto orbitaly mají vyšší energetický obsah než sp-orbitál. Z hlediska Huckelovy metody bude energie α. Z hlediska symetrie jsou tyto orbitaly ortogonální, popsáno jako AXSy a SXAy[2]
Základna pyramidy
| Obrázek 2: Orbitály apikálního atomu uhlíku (nahoře) a MO báze (dole)[2] |
 |
| Obrázek 3: Interakce mezi apikální a bazální orbitaly. „A“ nahoře je apikální uhlík, „P“ označuje pyramidovou strukturu, „B“ označuje bazální část pyramidy. |
 |
Aproximací základny pyramidy je uzavřený kruh atomů uhlíku, všechny sp2 hybridizovaný. Přesné výsledky závisí na velikosti prstenu; celkové závěry lze formulovat jako:
- Nejnižší molekulární okružní dráha, sledovaná z vrcholu pyramidy, nemá žádné uzlové roviny. Symetrie bude SXSy.[2] U Hückelovy metody je jeho energie (α - 2β)
- Další úroveň energie je obsazena dvěma zdegenerovanými orbitaly. Symetricky jsou psány jako SXAy a AXSy.[2] Energie závisí na velikosti prstenu:
| velikost prstenu | úroveň energie |
|---|---|
| 3 | (α + β) |
| 4 | α |
| 5 | (α - 0,618β) |
| 6 | (α - β) |
- V závislosti na velikosti základny budou existovat další MO, ale pro tuto diskusi jsou irelevantní.
Interakce mezi vrcholem a základnou
K získání vazebných interakcí mezi atomy nebo částmi molekul by měly být splněny dvě podmínky:
- Orbitaly, které se mají kombinovat, by měly mít stejnou symetrii.
- Menší energetický rozdíl mezi kombinujícími orbitaly bude mít větší stabilizační účinek.
Orbitály na apikálním uhlíku a základním polygonu jsou schopné kombinovat s ohledem na jejich symetrie. Výsledkem bude stabilnější konfigurace pyramid. Na obrázku 2 jsou znázorněny aspekty symetrie.
- Apikální sp orbitál se kombinuje s nejnižší MO základního prstence s nízkou vazbou a vysokou anti-vazbou.
- Dva apikální p orbitaly se kombinují s druhou nejnižší úrovní energie v základním prstenci. Výsledkem jsou dvě vazebné a dvě protilehlé orbitaly. Obrázek 3 je grafické znázornění výsledků.
Plnění atomových a molekulárních orbitalů do pyramidových struktur různé velikosti základny vede k další tabulce. Jsou účtovány pouze spojovací orbitaly.
| n = 3 (trigonální) | n = 4 (náměstí) | n = 5 (pětiúhelníkový) | n = 6 (šestihranný) | |||||
|---|---|---|---|---|---|---|---|---|
| orbitaly | nabít | orbitaly | nabít | orbitaly | nabít | orbitaly | nabít | |
| 1 s orbitaly na uhlíku | 4 | −8 | 5 | −10 | 6 | −12 | 7 | −14 |
| σ vazba mezi vodíkem a vrcholovým uhlíkem | 1 | −2 | 1 | −2 | 1 | −2 | 1 | −2 |
| σ vazba mezi vodíkem a bazickým uhlíkem | 3 | –6 | 4 | –8 | 5 | 10 | 6 | –12 |
| σ vazba mezi základními uhlíky | 3 | –6 | 4 | –8 | 5 | –10 | 6 | –12 |
| vazba MO mezi apikální a nejnižší základní oběžnou dráhou | 1 | –2 | 1 | –2 | 1 | –2 | 1 | –2 |
| vazba MO mezi apikální a druhou nejnižší základní orbitaly | 2 | –4 | 2 | –4 | 2 | –4 | 2 | –4 |
| celkový počet elektronů | –28 | –34 | –40 | –46 | ||||
| celkový jaderný náboj: (n + 1) * (C + H) = (n + 1) * (6 + 1) | +28 | +35 | +42 | +49 | ||||
| Čistý náboj struktury | 0 | 1+ | 2+ | 3+ | ||||
V případě trojstranné pyramidy zjevně žádné iontové výsledky; vznikne známý neutrální druh: čtyřstěn. Pro tuto molekulu je tento způsob popisu alternativou kvantově mechanický popis.
Ostatní pyramidové struktury budou účtovány ve vztahu k jejich základní velikosti.
Příklady
Monocation
- Obrázek 4: Řada derivátů tricla [3,1,0,02,4] pentan (TCP) vedoucí ke stejnému pyramidovému kationtu. Atom uhlíku nesoucí opouštějící skupina se stane základním, zatímco uhlík na proti pozice se stává apikální.
Skupina „R“ je buď 1H nebo 2H (D ):

4a:
3-hydroxy-1,4-dimethyl-TCP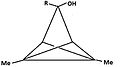
4b:
3-hydroxy-1,5-dimethyl-TCP
4c:
3-methoxy-3,5-dimethyl-TCP
4d:
výsledná karbokace
V roce 1972 Masamune popisuje výsledky rozpuštění řady předchůdců 4d (obrázek 4) v - 70 ° C. v superkyselina (směs SO2ClF a FSO3H). Na základě obou 13C stejně jako 1H-NMR spektrum je zřejmé: v každém případě je vytvořen stejný prostředník. Také, když je zničeno super kyselé médium, buď methanolu nebo kyselina benzoová, vzniká stejný produkt. (vidět: Reakce... níže).[3]
| skupina / atom ( !) | 13C | 1H | |
|---|---|---|---|
| 1 | 93.56 | - |  |
| 2 / 4 | 73.00 | 4.62 | |
| 3 (pokud R = 1H) | 60.97 | 4.68 | |
| 5 | -23.04 | - | |
| Methyl v 1 | 7.45 | 2.15 | |
| Methyl v 5 | -1.03 | 1.84 | |
| ( !) V této tabulce se atomy uhlíku nazývají, v 1H-NMR je zobrazen signál vodíku nesený zvanými uhlíky | |||
- Přiřazení ve vodíkovém spektru je částečně na intenzitě (vodíky na základním kruhu), částečně na společných zkušenostech, že vodík na vnější straně kruhového konjugovaného systému má signály při vyšších ppm ve srovnání s TMS, zatímco ty umístěné nad kruhem budou mít nižší, i negativní, signály ve vztahu k TMS.
- Přiřazení v 13C-NMR se řídí stejnými úvahami jako pro 1H. Ačkoli je uhlíková NMR intenzita špatným vodítkem k počtu atomů, v základním kruhu jsou nesubstituované uhlíky dostatečně podobné, aby používaly intenzitu jako indikaci jejich počtu. Silným nástrojem je také rozmanitost uhlíkového signálu v důsledku vazby s vodíkem vázaným na uhlík.
- Masamune sám neříká nic o povaze meziproduktu iontu.[5] Nicméně na základě pravidel formulovaných Olahem[6] je schopen vyloučit lokalizované kationty (jako 1-butyl) nebo delokalizované (jako allyl). U těchto iontových signálů se očekává kolem 200 ppm.
Reakce s methanolem a kyselinou benzoovou
- Obrázek 5: Produkty reakce dimethyl pyramidového kationtu s methanolem a kyselinou benzoovou.
Skupina „R“ je buď1H nebo 2H (D ):
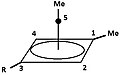
5a = 4 dny
Pyramidový kation
5b
Produkt reakce s kyselinou benzoovou
v diploárním aprotickém rozpouštědle
5c
reakční produkt s methanolem
v methanolu
Jak je popsáno výše, nezávisle na jeho syntetické cestě pyramidový iont 5a reaguje s methanolem nebo benzoátem za vzniku produktů řízených reagentem a reakčním médiem, jak je zřejmé ze vzorců substituce. V roce 1972 Masamune [3][4] není schopen vysvětlit odlišné chování meziproduktu. Pokud jde o teorii HSAB, mohlo by být podáno vysvětlení.
V roce 1975 Masamune vypočítal[7] v nesubstituovaném iontu většina náboje na atomech vodíku. Výměna vodíku za uhlík, centrální atom methylové skupiny, je více elektronegativní substituent (2,5 proti 2,1 na Paulingově stupnici) koncentruje náboj na kosterním uhlíku. Tato koncentrace náboje má několik účinků:
- Reakce s benzoátem se řídí interakcemi π - π. Degenerace v základním MO systému bude ztracena. Protože je apikální strana nepřístupná, benzoát se přiblíží ze spodní strany pyramidy. Interakce mezi dvěma systémy π, narušenými v jednom bodě, vynutí specifickou orientaci. Orientace, ve které interakce mezi kladným nábojem generovaným methylovou skupinou na pyramidě a nábojem sousedícím s karboxylovou skupinou povede systém k reakci karboxylové skupiny s uhlíkem 2 nebo 4 pyramidové báze. Když probíhá reakce s benzoátem na uhlíku, vytvoří se 2 můstky mezi apikálním uhlíkem a atomy 1 a 3. Také se vytvoří vazba mezi proti-uhlík 4 a vrchol. Reakce na uhlíku 4 bude mít stejný účinek, i když výsledná molekula má zrcadlový vztah k molekule, která je výsledkem reakce v poloze 2.
- Reakce s methanolem je řízena nábojem. V základním systému je identifikovatelné centrum kladného náboje přítomné na uhlíku nesoucím methylovou skupinu. Metanol s jeho tvrdá základna v kyslíku, bude reagovat ve středu pozitivity. Methoxyskupina se objevuje na uhlíku 1 a nutí můstky tvořit mezi uhlíkem 2 a 4 k vrcholu, stejně jako mezi nyní proti-uhlík 3.
Bishomomonokarbocation
V chemii předpona „homo-“ označuje a homolog, podobně sloučenina obsahující jeden, nebo jako v tomto případě dva, navíc CH2-skupiny. Společným aspektem iontů bishomo je vlastnictví a 1,4-cyklohexadien zazvonit místo a cyklobutadien jeden.

Mosty mezi homoatomy bishomo-karbokation
Letadla obsahující sp2 hybrizované atomy a atomy s nimi spojené
Odpojuje bishomo-karbokation
Stabilita tohoto iontu se na první pohled může zdát divná, protože zvětšení prstence obecně sníží přesah vazeb mezi orbitaly ve středu pyramidové struktury. Tady sp2 hybridizace a následně rovinnost atomů a atomů přímo vázaných na sp2 středy, tlačí vrcholy p-orbitalů bazálních uhlíků k sobě navzájem, čímž vytváří pevnou základnu pro usazení vrcholového uhlíku. Zpevnění konfigurace můstkem mezi homoatomy, převedením základny pyramidy, na a norbornadiene, vytváří ještě stabilnější strukturu.
Dication
Podle výsledků uvedených v tabulce 1 bude pětistranný pyramidový karbokation dvojmocný. To je potvrzeno teoreticky[8] a praktická práce Hogeveen.[9][10] Na rozdíl od monokationu, který je popsán s několika vzory substituce, je dikace studována hlavně jeho hexamethyl derivátem. Syntéza začíná v hexamethyl Dewar benzen (sloučenina Já v tabulce 4) reakce s Cl2 na 5,6-dichlor-l, 2,3,4,5,6-hexamethylbicyklo [2.1.1] hex-2-en (sloučenina II v tabulce 4). Rozpuštění této sloučeniny v kyselina fluorsulfonová vede k dikaci (struktura III v tabulce 4).
 |  |  |
| Já: Mě6- Dewarův benzen | II: Produkt reakce mě6 Dewar benzen s chlorem | III: pyramidové označení |
Přítomnost pyramidového iontu v roztoku kyseliny flurosulfonové dokládá 1Ruka 13C-NMR spektrum (tabulka 5).
| Intenzita | 1H | 13CSingulet | 13CKvartet |
|---|---|---|---|
| 1 | 1,96 (s) | 22,5 | - 2.0 |
| 5 | 2,65 (s) | 126,3 | 10,6 |
Přiřazení signálů je založeno na jejich intenzitách a multiplicitách. Přiřazení pyramidové struktury je založeno na pozorované jednoduchosti spektra: pět stejných C-CH3 skupiny v kombinaci s jedním vynikajícím C-CH3 skupina. Jediným způsobem, jak z těchto dat postavit molekulární entitu, je pětistranná pyramida. Rychlá rovnováha mezi zdegenerovanými klasickými nebo neklasickými karbokationty se zahodí, protože poloha signálů neodpovídá očekávaným hodnotám pro tyto druhy struktur.[8]
Krystalová struktura [C.6(CH3)6]2+ (SbF6−)2 • HSO3F bylo získáno v roce 2017. Ačkoli je apikální atom uhlíku hexakoordinovaný, pravidlo čtyřmocnosti uhlíku je stále splněno. Zatímco C-CH3 délka vazby 1,479 (3) Å je typická pro jednoduchou vazbu C-C, dalších pět velmi dlouhých vzdáleností C-C 1,694 (2) - 1,715 (3) Å označuje pořadí vazby <1.[11]
Reakce dikace
| Obrázek 6: Reakce pyramidové karbodikace |
|---|
 |
|
Reakce dikace se rozpadají do tří skupin:[9][10]
- Tepelné reakce Hexametyl substituovaný dication je stabilní struktura až do 40 ° C (104 ° F). Nad touto teplotou dochází k reakci: a hydrid -ion je vzat, následovaný nevratným přesmykem na a Meisenheimerův komplex který je stabilní v médiu s kyselinou fluorosulfonovou (viz: Obrázek 6, horní reakce).
- Nabité nukleofily (hydrid, methoxid, hydroxid) reagují reverzibilně, což vede k, nezávisle na použitém nukleofilu, identickému 2,4-substituovanému tricyklo [3.1.0.03,6] hexan derivát, například: s methoxidem: 2,4-dimethoxy-tricyklo [3.1.0.03,6] vytvoří se hexan (viz: Obrázek 6, střední reakční cesta).
- Nenabité nukleofily (aminy jako triethylamin ) působí jako báze, reverzibilně extrahuje dva vodíky z iontu a ve skutečnosti produkuje dimethylenový derivát benzvalen (viz: Obrázek 6, spodní reakce).
Další substituční vzorce na dikacích
Produkt reakce dvojky s triethylamin nabízí cestu k dalším substitučním vzorům než hexamethyl.[12] Jedna nebo obě dvojné vazby jsou oxidovány na keton. Keton pak reaguje s organokovová sloučenina za vzniku alkylovaného hydroxidu. Takto vytvořené sloučeniny obsahují jednu nebo dvě další alkylové skupiny, v závislosti na počtu oxidovaných dvojných vazeb. Když alkoholy jsou rozpuštěny v kyselina fluorsulfonová, opět dávají vzniknout novým pyramidovým dikacím. Obě nemetylové skupiny zaujímají bazální polohy. Každá další pozice na pyramidovém skeletu stále nese methylovou skupinu. Tabulka 6 shrnuje tato zjištění.
 |  |  |  |  |
| Já: Reakční produkt s Et3N | II: Monoketon | III: alkylovaný monoalkohol | IV: Pyramidový iont, když se poprvé rozpustil v FSO3H | PROTI: Pyramidový kation se rozpustil podruhé ve FSO3H |
 |  |  |  | |
| II: Diketon | III: alkylovaný diol | IV: Pyramidový iont, když se poprvé rozpustil v FSO3H | PROTI: Pyramidový kation se rozpustil podruhé ve FSO3H |
Až do tohoto bodu má substituční vzorec dvojmocného pyramidového iontu pro jeho chování malý význam. Jasný rozdíl nastává, když je tepelná stabilita, pokud jsou ionty typu PROTI (Tabulka 6) je studována: při -40 ° C (-40 ° F) apikální ethyl substituovaný iont je stabilní po dobu 48 hodin, zatímco po apikální není žádná stopa iso-propylový ion je již detekovatelný.
Tervalentní a vyšší ionty
V době průzkumu literatury (konec roku 1978) nebyly žádné zprávy o tervalentních nebo vyšších pyramidových kationtech.
Poznámky a odkazy
- ^ Stohrer, W.D .; Hoffmann, R. (1972). „Bond-stretch izomerismus a polytopální přesmyky v (CH) 5+, (CH) 5- a (CH) 4CO“. J. Am. Chem. Soc. 94 (5): 1661–1668. doi:10.1021 / ja00760a039.
- ^ A b C d E S označující orbitál je symetrický vzhledem k rovině označené dolním indexem. An A popisuje antisymetrii vzhledem k rovině označené indexem.
- ^ A b Masamune, S .; Sakai, M .; Ona, H. (1972). „Povaha (CH)5+ druh. I. Solvolýza 1,5-dimethyltricyklo [2.1.0.02,5] pent-3-ylbenzoát ". J. Am. Chem. Soc. 94 (25): 8955–8956. doi:10.1021 / ja00780a078.
- ^ A b S. Masamune, S .; Sakai, M .; Ona, H .; Jones, A.J. (1972). „Povaha (CH)5+ druh. II. Přímé pozorování uhlíkového iontu derivátů 3-hydroxyhomotetrahedranu “. J. Am. Chem. Soc. 94 (25): 8956. doi:10.1021 / ja00780a079.
- ^ Ačkoli Masamune představil své praktické výsledky později ve stejném roce jako Stöhrer a Hoffmann jejich teoretické výsledky, je nepravděpodobné, že by Masamune byl schopen upravit svůj příspěvek v okamžiku, kdy byly objasněny důsledky teoretické práce.
- ^ Olah, GA; Donovan, D.J .; Prakash, G. (1978). "Α, 1-dimethylcyklopropylkarbinyl kation". Čtyřstěn dopisy. 19 (48): 4779–4782. doi:10.1016 / s0040-4039 (01) 85729-4.
- ^ Masamune, S. (1975). „Některé aspekty napjatých systémů. [4] Annulen a jeho CH + adukt“. Čistá a aplikovaná chemie. 44 (4): 861–884. doi:10.1351 / pac197544040861.
- ^ A b Hogeveen, H .; Kwant, P. W .; Postma, J .; van Duynen, P. Th. (1974). "Elektronická spektra pyramidových směrů, (CCH3)62+ a (CCH)62+". Čtyřstěn dopisy. 15 (49–50): 4351–4354. doi:10.1016 / S0040-4039 (01) 92161-6.
- ^ A b Hogeveen, H .; Kwant, P. W. (1974). „Chemie a spektroskopie v silně kyselých roztocích. XL. (CCH3)62+, neobvyklý údaj “. Journal of the American Chemical Society. 96 (7): 2208–2214. doi:10.1021 / ja00814a034.
- ^ A b Hogeveen, H .; Kwant, P. W. (1973). "Přímé pozorování pozoruhodně stabilní dikace neobvyklé struktury: (CCH3)62⊕". Čtyřstěn dopisy. 14 (19): 1665–1670. doi:10.1016 / S0040-4039 (01) 96023-X.
- ^ Malischewski, Moritz; Seppelt, K. (2016-11-25). "Stanovení krystalové struktury pentagonálně-pyramidového hexamethylbenzenu Dication C6 (CH3) 6 2+". Angewandte Chemie International Edition. 56 (1): 368–370. doi:10,1002 / anie.201608795. ISSN 1433-7851. PMID 27885766.
- ^ G. Giordano, G .; Heldeweg, R .; Hogeveen, H. (1977). "Pyramidové dikace. Zavedení bazálních a apikálních substituentů". J. Am. Chem. Soc. 99 (15): 5181–5183. doi:10.1021 / ja00457a050.










