Tetramethylsilan - Tetramethylsilane - Wikipedia
 | |||
| |||
| Jména | |||
|---|---|---|---|
| Preferovaný název IUPAC Tetramethylsilan | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| Zkratky | TMS | ||
| 1696908 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Informační karta ECHA | 100.000.818 | ||
| Číslo ES |
| ||
| Pletivo | Tetramethylsilan | ||
PubChem CID | |||
| Číslo RTECS |
| ||
| UNII | |||
| UN číslo | 2749 | ||
Řídicí panel CompTox (EPA) | |||
| |||
| |||
| Vlastnosti | |||
| C4H12Si | |||
| Molární hmotnost | 88.225 g · mol−1 | ||
| Vzhled | Bezbarvá kapalina | ||
| Hustota | 0,648 g cm−3 | ||
| Bod tání | −99 ° C (−146 ° F; 174 K) | ||
| Bod varu | 26 až 28 ° C (79 až 82 ° F; 299 až 301 K) | ||
| Rozpustnost | organická rozpouštědla | ||
| Struktura | |||
| Čtyřboká na uhlíku a křemíku | |||
| 0 D. | |||
| Nebezpečí | |||
Klasifikace EU (DSD) (zastaralý) | |||
| R-věty (zastaralý) | R12 | ||
| S-věty (zastaralý) | S16, S3 / 7, S33, S45 | ||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | −28 - −27 ° C | ||
| Související sloučeniny | |||
Související silany | Silane Tetrabromid křemičitý | ||
Související sloučeniny | Neopentan | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
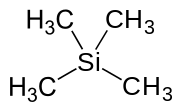
Tetramethylsilan (ve zkratce TMS) je organokřemičitá sloučenina s vzorec Si (CH3)4. Je to nejjednodušší tetraorganosilan. Jako všichni silany, rámec TMS je čtyřboký. TMS je stavebním kamenem v organokovová chemie ale také nachází uplatnění v různých specializovaných aplikacích.
Syntéza a reakce
TMS je vedlejším produktem při výrobě methylchlorsilanů, SiClX(CH3)4−Xprostřednictvím přímý proces reakce methylchlorid s křemíkem. Užitečnější produkty této reakce jsou produkty pro X = 1 (trimethylsilylchlorid ), 2 (dimethyldichlorsilan ) a 3 (methyltrichlorsilan ).[1]
TMS prochází deprotonací po ošetření butyllithium dát (H3C)3SiCH2Li. Ten druhý, trimethylsilylmethyl lithium, je relativně běžný alkylační činidlo.
v chemická depozice par, TMS je předchůdcem oxid křemičitý nebo karbid křemíku, v závislosti na podmínkách ukládání.
Využití v NMR spektroskopii
Tetramethylsilan je akceptovaný interní standard pro kalibraci chemický posun pro 1H, 13C a 29Si NMR spektroskopie v organických rozpouštědlech (kde je TMS rozpustný). Ve vodě, kde není rozpustný, sodné soli DSS, 2,2-dimethyl-2-silapentan-5-sulfonát, místo toho se používají. Díky své vysoké těkavosti lze TMS snadno odpařit, což je vhodné pro izolaci vzorků analyzovaných NMR spektroskopií.[2]
Protože všech dvanáct atomů vodíku v molekule tetramethylsilanu je ekvivalentní 1H NMR spektrum sestává z singletu.[3]Chemický posun tohoto singletu je přiřazen jako δ 0 a všechny ostatní chemické posuny jsou určeny vzhledem k ní. Většina sloučenin studovala 1H NMR spektroskopie absorbuje downfield signálu TMS, takže mezi standardem a vzorkem obvykle není interference. Podobně jsou všechny čtyři atomy uhlíku v molekule tetramethylsilanu ekvivalentní.[3]V plně odděleném 13Podle C NMR spektra se uhlík v tetramethylsilanu jeví jako singlet, což umožňuje snadnou identifikaci. Chemický posun tohoto singletu je také nastaven na δ 0 v 13C spektrum a všechny ostatní chemické posuny jsou určeny vzhledem k němu.
Komerční NMR rozpouštědla se často dodávají bez TMS. 1H NMR spektra mohou být kalibrována proti zbytkovému protio-rozpouštědlu (např. Zbývajících 0,1% nebo tak nedeuterovaného chloroformu v komerčních CDCI3 ). Vzhledem k tomu, že deuterium není v 1H NMR lze jasně sledovat zbytkové signály protio-rozpouštědla. Pro 13C NMR práce, spektra jsou obvykle kalibrována proti deuterovanému píku rozpouštědla. Například, deuterovaný chloroform ukazuje trojici stejné výšky v δ 77.0.[4]Triplet je vysvětlen aplikací 2nI + 1 pravidlo; pro případ deuteria, Já = 1. Tabulky a grafy chemických posunů pro různé typy NMR spektroskopie jsou často poskytovány prodejci NMR rozpouštědel. Rovněž byla provedena práce na přípravě komplexních tabulek chemických posunů rozpouštědel a nečistot.[5][6]
Reference
- ^ Elschenbroich, C. (2006). Organometallics. Weinheim: Wiley-VCH. ISBN 978-3-527-29390-2.
- ^ Mohrig, Jerry R .; Noring Hammond, Christina; Schatz, Paul F. (leden 2006). Techniky v organické chemii (Knihy Google výňatek). 273–274. ISBN 978-0-7167-6935-4.
- ^ A b Teorie NMR - chemický posun
- ^ Teorie NMR - rozpouštědla pro NMR spektroskopii
- ^ Gottlieb, Hugo E .; Kotlyar, Vadim; Nudelman, Abraham (1997). "NMR chemické posuny běžných laboratorních rozpouštědel jako stopové nečistoty". The Journal of Organic Chemistry. 62 (21): 7512–7515. doi:10.1021 / jo971176v. PMID 11671879.
- ^ Fulmer, Gregory R .; Miller, Alexander J. M .; Sherden, Nathaniel H .; Gottlieb, Hugo E .; Nudelman, Abraham; Stoltz, Brian M .; Bercaw, John E .; Goldberg, Karen I. (2010). „NMR chemické posuny stopových nečistot: běžná laboratorní rozpouštědla, organická rozpouštědla a plyny v deuterovaných rozpouštědlech relevantní pro organokovové chemikálie“ (PDF). Organometallics. 29 (9): 2176–2179. doi:10.1021 / om100106e.



