Nesynaptická plasticita - Nonsynaptic plasticity

Nesynaptická plasticita je forma neuroplasticity který zahrnuje úpravu iontový kanál funkce v axon, dendrity a tělo buňky, které má za následek specifické změny v integraci excitační postsynaptické potenciály (EPSP) a inhibiční postsynaptické potenciály (IPSP). Nesynaptická plasticita je modifikací vnitřní vzrušivost neuronu. Interaguje s synaptická plasticita, ale je považována za samostatnou entitu od synaptické plasticity. Vnitřní modifikace elektrických vlastností neurony hraje roli v mnoha aspektech plasticity od homeostatická plasticita na učení se a Paměť sám. Nesynaptická plasticita ovlivňuje synaptická integrace, podprahové propagace, generace hrotu a další základní mechanismy neuronů na buněčné úrovni. Tyto jednotlivé neuronální změny mohou mít za následek změny v vyšší mozek funkce, zejména učení a paměť. Jako rozvíjející se pole v neurovědy, velká část znalostí o nesynaptické plasticitě je nejistá a stále vyžaduje další vyšetřování, aby bylo možné lépe definovat její roli ve funkci a chování mozku.
Vs. synaptická plasticita
Neuroplasticita je schopnost určité části nebo oblasti neuronu měnit sílu v průběhu času. Existují dvě převážně uznávané kategorie plasticity: synaptická a nesynaptická. Synaptická plasticita se zabývá přímo silou spojení mezi dvěma neurony, včetně množství neurotransmiter propuštěn z presynaptický neuron a odpověď generovaná v souboru postsynaptický neuron. Nesynaptická plasticita zahrnuje modifikaci neuronové excitability v axon, dendrity, a soma individuální neuron, vzdálený od synapse.
Synaptická plasticita
Synaptická plasticita je schopnost synapse mezi dvěma neurony měnit sílu v průběhu času. Synaptická plasticita je způsobena změnami v používání synaptické dráhy, konkrétně frekvencí synaptických potenciálů a receptory používanými k přenosu chemických signálů. Synaptická plasticita hraje velkou roli při učení a paměti v mozku. Synaptická plasticita může nastat prostřednictvím vnitřních mechanismů, ve kterých dochází ke změnám v síle synapse kvůli jeho vlastní aktivitě, nebo prostřednictvím vnějších mechanismů, ve kterých ke změnám v síle synapse dochází prostřednictvím jiných nervových drah. Krátkodobá inhibiční synaptická plasticita se často vyskytuje z důvodu omezené neurotransmiter zásobování synapsí a dlouhodobá inhibice může nastat snížením exprese receptoru v postsynaptická buňka. Krátkodobá komplementární synaptická plasticita se často vyskytuje kvůli zbytkovému nebo zvýšenému toku iontů v presynaptickém nebo postsynaptickém terminálu, zatímco dlouhodobá synaptická plasticita může nastat zvýšenou produkcí AMPA a NMDA glutamátové receptory, mimo jiné v postsynaptické buňce.[1]
Nesynaptická plasticita
Ve srovnání je nesynaptická plasticita méně známá a poněkud nová a pokračující oblast výzkumu v neurovědě. Projevuje se změnami charakteristik nesynaptických struktur, jako je soma (biologie), axon nebo dendrity. Nesynaptická plasticita může mít krátkodobé nebo dlouhodobé účinky. Jedním ze způsobů, jak tyto změny nastanou, je modifikace napěťově řízené kanály v dendritech a axonu, což mění interpretaci excitačních nebo inhibičních potenciálů šířených do buňky. Například lze pozorovat axonální nesynaptickou plasticitu, když akční potenciál nedosáhne presynaptického terminálu kvůli nízkému vedení nebo nahromadění iontů. [2]

Synergické účinky
Obecné excitační účinky
Bylo prokázáno, že nesynaptická a synaptická plasticita fungují souběžně různými způsoby k vyvolání stimulačních účinků na neuron. To zahrnuje generování špiček, produkt nesynaptické regulace draslíku a dalších presynaptických iontových kanálů, které zvyšují odezvu excitační postsynaptický potenciál uvolňováním neurotransmiterů a zvyšováním akčního potenciálu.[3] Nesynaptická dendritická plasticita také zvyšuje účinky synaptické plasticity rozšířením akčního potenciálu. Jak bude dále diskutováno, odvozeno z mozku neurotrofický faktor (BNDF) je produkován neurony ke koordinaci nesynaptické a synaptické plasticity.[4] Nesynaptické změny v somálním těle, axonu nebo dendritech neuronu jsou neoddělitelně spojeny se synaptickou silou.
Integrace do paměti a učení
Ačkoli se o úloze synaptické plasticity v paměti a učení ví mnohem víc, je synaptická i nesynaptická plasticita nezbytná Paměť a učení se v mozku. Existuje mnoho důkazů, že oba tyto mechanismy fungují k synergickému dosažení pozorovaných účinků. Klíčovým příkladem je tvorba paměti v synapse, ve které modifikace presynaptických mechanismů uvolňování a postsynaptických receptorů ovlivňuje buď dlouhodobou potenciaci, nebo depresi. Nepřetržitý somál depolarizace, na druhé straně, byla navržena jako metoda pro naučené chování a paměť nesynaptickou plasticitou. Nesynaptická plasticita také zvyšuje účinnost tvorby synaptické paměti regulací napěťově řízené iontové kanály. Nesynaptická plasticita je mechanismus odpovědný za modifikace těchto kanálů v axonu, což vede ke změně síly neuronového akčního potenciálu, který vždy ovlivňuje sílu synaptických mechanismů, a tím hloubku a délku kódování paměti. [5][6]
Regulace synaptické plasticity
Nesynaptická plasticita má také schopnost regulovat účinky synaptické plasticity prostřednictvím negativní zpětná vazba mechanismy. Změna počtu a vlastností iontových kanálů v axonu nebo dendritech má schopnost snižovat účinky hyperstimulované synapse.[5][6] V případě extrémní nadměrné excitace těchto iontových kanálů dojde k zpětnému toku iontů do buňky, což vede k excitotoxicita a buněčná smrt apoptóza nebo nekróza.[7]
Vnitřní mechanismy
Nesynaptické neuronální oblasti, jako je axon, mají také inherentní vlastnosti, které ovlivňují synapse. Tyto základní mechanismy zahrnují zpoždění depolarizace, které akční potenciál prochází při cestování dolů po axonu. Tato vnitřní kvalita zpomaluje šíření akčních potenciálů a je způsobena pohybem depolarizačního proudu dolů po cytoplazmě a přerušovaným umístěním sodíkových kanálů na Uzly Ranvier. Tyto mechanismy vždy existují, ale mohou se měnit v závislosti na podmínkách buněčného soma, axonu a dendritů v té době. Proto může být latence nebo zpoždění v šíření akčních potenciálů nebo EPSP proměnlivé. Každý excitační postsynaptický potenciál který se šíří do postsynaptické buňky, se nejprve přenáší akčním potenciálem dolů axonem v presynaptické buňce, a tak nesynaptická plasticita inherentně ovlivňuje synaptickou plasticitu.[1]
Typy
Vnitřní excitabilita neuronu
Vzrušení neuronu v kterémkoli bodě závisí na vnitřních a vnějších podmínkách buňky v době stimulace. Protože neuron obvykle přijímá více příchozích signálů najednou, propagace akčního potenciálu závisí na integraci všech příchozích EPSP a IPSP přijíždějící na Axon Hillock. Pokud je součet všech excitačních a inhibičních signálů depolarizovat buněčná membrána na prahové napětí, je aktivován akční potenciál. Změna vnitřní dráždivosti neuronu změní funkci tohoto neuronu.
Spike generace
Nesynaptická plasticita má excitační účinek na generování hroty. Zvýšení tvorby špiček souviselo se snížením práh špičky,[3] odpověď z nesynaptické plasticity. Tato odpověď může být výsledkem modulace určité presynaptické K.+ (iont draslíku) proudy (I.A, JáK, Caa jáKs), které zvyšují excitabilitu senzorických neuronů, rozšiřují akční potenciál a zlepšují neurotransmiter uvolnění. Tyto modulace K.+ vodivosti slouží jako běžné mechanismy pro regulaci excitability a synaptická síla.[5]
Regulace synaptické plasticity
Nesynaptická plasticita byla spojena se synaptickou plasticitou prostřednictvím synergických i regulačních mechanismů. Stupeň synaptické modifikace určuje polarita nesynaptických změn ovlivňujících změnu buněčné excitability. Mírné úrovně synaptické plasticity produkují nesynaptické změny, které budou synergicky působit se synaptickými mechanismy k posílení reakce. Naopak silnější úrovně synaptické plasticity způsobí nesynaptické reakce, které budou fungovat jako mechanismus negativní zpětné vazby. Mechanismy negativní zpětné vazby pracují na ochraně proti nasycení nebo potlačení aktivity obvodu jako celku.[5]
Axonální modulace
Axonální modulace je druh plasticity, ve kterém je počet, aktivita nebo umístění iontové kanály v axonových změnách. To způsobí, že se neuron při stimulaci chová odlišně. Modulace iontových kanálů je odpovědí na změnu stimulačních frekvencí neuronu.
Propagační plasticita
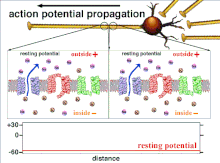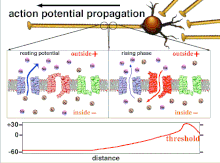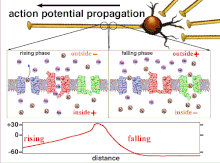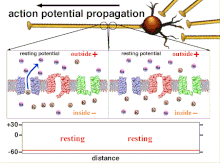
Protože je to součet akčních potenciálů, který nakonec vede k překročení prahové polarizace, je dočasný vztah různých vstupních signálů velmi důležitý pro určení, zda a kdy bude postsynaptický neuron vystřelen. Časem se může změnit čas potřebný k akčnímu potenciálu k šíření po délce konkrétního axonu. V jednom experimentu multielektrodová pole byly použity k měření času, který trvalo akčním potenciálům přejít z jedné elektrody na druhou, tzv. latence. Neurony byly poté stimulovány a byla zaznamenána hodnota latence v průběhu času. Hodnoty latence se časem měnily, což naznačuje, že axonální plasticita ovlivnila šíření akčních potenciálů.[8]
Posun
Posunování je proces, při kterém se během pasivního toku otevírají axonální iontové kanály (nevyžaduje se iontová pumpa ) podprahové hodnoty depolarizace dolů po axonu. Obvykle se vyskytuje v bodech axonálních větví,[9] načasování otevření těchto kanálů, když dorazí podprahový signál do oblasti, způsobí, že do pasivně tekoucí depolarizace bude zavedena hyperpolarizace. Proto je buňka schopna řídit, kterými větvemi axonu protéká podprahový depolarizační proud, což má za následek, že některá větve axonu jsou více hyperpolarizovaná než ostatní. Tyto odlišné membránové potenciály způsobují, že určité oblasti neuronu jsou vzrušivější než jiné, na základě konkrétního umístění a výskytu posunu.
Vysokofrekvenční stimulace
Krátkodobé účinky: Vysokofrekvenční stimulace neuronu na krátkou dobu zvyšuje excitabilitu neuronu snížením množství Napětí požadováno ke střelbě akčního potenciálu.[3]Vysokofrekvenční stimulace vede ke zvýšení intracelulární koncentrace iontů sodíku a vápníku v důsledku opakovaného otevírání napěťově řízené sodíkové a vápníkové kanály v axonu a terminálu. Jak se zvyšuje frekvence stimulů, je mezi každým stimulem méně času, aby buňka mohla repolarizovat a vrátit se do normálu klidový potenciál. Proto se klidový potenciál stává více depolarizovaným, což znamená, že ke spuštění akčního potenciálu je zapotřebí menší depolarizující proud.
Tato modulace je však obvykle velmi krátká. Pokud stimulace ustane, neuron se vrátí ke svému původnímu klidovému potenciálu jako iontové kanály a čerpadla mít dostatek času na zotavení z posledního stimulu.
Dlouhodobé účinky: Vysokofrekvenční stimulace neuronu po dlouhou dobu způsobí dvě výsledné neuronální změny. Zpočátku neuron reaguje tak, jak by reagoval během krátkodobé stimulace, se zvýšenou vzrušivostí. Pokračování vysokofrekvenční stimulace po tomto bodě má za následek drastickou nevratnou změnu vzrušivosti. Když koncentrace sodíku dosáhnou dostatečně vysoké úrovně v axonu, sodíkové / vápenaté pumpy obrátí svůj směr toku, což způsobí, že se vápník dováží do buňky při vývozu sodíku. Zvýšená koncentrace vápníku (a následná depolarizace membrány) deaktivuje sodíkové kanály a zaměřuje je na endocytóza a lysozomální hydrolýza.[10]To má za následek velké snížení axonálních sodíkových kanálů, které jsou nezbytné pro šíření akčního potenciálu. Pokud stimulace pokračuje, neuron nakonec přestane přenášet akční potenciály a zemře. Neuronální smrt v důsledku nadměrné stimulace se nazývá excitotoxicita.
Nízkofrekvenční stimulace
Krátkodobé účinky: Všechny živé neurony mají bazální rychlost šíření akčního potenciálu a synaptické uvolňování. Nízkofrekvenční stimulace neuronu je tedy v krátkodobém horizontu podobná aktivitě neuronu v klidu v mozku. S vnitřní excitabilitou neuronu nedošlo k žádným zásadním změnám.
Dlouhodobé účinky: Nízkofrekvenční stimulace neuronu po dlouhou dobu snižuje excitabilitu neuronu aktivací fosfatáz závislých na vápníku, které značkují AMPA receptory pro internalizaci.[11] Nízkofrekvenční stimulace vede k nízké hladině vápníku v buňce. Když jsou koncentrace vápníku nízké, dominují aktivní fosfatázy závislé na vápníku nad kinázami závislými na vápníku. Jak je aktivováno více fosfatáz, označují více receptorů AMPA pro internalizaci prostřednictvím endocytózy. Vzhledem k tomu, že receptory AMPA jsou jedním z hlavních excitačních receptorů na neuronech, jejich odstranění z buněčné membrány účinně deprimuje buňku (pokud buňka nemůže reagovat na excitační signály, nemůže generovat vlastní akční potenciál). Tímto způsobem může nízkofrekvenční stimulace skutečně zvrátit účinky dlouhodobé potenciace,[12] tyto koncepty se však obecně považují za typy synaptické plasticity.
Homeostatická a Hebbova plasticita
Centrální nervový systém (CNS) neurony integrují signály z mnoha neuronů. Z krátkodobého hlediska je důležité mít změny v aktivitě neuronu, protože takto se přenášejí informace v nervovém systému (Hebská plasticita ). Pro dlouhodobou udržitelnost však posun směrem k excitabilitě nebo nebuzivosti naruší schopnost obvodu předávat informace (homeostatická plasticita ). Dlouhodobá potenciace (LTP) indukuje vyšší rychlost střelby v postsynaptických neuronech. Předpokládala se hypotéza, že vnitřní vlastnosti neuronu by měly být uspořádány tak, aby co nejlépe využívaly dynamický rozsah a fungovaly jako homeostatický mechanismus.[13] Ukázalo se však, že vnitřní excitabilita sleduje lognormální distribuci, která vyžaduje udržování aktivního hebbského učení.[14] Studie in vitro zjistily, že když spontánní aktivita neuronových kultur je potlačeno, neurony se stávají velmi vzrušitelnými a že když je po dlouhou dobu indukováno zvýšení aktivity, rychlost vypalování kultury klesá.[15][16] Naproti tomu existuje spousta důkazů, že dochází i k opačné formě regulace, hebbovskému učení nebo LTP-IE / LTD-IE[17] a teoretické argumenty to ukazují Hebská plasticita musí být dominantní formou plasticity i pro vnitřní excitabilitu.[14] Od té doby homeostatická plasticita dochází také mezi jednotlivými synapsemi,[18] dřívější názor naznačující, že homeostatická plasticita a vnitřní plasticita jsou spojeny, se ukázal být v rozporu s důkazy.
Mechanismus
Jeden mechanismus pro zachování dynamického rozsahu neuronu je synaptické škálování, homeostatická forma plasticity, která obnovuje neuronovou aktivitu na její normální „základní“ hladinu změnou postsynaptické odpovědi synapsí neuronu jako funkce aktivity. Homeostatická modulace vnitřní excitability neuronu je dalším způsobem, jak udržet stabilitu. Nařízení z iontové vodivosti lze dosáhnout mnoha způsoby, většinou uvolňováním neuromodulátorů, jako je dopamin, serotonin atd.[19] Dalším způsobem je řízené uvolňování z mozku neurotrofický faktor (BDNF). Bylo také zjištěno, že BDNF ovlivňuje synaptické škálování, což naznačuje, že tento neurotrofický faktor může být zodpovědný za koordinaci synaptických a nesynaptických mechanismů v homeostatické plasticitě.[4]
Dendritická vzrušivost
Dendrity jsou regiony odpovědné za integraci vstupů z jiných neurony. Jedním ze způsobů, jak neurony manipulují s integračními vlastnostmi dendritů, je změna počtu a vlastností napěťově řízených iontových kanálů. Vyvolání konkrétního dlouhodobého potenciace (LTP) synapse, má za následek zvýšení vzrušivosti dendritických větví specifických pro danou synapse.[20] Dendritická excitabilita je důležitá pro šíření a integraci synaptických signálů. Předpokládá se, že dendritická excitabilita přispívá k potenciaci E-S nebo ke zvýšení pravděpodobnosti, že daný vstup bude mít za následek odpálení akčního potenciálu.[21]
Je známo, že změny v dendritické dráždivosti ovlivňují zpětné šíření akčního potenciálu. Akční potenciály začínají poblíž pahorku axonu a šíří se po délce axonu, ale také se šíří dozadu přes somu do dendritického altánu. Aktivní zpětné šíření závisí na iontových kanálech a změna hustoty nebo vlastností těchto kanálů může ovlivnit stupeň, v jakém je signál oslabený.[21] Plasticita zpětného šíření v dendritech nastává za méně než jednu minutu a trvá déle než 25 minut.[22] Zpětné šíření je metoda signalizace do synapsí, že byl aktivován akční potenciál. To je důležité pro plasticita závislá na časování špiček.
Vnitřní plasticita
Vnitřní plasticita je forma plasticity závislé na činnosti odlišná od synaptická plasticita, který zahrnuje změny na synapse mezi dvěma neurony, spíše než změny elektrických vlastností v jednom neuronu.[23][24] Existují některé úzce související jevy, které mohou ovlivnit vzrušivost neuronu - například neuromodulace strukturální plasticita, krátkodobá plasticita v důsledku kinetiky kanálu a neurální vývoj.[25][26] Neexistuje shoda ohledně množství, které reguluje vnitřní plasticita, např. rychlost střelby neuronu, jeho zisk nebo jeho vnitřní koncentrace vápníku. Vnitřní plastickost může funkčně umožnit neuronům naučit se intenzitu stimulů a představovat tyto statistiky intenzity v jejich vzrušivosti.[27][28] Vnitřní plasticita přispívá ke kódování paměti a doplňuje další formy plasticity závislé na činnosti, včetně synaptická plasticita.[29]
Vyšší funkce mozku
Dlouhodobá asociativní paměť
Experimentální důkazy
Experiment Kemenes et al.[2] prokázal, že v zevnějšku modulační neuron, nesynaptická plasticita ovlivňuje vyjádření dlouhodobé asociativní paměti. Vztah mezi nesynaptickou plasticitou a pamětí byl hodnocen pomocí mozkových obřích buněk (CGC). Depolarizace z podmíněných podnětů zvýšila odpověď neuronové sítě. Tato depolarizace trvala tak dlouho, dokud dlouhodobá paměť. Trvalá depolarizace a behaviorální paměť se projevily více než 24 hodin po tréninku, což naznačuje dlouhodobé účinky. V tomto experimentu elektrofyziologické exprese stopy dlouhodobé paměti byla podmíněná stimulační odezva na krmení. CGC byly ve trénovaných organismech významně více depolarizovány než v kontrolní skupině, což naznačuje souvislost se změnami učení a excitability. Když byly CGC depolarizovány, vykazovaly zvýšenou reakci na podmíněné podněty a silnější fiktivní stravovací reakci. To prokázalo, že depolarizace je dostatečná k tomu, aby vyvolala významnou odezvu krmení na podmíněné podněty. Kromě toho nebyl pozorován žádný významný rozdíl v rychlosti krmení mezi kondicionovanými organismy a těmi, které byly uměle depolarizovány, čímž se znovu potvrzuje, že depolarizace je dostatečná k vytvoření chování spojeného s dlouhodobou pamětí.[2]
Paměťové úložiště
Nesynaptická aktivita v buňce je obvykle vyjádřena jako změny neuronální excitability. K tomu dochází prostřednictvím modulace membránových složek, jako je odpočinek a napěťově řízené kanály a iontová čerpadla. Předpokládá se, že do úložiště paměti jsou zapojeny nesynaptické procesy. Jedním z možných mechanismů této akce je značení neuronu, který byl nedávno aktivní se změnami excitability. To by pomohlo propojit časově oddělené podněty. Další potenciální mechanismus pochází z výpočetního modelu, který naznačuje, že nesynaptická plasticita může připravit obvody pro modifikaci učení, protože změny excitability mohou regulovat práh synaptické plasticity.[5]
Úložná kapacita paměťových systémů založených na synaptické paměti je velmi velká, což z ní činí atraktivní mechanismus ke studiu. Existuje přibližně 104 synapsí na neuron a 1011 neurony v lidském mozku.[23] Nesynaptická plasticita je často přehlížena jednoduše proto, že její skladovací kapacita není tak vysoká. Regulace hustoty iontových kanálů v axonu a somě neuronu by změnila propustnost a ovlivnila všechny synapse. Jeho skladovací kapacita by proto byla podstatně menší než skladovací kapacita synaptické plasticity.
Zatímco jeho skladovací kapacita je příliš nízká na to, aby se stala jediným mechanismem pro skladování, nesynaptická plasticita by mohla přispět k synaptickým metodám skladování. Ukázalo se, že modulace iontových kanálů může nastat v oblastech tak malých jako specifické dendrity.[20] Tato specificita zvětšuje úložnou kapacitu nesynaptické plasticity, než kdyby se bralo jako modulace celého neuronu. Procesní vzpomínky jsou pro tento typ úložného systému vhodné, protože nevyžadují vysokou specificitu, jakou deklarativní paměti vyžadují. Zobecnění motorických úkolů a podmíněné podněty mohou být účinným způsobem, jak tyto informace ukládat.[23]
Učení se
Změny vzrušivosti při učení, které fungují jako součást trasování paměti Udělejte to jako primery k zahájení dalších změn v neuronech nebo pomocí mechanismu krátkodobého ukládání krátkodobé paměti. Nesynaptická plasticita se může objevit během učení v důsledku buněčných procesů, i když časování, vytrvalost a vztah mezi nesynaptickou plasticitou a synaptickým výstupem jsou špatně pochopeny. Studie prokázaly, že nesynaptická plasticita hraje při formování vzpomínek nepřímou, ale důležitou roli. Nesynaptická plasticita vyvolaná učením je spojena s depolarizací soma.[5]
Klasická klimatizace
Experimenty odhalily, že v průběhu dochází k nesyntetickým změnám podmíněné učení. Dřevnatý et al.[30] to prokázal úprava eyeblink (EBC), forma klasického kondicionování pro studium nervových struktur a mechanismů, které jsou základem učení a paměti, u kočky je spojena se zvýšenou excitabilitou a vstupem do neuronů v senzomotorické kortikální oblasti a v obličejové jádro. Bylo pozorováno, že zvyšující se excitabilita z klasického kondicionování pokračovala i po ukončení reakce. To naznačuje, že zvýšená excitabilita může fungovat jako mechanismus pro ukládání paměti.[5]
Při kondicionování očních linek u králíků docházelo během celého období k nesynaptickým změnám hřbetní hipokampus. To naznačuje, že ačkoli samotné změny excitability nestačí k vysvětlení procesů ukládání do paměti, nesynaptická plasticita může být mechanismem ukládání pro fáze paměti omezené časem. Nesynaptické změny ovlivňují jiné typy plasticity spojené s pamětí. Například nesynaptická změna, jako je depolarizace klidový membránový potenciál vyplývající z podmíněného učení by mohlo v příštím učení způsobit synaptickou plasticitu.[5]
Pravidlo učení a úspory
Schopnost učit se pravidla závisí na nesynaptické plasticitě. Jedna studie se snažila naučit krysy rozlišovat mezi různými pachy a trvalo několik dní, než se naučily rozlišovat mezi prvními pachy. Poté, co se to ale naučil, se krysa dokázala naučit rozlišovat mezi různými pachy mnohem rychleji. Změny excitability pyramidových neuronů u těchto potkanů byly pozorovány tři dny po tréninku. Tyto změny nakonec vybledly, což naznačuje, že neurony byly zapojeny do učení pravidel, ne do ukládání paměti.[5] Daoudal a Debanne se pokusili zjistit, zda stejná pravidla učení a indukční mechanismy definované pro synaptickou plasticitu platí i pro nesynaptickou plasticitu ovlivňující iontové kanály. Zjistili, že nesynaptická a synaptická plasticita sdílejí společná pravidla učení a indukční cesty, např. NMDA receptor závislá dlouhodobá potenciace (LTP) a dlouhodobá deprese (LTD). Ukázali také, že nesynaptická a synaptická plasticita synergicky tvoří koherentní engram ukládat stopy paměti.[22]
Úspory jsou schopnost znovu se naučit zapomenuté informace mnohem rychleji, než se dozvěděly původně. Možným mechanismem tohoto efektu úspory je nesynaptická plasticita. Během tréninkových procedur dochází u mnoha neuronů ke zvýšení vnitřní vzrušivosti. Toto zvýšení vzrušivosti přetrvává i po vyblednutí paměti.[5][23]
Závislost na látce
Drogy zneužívání obvykle ovlivňují mezolimbický systém, nebo konkrétněji cesta odměny nervového systému. Mezi běžnými návykovými látkami je nikotin jedním z nejsilnějších agonistů nikotinové cholinergní synapsy.[31] Nikotin, soutěžící s acetylcholinem (ACh), působí prostřednictvím nesynaptického, předčasného nikotinový acetylcholinový receptor (nAChRs) k iniciaci změny membránového potenciálu a šíření intracelulárního Ca2+ signálu, čímž podporuje uvolňování neurotransmiterů. Specifická a charakteristická role aktivity nAChR zprostředkované vápníkovým proudem má jinou závislost na napětí než jiná Ca2+ propustné iontové kanály, stejně jako různé časové a prostorové rozložení, a jako výsledek, nesynaptická aktivita nAChR zvyšuje indukci synaptické potenciace a podporuje učení látkové závislosti.[32]
Aplikace na nemoci
Po poškození
Nesynaptická plasticita může fungovat ke zmírnění účinků poškození mozku. Když jeden z vestibulární nervy je poškozen, rozdíly v rychlosti střelby neuronů v vestibulární jádra způsobuje zbytečné vestibulární reflexy. Příznaky tohoto poškození časem slábnou. To je pravděpodobně způsobeno modifikacemi vnitřní excitability v neuronech vestibulárního jádra.[23][33]
Záchvatová aktivita
Nesynaptická plasticita také hraje klíčovou roli záchvat aktivita. Febrilní záchvaty, záchvaty způsobené horečkou v raném věku, mohou vést ke zvýšené excitabilitě hipokampálních neuronů. Tyto neurony jsou vysoce senzibilizovány na konvulzivní látky. Ukázalo se, že záchvaty v raném věku mohou předisponovat jeden k více záchvatům prostřednictvím nesynaptických mechanismů.[34]
Trauma, včetně mrtvice což má za následek kortikální zranění, často vede k epilepsie. Zvýšená vzrušivost a NMDA vodivosti vedou k epileptické aktivitě, což naznačuje, že nesynaptická plasticita může být mechanismem, kterým je po traumatu indukována epilepsie.[35]
Autismus
Kyselina valproová (VPA) je léčba epilepsie, migrény, a bipolární porucha která byla spojena s mnoha podmínkami včetně autismus. An zvířecí model autismu existuje, kde se březím potkanům podává VPA. Potomci mají podobné rysy jako lidé s autismem. Krátce po narození vykazovala tato zvířata sníženou excitabilitu a zvyšovala se NMDA proudy. Tyto účinky jsou korigovány v pozdějších fázích života. Změny vnitřní excitability u těchto zvířat pomohly vyrovnat účinky zvýšených proudů NMDA na aktivitu v síti, což je forma homeostatické plasticity. Předpokládá se, že to pomáhá zprostředkovat škodlivé účinky, které by měly zvýšené proudy NMDA.[36]
Současný a budoucí výzkum
Je zapotřebí dalšího výzkumu, abychom získali širší pochopení nesynaptické plasticity. Témata, která by měla být dále prozkoumána od ledna 2010[Aktualizace] zahrnout:
- Změny lokální versus globální vzrušivosti v neuronových sítích a udržování stopy paměti[5]
- Specifičnost indukce změn excitability závislých na učení[5]
- Manipulace se změnami excitability závislými na učení farmaceutickými produkty nebo genetickými mutacemi a jejich účinky na stopu paměti[5]
- Podobnosti mezi molekulárními mechanismy synaptické a nesynaptické plasticity[5]
- Srovnání in vivo vzorů nesynaptické plasticity s výsledky in vitro[5]
- Změny v genové expresi vyvolané nervovou aktivitou[37]
Reference
- ^ A b Byrne, John H. (1997). „Synaptická plasticita“. Neurovědy online. Lékařská fakulta UT v Houstonu. Citováno 28. října 2011.
- ^ A b C Kemenes I, Straub VA, Nikitin ES, Staras K, O'Shea M, Kemenes G, Benjamin PR (červenec 2006). "Role zpožděné nesynaptické neuronální plasticity v dlouhodobé asociativní paměti". Aktuální biologie. 16 (13): 1269–79. doi:10.1016 / j.cub.2006.05.049. PMID 16824916. S2CID 16726488.
- ^ A b C Hansel C, Linden DJ, D'Angelo E (květen 2001). „Beyond parallel fiber LTD: rozmanitost synaptické a nesynaptické plasticity v mozečku“. Přírodní neurovědy. 4 (5): 467–75. doi:10.1038/87419. PMID 11319554. S2CID 13919286.
- ^ A b Desai NS, Rutherford LC, Turrigiano GG (1999). „BDNF reguluje vnitřní excitabilitu kortikálních neuronů“. Učení a paměť. 6 (3): 284–91. doi:10,1101 / lm. 6.3.384 (neaktivní 2020-10-22). PMC 311300. PMID 10492010.CS1 maint: DOI neaktivní od října 2020 (odkaz)
- ^ A b C d E F G h i j k l m n Ó Mozzachiodi R, Byrne JH (leden 2010). „Více než synaptická plasticita: role nesynaptické plasticity v učení a paměti“. Trendy v neurovědách. 33 (1): 17–26. doi:10.1016 / j.tins.2009.10.001. PMC 2815214. PMID 19889466.
- ^ A b Debanne D, Kopysova IL, Bras H, Ferrand N (září 1999). „Posouzení šíření akčního potenciálu axonální vodivostí draslíku podobného A v hipokampu: nový typ nesynaptické plasticity“. Journal of Physiology, Paříž. 93 (4): 285–96. doi:10.1016 / S0928-4257 (00) 80057-1. PMID 10574118. S2CID 30737916.
- ^ Szydlowska K, Tymianski M (únor 2010). "Vápník, ischemie a excitotoxicita". Buněčný vápník. 47 (2): 122–9. doi:10.1016 / j.ceca.2010.01.003. PMID 20167368.
- ^ Bakkum DJ, Chao ZC, Potter SM (květen 2008). „Dlouhodobá na činnosti závislá plasticita zpoždění a amplitudy šíření akčního potenciálu v kortikálních sítích“. PLOS ONE. 3 (5): e2088. Bibcode:2008PLoSO ... 3.2088B. doi:10.1371 / journal.pone.0002088. PMC 2324202. PMID 18461127.

- ^ Debanne D, Gähwiler BH, Thompson SM (1996). „Synaptická a nesynaptická plasticita mezi jednotlivými pyramidovými buňkami v hipokampu potkanů in vitro“. Journal of Physiology, Paříž. 90 (5–6): 307–9. doi:10.1016 / s0928-4257 (97) 87903-x. PMID 9089497. S2CID 31639170.
- ^ Ahmed Z, Wieraszko A (leden 2009). „Axonální plasticita závislá na aktivitě: Účinky elektrické stimulace na potenciály složené akce zaznamenané z myšího nervového systému in vitro“. The Open Neuroscience Journal. 3 (1): 6. Bibcode:2009ONMJ .... 1 .... 6P. doi:10.2174/1874082000903010001. S2CID 14646213.
- ^ Lin JW, Ju W, Foster K, Lee SH, Ahmadian G, Wyszynski M a kol. (Prosinec 2000). "Zřetelné molekulární mechanismy a odlišné endocytotické dráhy internalizace AMPA receptorů". Přírodní neurovědy. 3 (12): 1282–90. doi:10.1038/81814. PMID 11100149. S2CID 18109725.
- ^ O'Dell TJ, Kandel ER (1994). „Nízkofrekvenční stimulace vymaže LTP aktivací proteinových fosfatáz zprostředkovanou receptorem NMDA“. Učení a paměť. 1 (2): 129–139. doi:10,1101 / lm.1.2.129 (neaktivní 2020-10-22). PMID 10467591.CS1 maint: DOI neaktivní od října 2020 (odkaz)
- ^ Stemmler M, Koch C (červen 1999). "Jak se vodivosti závislé na napětí mohou přizpůsobit, aby maximalizovaly informace kódované rychlostí vypalování neuronů". Přírodní neurovědy. 2 (6): 521–7. doi:10.1038/9173. PMID 10448216. S2CID 15134486.
- ^ A b Scheler G (2017). „Logaritmické distribuce dokazují, že vnitřní učení je hebbovské“. F1000Výzkum. 6: 1222. arXiv:1410.5610. doi:10.12688 / F1000Research.12130.2. PMC 5639933. PMID 29071065.
- ^ Corner MA, Ramakers GJ (leden 1992). „Spontánní střelba jako epigenetický faktor ve vývoji mozku - fyziologické důsledky expozice chronickému tetrodotoxinu a pikrotoxinu na kultivovaných neuronech neuronů krys“. Výzkum mozku. Vývojový výzkum mozku. 65 (1): 57–64. doi:10.1016 / 0165-3806 (92) 90008-K. PMID 1551233.
- ^ Turrigiano GG, Leslie KR, Desai NS, Rutherford LC, Nelson SB (únor 1998). "Aktivita závislá škálování kvantové amplitudy v neokortikálních neuronech". Příroda. 391 (6670): 892–6. Bibcode:1998 Natur.391..892T. doi:10.1038/36103. PMID 9495341. S2CID 4328177.
- ^ Mahon S, Charpier S (srpen 2012). „Obousměrná plasticita vnitřní excitability řídí účinnost senzorických vstupů ve neuronech mozkové kůry vrstvy 5 barelů in vivo“. The Journal of Neuroscience. 32 (33): 11377–89. doi:10.1523 / JNEUROSCI.0415-12.2012. PMC 6621180. PMID 22895720.
- ^ Keck T, Keller GB, Jacobsen RI, Eysel UT, Bonhoeffer T, Hübener M (říjen 2013). "Synaptické škálování a homeostatická plasticita v mozkové vizuální kůře in vivo". Neuron. 80 (2): 327–34. doi:10.1016 / j.neuron.2013.08.018. PMID 24139037. S2CID 13151568.
- ^ Scheler G (2014). „Učení se vnitřní vzrušivosti ve středně ostnatých neuronech“. F1000Výzkum. 2: 88. doi:10.12688 / f1000research.2-88.v2. PMC 4264637. PMID 25520776.
- ^ A b Frick A, Magee J, Johnston D (únor 2004). „LTP je doprovázeno zvýšenou místní excitabilitou pyramidových neuronových dendritů“. Přírodní neurovědy. 7 (2): 126–35. doi:10.1038 / nn1178. PMID 14730307. S2CID 11964239.
- ^ A b Sjöström PJ, Rancz EA, Roth A, Häusser M (duben 2008). „Dendritická excitabilita a synaptická plasticita“. Fyziologické recenze. 88 (2): 769–840. doi:10.1152 / physrev.00016.2007. PMID 18391179. S2CID 1261675.
- ^ A b Daoudal G, Debanne D (2003). „Dlouhodobá plasticita vnitřní excitability: pravidla a mechanismy učení“. Učení a paměť. 10 (6): 456–65. doi:10,1101 / lm.64103. PMID 14657257.
- ^ A b C d E Zhang W, Linden DJ (listopad 2003). „Druhá strana engramu: změny založené na zkušenostech v neuronální vnitřní excitabilitě“. Recenze přírody. Neurovědy. 4 (11): 885–900. doi:10.1038 / nrn1248. PMID 14595400. S2CID 17397545.
- ^ Debanne D, Inglebert Y, Russier M (únor 2019). „Plasticita vnitřní neuronální excitability“ (PDF). Aktuální názor v neurobiologii. 54: 73–82. doi:10.1016 / j.conb.2018.09.001. PMID 30243042. S2CID 52812190.
- ^ Triesch, Jochen. "Synergie mezi vnitřní a synaptickou plasticitou v jednotlivých modelových neuronech. " Pokroky v systémech zpracování neurálních informací. 2004.
- ^ W. Zhang a D. J. Linden. The other side of the engram: Experience-driven changes in neuronal intrinsic excitability. Nature Reviews Neuroscience, 4:885-900, 2003.
- ^ T. Monk, C. Savin, and J. Lucke. "Optimal neural inference of stimulus intensities. " Scientific reports, 8:1, 2018.
- ^ T. Monk, C. Savin, and J. Lucke. Neurons equipped with intrinsic plasticity learn stimulus intensity statistics. Pokroky v systémech zpracování neurálních informací. 2016.
- ^ Grasselli G, Boele HJ, Titley HK, Bradford N, van Beers L, Jay L, et al. (Leden 2020). "SK2 channels in cerebellar Purkinje cells contribute to excitability modulation in motor-learning-specific memory traces". PLOS Biology. 18 (1): e3000596. doi:10.1371/journal.pbio.3000596. PMC 6964916. PMID 31905212.
- ^ Woody CD, Black-Cleworth P (November 1973). "Differences in excitability of cortical neurons as a function of motor projection in conditioned cats". Journal of Neurophysiology. 36 (6): 1104–16. doi:10.1152/jn.1973.36.6.1104. PMID 4761722.
- ^ Kauer JA, Malenka RC (November 2007). "Synaptic plasticity and addiction". Recenze přírody. Neurovědy. 8 (11): 844–58. doi:10.1038/nrn2234. PMID 17948030. S2CID 38811195.
- ^ Dani JA, Ji D, Zhou FM (August 2001). "Synaptic plasticity and nicotine addiction". Neuron. 31 (3): 349–52. doi:10.1016/S0896-6273(01)00379-8. PMID 11516393. S2CID 10062998.
- ^ Darlington CL, Dutia MB, Smith PF (June 2002). "The contribution of the intrinsic excitability of vestibular nucleus neurons to recovery from vestibular damage". Evropský žurnál neurovědy. 15 (11): 1719–27. doi:10.1046/j.1460-9568.2002.02024.x. PMID 12081651. S2CID 19939794.
- ^ Bender RA, Dubé C, Gonzalez-Vega R, Mina EW, Baram TZ (2003). "Mossy fiber plasticity and enhanced hippocampal excitability, without hippocampal cell loss or altered neurogenesis, in an animal model of prolonged febrile seizures". Hippocampus. 13 (3): 399–412. doi:10.1002/hipo.10089. PMC 2927853. PMID 12722980.
- ^ Bush PC, Prince DA, Miller KD (October 1999). "Increased pyramidal excitability and NMDA conductance can explain posttraumatic epileptogenesis without disinhibition: a model". Journal of Neurophysiology. 82 (4): 1748–58. doi:10.1152/jn.1999.82.4.1748. PMID 10515964. S2CID 5927906.
- ^ Walcott EC, Higgins EA, Desai NS (September 2011). "Synaptic and intrinsic balancing during postnatal development in rat pups exposed to valproic acid in utero". The Journal of Neuroscience. 31 (37): 13097–109. doi:10.1523/JNEUROSCI.1341-11.2011. PMC 6623264. PMID 21917793.
- ^ Leslie JH, Nedivi E (August 2011). "Activity-regulated genes as mediators of neural circuit plasticity" (PDF). Pokrok v neurobiologii. 94 (3): 223–37. doi:10.1016/j.pneurobio.2011.05.002. hdl:1721.1/102275. PMC 3134580. PMID 21601615.
