N,N-Dicyklohexylkarbodiimid - N,N-Dicyclohexylcarbodiimide - Wikipedia
 | |
 | |
 | |
| Jména | |
|---|---|
| Preferovaný název IUPAC N,N„-Dicyklohexylmethanediimin | |
| Ostatní jména Dicyklohexylmetandiimin N,N„-Dicyklohexylkarbodiimid DCC, DCCD, DCCI | |
| Identifikátory | |
3D model (JSmol ) | |
| 610662 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Informační karta ECHA | 100.007.914 |
| Číslo ES |
|
| 51651 | |
PubChem CID | |
| Číslo RTECS |
|
| UNII | |
| UN číslo | 2811 |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| C13H22N2 | |
| Molární hmotnost | 206.333 g · mol−1 |
| Vzhled | bílý krystalický prášek |
| Hustota | 1,325 g / cm3, pevný |
| Bod tání | 34 ° C (93 ° F; 307 K) |
| Bod varu | 122 ° C (252 ° F; 395 K) (při 6 mmHg) |
| nerozpustný | |
| Nebezpečí | |
| Piktogramy GHS |    |
| Signální slovo GHS | Nebezpečí |
| H302, H311, H317, H318 | |
| P261, P264, P270, P272, P280, P301 + 312, P302 + 352, P305 + 351 + 338, P310, P312, P321, P322, P330, P333 + 313, P361, P363, P405, P501 | |
| NFPA 704 (ohnivý diamant) | |
| Bod vzplanutí | 113 ° C (235 ° F; 386 K) |
| Související sloučeniny | |
Příbuzný karbodiimidy | DIC,EDC |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
N,N′ -Dicyklohexylkarbodiimid (DCC nebo DCCD)[1] je organická sloučenina s chemickým vzorcem (C6H11N)2C. Je to voskovitá bílá pevná látka se sladkou vůní. Jeho primární použití je párování aminokyseliny během umělé syntéza peptidů. Nízký bod tání tohoto materiálu umožňuje jeho roztavení pro snadnou manipulaci. Je vysoce rozpustný v dichlormethan, tetrahydrofuran, acetonitril a dimethylformamid, ale nerozpustný v voda.
Struktura a spektroskopie
C-N = C = N-C jádro karbodiimidů (N = C = N) je lineární a souvisí se strukturou Allene. Molekula se idealizovala C2 symetrie.
N = C = N skupina dává charakteristický IR spektroskopický podpis na 2117 cm−1.[2] The 15N NMR spektrum ukazuje charakteristický posun 275 ppm směrem nahoru od kyseliny dusičné a 13C NMR spektrum vykazuje vrchol při přibližně 139 ppm směrem dolů od TMS.[3]
Příprava
Z několika syntéz DCC, Pri-Bara et al. použití octan palladnatý, jod a kyslík k propojení cyklohexylaminu a cyklohexylu isokyanid.[4] Touto cestou bylo dosaženo výnosů až 67%:
- C6H11NC + C6H11NH2 + O.2 → (C.6H11N)2C + H2Ó
Tang et al. kondenzovat dva isokyanáty za použití katalyzátoru OP (MeNCH2CH2)3N ve výtěžcích 92%:[2]
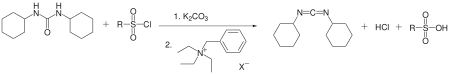
DCC byl také připraven z dicyklohexylmočovina používat katalyzátor fázového přenosu od Jaszay et al. Disubstituovaná močovina, arensulfonylchlorid a Uhličitan draselný reagují v toluenu v přítomnosti benzyl triethylamonium chloridu, čímž se získá DCC v 50% výtěžku.[5]
Reakce
Tvorba amidů, peptidů a esterů
DCC je dehydratační činidlo pro přípravu amidy, ketony a nitrily.[1] Při těchto reakcích DCC hydratuje za vzniku dicyklohexylmočoviny (DCU), sloučeniny, která je téměř nerozpustná ve většině organických rozpouštědel a nerozpustná ve vodě. Většina DCU je tak snadno odstraněna filtrací, i když poslední stopy z nepolárních produktů je obtížné odstranit. DCC lze také použít k obráceně sekundární alkoholy. V Steglichova esterifikace, alkoholy, včetně dokonce některých terciárních alkoholů, mohou být esterifikovány pomocí karboxylové kyseliny v přítomnosti DCC a katalytického množství DMAP.[6]
Při syntéze bílkovin (např Fmoc polovodičové syntezátory ), N-konec se často používá jako místo připojení, na kterém je aminokyselina monomery jsou přidány. Vylepšit elektrofilita z karboxylát záporně nabitý kyslík musí být nejprve „aktivován“ na lepší opouštějící skupina. K tomuto účelu se používá DCC. Záporně nabitý kyslík bude působit jako a nukleofil, útočící na centrální uhlík v DCC. DCC je dočasně připojen k dřívější karboxylátové skupině a tvoří vysoce elektrofilní meziprodukt nukleofilní útok terminální aminoskupinou na rostoucím peptidu účinnější.
Moffattova oxidace
V kombinaci s dimethylsulfoxid (DMSO), DCC ovlivňuje Pfitzner-Moffattova oxidace.[7] Tento postup se používá pro oxidaci alkoholy na aldehydy a ketony. Na rozdíl od kovu oxidace, tak jako Jonesova oxidace, reakční podmínky jsou dostatečně mírné, aby se zabránilo nadměrné oxidaci aldehydů na karboxylové kyseliny. Obecně se nechá reagovat přes noc při teplotě místnosti tři ekvivalenty DCC a 0,5 ekvivalentu zdroje protonu v DMSO. Reakce se zastaví kyselinou.
Další reakce
- Reakce kyseliny s peroxidem vodíku v přítomnosti DCC vede k tvorbě peroxidové vazby.
- Alkoholy lze také dehydratovat pomocí DCC. Tato reakce probíhá tak, že se nejprve získá meziprodukt O-acylmočoviny, který se poté hydrogenolyzuje za vzniku odpovídajícího alkenu:
- RCHOHCH2R '+ C6H11N)2C → RCH = CHR '+ (C.6H11NH)2CO
- Sekundární alkoholy mohou být stereochemicky invertovány tvorbou formylesteru následovanou zmýdelnění. Sekundární alkohol je smíchán přímo s DCC, kyselina mravenčí a silná základna jako methoxid sodný.
Biologické působení
DCC je klasický inhibitor ATP syntáza.[8] DCC inhibuje ATP syntázu vazbou na jednu z C podjednotky a způsobující sterickou zábranu otáčení FÓ podjednotka.[9]
Bezpečnost
DCC je silný alergen a senzibilizátor, který často způsobuje kožní vyrážky.[1]
Viz také
Reference
- ^ A b C Jeffrey S. Albert, Andrew D. Hamilton, Amy C. Hart, Xiaoming Feng, Lili Lin, Zhen Wang (2017). „1,3 ‐ Dicyklohexylkarbodiimid“. EEROS: 1–9. doi:3. 1002/047084289X.rd146.pub3. ISBN 9780470842898.CS1 maint: používá parametr autoři (odkaz)
- ^ A b Tang, J .; Mohan, T .; Verkade, J. G. (1994). „Selektivní a efektivní syntéza perhydro-1,3,5-triazin-2,4,6-trionů a karbodiimidů z izokyanátů pomocí ZP (MeNCH2CH2)3N katalyzátory ". Journal of Organic Chemistry. 59 (17): 4931–4938. doi:10.1021 / jo00096a041.
- ^ Yavari, I .; Roberts, J. D. (1978). „Spektroskopie nukleární magnetické rezonance dusíku-15. Karbodiimidy“ (PDF). Journal of Organic Chemistry. 43 (25): 4689–4690. doi:10.1021 / jo00419a001.
- ^ Pri-Bar, I .; Schwartz, J. (1997). „N, N-dialkylkarbodiimidová syntéza palladiem katalyzovanou vazbou aminů s izonitrily“. Chemická komunikace. 1997 (4): 347–348. doi:10.1039 / a606012i.
- ^ Jászay, Z. M .; Petneházy, I .; Töke, L .; Szajáni, B. (1987). „Příprava karbodiimidů pomocí katalýzy fázovým přenosem“. Syntéza. 1987 (5): 520–523. doi:10,1055 / s-1987-27992.
- ^ Neises, B .; Steglich, W. (1985). "Esterifikace karboxylových kyselin s dicyklohexylkarbodiimidem / 4-dimethylaminopyridinem: terc-butyl-ethylfumarát". Organické syntézy. 63: 183. doi:10.15227 / orgsyn.063.0183.
- ^ John G. Moffatt (1967). „Cholane-24-al“. Org. Synth. 47: 25. doi:10.15227 / orgsyn.047.0025.
- ^ Hong S, Pedersen PL. (2008). „ATP syntáza a působení inhibitorů využívaných ke studiu jejích rolí v oblasti lidského zdraví, nemocí a dalších vědeckých oblastí“. Microbiol Mol Biol Rev. 72 (4): 590–641. doi:10.1128 / MMBR.00016-08. PMC 2593570. PMID 19052322.CS1 maint: používá parametr autoři (odkaz)
- ^ Toei M, Noji H. (2013). „Jednomolekulární analýza F0F1-ATP syntáza inhibována N,N-dicyklohexylkarbodiimid ". J Biol Chem. 288 (36): 25717–26. doi:10,1074 / jbc.M113,482455. PMC 3764779. PMID 23893417.CS1 maint: používá parametr autoři (odkaz)
externí odkazy
- Vynikající ilustraci tohoto mechanismu naleznete zde: [1].