Imunoglobulin M. - Immunoglobulin M
Tento článek je tón nebo styl nemusí odrážet encyklopedický tón použitý na Wikipedii. (Února 2018) (Zjistěte, jak a kdy odstranit tuto zprávu šablony) |
| Imunoglobulin M. | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (pentamer) | |||||||||||||
 | |||||||||||||
| Proteinový typ | protilátka | ||||||||||||
| |||||||||||||
Imunoglobulin M. (IgM) je jedním z několika izotypy z protilátka (také známý jako imunoglobulin), které produkuje obratlovců. IgM je největší protilátka a je to první protilátka, která se objevila v Odezva k počáteční expozici vůči antigen.[1][2] V případě lidí a jiných savců, které byly studovány, se slezina, kde plazmablasty zodpovědný za produkci protilátek je hlavním místem specifické produkce IgM.[3][4]
Dějiny
Studie IgM začala zprávou z roku 1937, že koně hyperimunizovaní pneumokokovým polysacharidem produkovali protilátky, které byly mnohem větší než typický králičí γ-globulin,[5] s molekulovou hmotností 990 000 daltony.[6] V souladu se svou velkou velikostí byla nová protilátka původně označována jako γ-makroglobulin a poté v další terminologii jako IgM — M pro „makro“. V domény normálního imunoglobulinu jsou vysoce heterogenní, což odráží jejich roli při ochraně před širokou škálou infekčních mikrobů, a tato heterogenita znemožňovala podrobnou strukturní analýzu IgM. Následně byly objeveny dva zdroje homogenního IgM. Za prvé, vysokomolekulární protein produkovaný některými mnohočetný myelom pacientů bylo rozpoznáno jako y-makroglobulin produkovaný nádorem, a nyní to víme, protože nádor je klon IgM, který produkuje, je homogenní.[7] V šedesátých letech byly vyvinuty metody pro indukci nádorů produkujících imunoglobuliny (plazmocytomy) u myší, což také poskytuje zdroj homogenních imunoglobulinů různých izotypů, včetně IgM (přehled[8]). V poslední době lze expresi geneticky upravených imunoglobulinových genů v tkáňové kultuře použít k produkci IgM se specifickými alteracemi, a tím k identifikaci molekulárních požadavků na vlastnosti, které nás zajímají.
Struktura
Imunoglobuliny zahrnují lehké řetězce a těžké řetězce. Lehký řetězec (λ nebo κ) je protein o ~ 220 aminokyselinách, složený z variabilní domény, VL (segment přibližně 110 aminokyselin) a konstantní domény CL (také přibližně 110 aminokyselin dlouhý). U těžký řetězec IgM je protein ~ 576 aminokyselin a zahrnuje variabilní doménu (VH ~ 110 aminokyselin), čtyři odlišné domény konstantní oblasti (Cul, Cul2, Cul3, Cul4, každá ~ 110 aminokyselin) a „Struník“ ~ 20 aminokyselin. U těžkého řetězce nese oligosacharidy na pěti asparaginových zbytcích. Oligosacharidy na myších a lidských IgM byly částečně charakterizovány řadou technik, včetně NMR, vazby lektinu, různých chromatografických systémů a enzymatické citlivosti (přehled v[9]). Struktura oligosacharidů v každém místě se liší v detailech a převládající oligosacharidy - biantennary, triantennary, high mannose - se mezi jednotlivými místy liší.
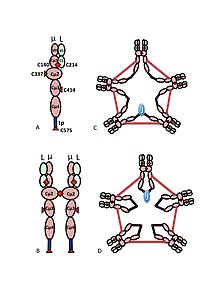
A) ul heterodimer, někdy nazývaný jako halfmer, s variabilními (VH, VL) a konstantní oblastí (Cul, Cul2, Cul3, Cul4tp; CL) doménami. Cysteiny, které zprostředkovávají disulfidové vazby mezi µ řetězci, jsou zobrazeny jako červené šipky, takže cystein disulfidová vazba se jeví jako červená dvojitá šipka (červený diamant).
B) IgM „monomer“ (µL) 2. Disulfidové vazby mezi doménami Cu2 jsou reprezentovány červenou dvojitou šipkou.
C, D) Dva modely pentameru IgM obsahujícího řetězec J, které se objevily v různých publikacích v různých časech. Stejně jako v bodě (B) jsou disulfidové vazby mezi doménami Cu2 a disulfidové vazby mezi doménami Cu4tp reprezentovány červenou dvojitou šipkou; disulfidové vazby Cµ3 jsou (kvůli jasnosti) reprezentovány dlouhými šipkami se dvěma hlavami. Konektivita, tj. Mezireťazcová disulfidová vazba řetězců µ, se označuje jako elektrická konektivita. V (C) disulfidové vazby C3 spojují řetězce µ paralelně s disulfidovými vazbami C44tp a tyto disulfidové vazby spojují řetězce μ sériově s disulfidovými vazbami Cu2. V (D) disulfidové vazby Cµ2 a Cµ4tp spojují µ řetězce paralelně a oba typy spojují µ řetězce v sérii s Cul3 disulfidovými vazbami. (Obrázek je reprodukován se svolením vydavatele a autorů[10]).
Multimerní struktura IgM je schematicky znázorněna na obrázku 1. Obrázek 1A ukazuje „heterodimer“ složený z jednoho lehkého řetězce označeného L a jednoho těžkého řetězce označeného u. Těžký a lehký řetězec jsou drženy pohromadě jak disulfidovými vazbami (znázorněnými jako červené trojúhelníky), tak nekovalentními interakcemi.
Obrázek 1B ukazuje dvě ul jednotky spojené disulfidovou vazbou v doménách Cu2; tato struktura (µL) 2 se často označuje jako „monomer“ IgM, protože je v některých ohledech analogická struktuře imunoglobulin G (IgG).
Na základě své rychlosti sedimentace a vzhledu na elektronových mikrofotografiích bylo odvozeno, že IgM je většinou „pentamer“, tj. Polymer složený z pěti „monomerů“ [(µL) 2] 5, a byl původně znázorněn modely na obrázcích 1C a 1D, s disulfidovými vazbami mezi doménami Cµ3 a mezi koncovými částmi.[11][12] Je také ukázáno, že pentamerní IgM zahrnuje třetí protein, řetězec J. J řetězec (J pro spojení) byl objeven jako kovalentně vázaná složka polymerních IgA a IgM.[13][14] J řetězec je malý (~ 137 aminokyselin), kyselý protein. Jak je znázorněno, řetězec J spojuje dva µ řetězce prostřednictvím disulfidových vazeb zahrnujících cysteiny v koncovkách.[15]
Molekulární požadavky na tvorbu polymerního IgM
Zpočátku se očekávalo, že řetězec J bude důležitý pro tvorbu polymerních imunoglobulinů a polymerace IgA skutečně silně (ale ne zcela) závisí na řetězci J.[16][17] Naproti tomu polymerní IgM se účinně tvoří v nepřítomnosti řetězce J.[18][19]
Převládající formou lidského a myšího IgM je pentamer. Pro srovnání, IgM ze žáby (Xenopus) je převážně hexamer,[20][21] IgM z kostnatých ryb je převážně tetramer a IgM z chrupavčitých ryb (žralok) je převážně pentamer.[22][23] Bez ohledu na převahu pentameru v myším a lidském IgM bylo zřejmé, že tyto IgM mohou existovat také jako hexamer.[24][25] Následné studie využívající rekombinantní expresní systémy DNA ukázaly, že hexamer je hlavní formou myšího IgM, když je IgM produkován za podmínek, kdy je zabráněno začlenění řetězce J, buď produkcí IgM v buňkách, které postrádají řetězec J[18] nebo produkcí IgM s těžkým řetězcem µ, kterému chybí cystein v koncovce.[26][27] Stručně řečeno, hexamerní IgM nikdy neobsahuje J řetězec; pentamerní IgM mohou být vytvořeny tak, aby zahrnovaly nebo nezahrnovaly J řetězec.[28]
Důležitým rozdílem mezi těžkými řetězci µ a γ je dostupnost cysteinů pro tvorbu disulfidových vazeb mezi těžkými řetězci. V případě γ těžkého řetězce jsou jediné vazby mezi γ tvořeny cysteiny v závěsu a podle toho se každý γ řetězec váže pouze na jeden další γ řetězec. Naproti tomu domény Cu2 a Cu3 a koncovka obsahují cystein, který tvoří disulfidovou vazbu s dalším u řetězcem. Cysteiny v doménách Cul2 zprostředkovávají tvorbu monomerního IgM (ul) 2. Koncovka spolu se zahrnutým cysteinem je nezbytná a dostatečná pro tvorbu polymerních imunoglobulinů. To znamená, že odstranění koncovky z těžkého řetězce µ zabrání tvorbě polymerního IgM.[29] Naopak buňky exprimující y těžký řetězec, který byl upraven tak, aby zahrnoval koncovku, produkují polymerní IgG.[30][31][32]
Role cysteinu v doméně Cµ3 je jemnější. Obrázky 1C a 1D představují možné modely pro pentamerní IgM. V těchto modelech se předpokládá, že každý µ řetězec naváže dva další µ řetězce. Ani jeden model však nemůže plně odpovídat za strukturu polymerního IgM. Například model na obrázku 1C předpovídá, že disulfidová vazba mezi doménami Cµ2 je nezbytná pro výrobu polymerního IgM s disulfidovou vazbou. Model na obrázku 1D předpovídá, že disulfidová vazba mezi doménami Cµ3 je zásadní. Ve skutečnosti lze polymerní IgM vázaný na disulfidovou vazbu stále připravovat, pokud chybí některý ze tří cysteinů. V kontextu modelů, ve kterých každý µ řetězec interaguje pouze se dvěma dalšími µ řetězci, tyto výsledky naznačují, že některé molekuly jsou jako obrázek 1C a jiné jako obrázek 1D. Dostupnost tří cysteinů pro navázání řetězce mezi µ však naznačuje, že řetězce µ by se mohly každý vázat na další tři řetězce µ, jak je znázorněno na obrázku 2. Ve stejném duchu představuje obrázek 2C model pentameru obsahujícího řetězec J, který odráží důkaz, že J řetězec spojuje µ řetězce, které nejsou spojeny s jinými µ řetězci cysteiny v doménách Cµ3. Tyto a další modely, pravidelné i nepravidelné, jsou diskutovány jinde.[27][33]
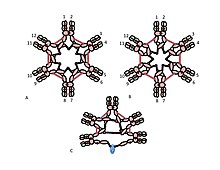
A, B) Tyto obrázky znázorňují dva z mnoha možných modelů disulfidové vazby inter-u řetězce v hexamerním IgM. Stejně jako na obrázku 1 jsou disulfidové vazby C22 a disulfidové vazby C44p představovány červenou dvojitou šipkou a disulfidové vazby C33 jsou představovány dlouhými dvojitými šipkami. V obou modelech A a B spojuje každý typ disulfidové vazby (Cu2-Cu2; Cu3-Cu3; Cu4tp-Cu4tp) u řetězce v sérii s každým z ostatních. Metody pro rozlišení těchto a dalších modelů jsou popsány v odkazu [28].
C) Toto znázornění pentamerních IgM ilustruje, jak může být J řetězec navázán na µ řetězce, které nejsou navázány prostřednictvím C3 disulfidových vazeb
Pentamerický IgM je typicky reprezentován jako obsahující jediný J řetězec na polymer, ale ve skutečnosti se měření stechiometrie řetězce J pohybovala v rozmezí od jedné molekuly J na polymer do tří molekul J na polymer.[34][35][36][37] Široký rozsah může být způsoben technickými problémy, jako je neúplné radioaktivní značení nebo nepřesné vyčíslení Ouchterlonyho linky. Variace však může být také způsobena heterogenitou přípravků IgM, tj. Různé přípravky se mohly podstatně lišit v obsahu polymerů obsahujících J a J-deficientních polymerů.
Terciární a kvartérní struktura konstantní oblasti µ
Abychom získali přehled o podrobné trojrozměrné struktuře řetězce u, byly jednotlivé domény Cµ2, Cµ3 a Cµ4tp vyrobeny odděleně v E. coli a poté analyzovány různými metodami, včetně rychlosti sedimentace, rentgenové krystalografie a NMR spektroskopie. Stejně jako v případě jiných imunoglobulinů mají domény těžkého řetězce µ charakteristické překrývající se β-listy obsahující sedm řetězců, stabilizované disulfidovými vazbami uvnitř domény. Celkově má konstantní oblast IgM strukturu podobnou „houbám“, kde domény Cµ2-Cµ3 jsou disk analogický s hlavou houby a domény Cµ4tp vyčnívají jako krátká stopka.[38]
Funkce
IgM interaguje s několika dalšími fyziologickými molekulami:
- IgM se může vázat doplněk komponent C1 a aktivovat klasická cesta, vedoucí k opsonizace z antigeny a cytolýza.
- IgM se váže na polyimmunoglobulinový receptor (pIgR) v procesu, který přináší IgM do slizniční povrchy, jako jsou střeva lumen a do mateřského mléka. Tato vazba závisí na řetězci J.[39]
- Byly detekovány dva další Fc receptory, které váží IgM - Fcα / µ-R a Fcµ-R. Fcα / u-R, stejně jako pIgR, váže polymerní IgM a IgA. Fcα / µ-R může zprostředkovat endocytóza a jeho exprese ve střevě naznačuje roli v imunitě sliznic. Fcu-R (dříve známý jako Toso / Faim3) váže výhradně IgM a může zprostředkovat buněčnou absorpci IgM konjugovaného antigenu.[40] Inaktivací odpovídajících genů u knock-out myší vzniká a fenotyp, ale fyziologické funkce těchto receptorů jsou stále nejisté[41]
Regulace imunitní odpovědi
Charakteristický imunoglobuliny které se vstřikují do zvířat společně s jejich antigen může ovlivnit protilátkovou odpověď na stejný antigen.[42] Endogenní protilátky produkované po primární imunizaci mohou také ovlivnit protilátkovou odpověď na posilovací imunizaci, což naznačuje, že k podobným účinkům dochází za fyziologických podmínek. „Regulační“ účinky mohou být pozitivní nebo negativní. To znamená, že v závislosti na typu antigenu a izotypu protilátky může být účinkem potlačení nebo zesílení protilátkové odpovědi. Tyto účinky jsou dobře ilustrovány experimenty zahrnujícími imunizaci xenogenními (cizími) erytrocyty (červenými krvinkami). Například když je IgG podáván společně s xenogenními erytrocyty, tato kombinace způsobuje téměř úplné potlačení protilátkové odpovědi specifické pro erytrocyty. Tento účinek se klinicky používá k prevenci imunizace Rh negativních matek proti fetálním Rh pozitivním erytrocytům a jeho použití dramaticky snížilo výskyt hemolytické nemoci novorozence.[43]Na rozdíl od účinku IgG může antigen-specifický IgM značně zvýšit protilátkovou odpověď, zejména v případě velkých antigenů.[44] Když se tedy do zvířat (včetně lidí) injikuje IgM specifický pro erytrocyty společně s erytrocyty, indukuje se mnohem silnější protilátková odpověď na erytrocyty, než když se erytrocyty podávají samostatně. Několik linií důkazů naznačuje, že schopnost IgM se aktivovat doplněk je vyžadován pro jeho zesilující účinek. To znamená, že IgM zprostředkované vylepšení se nevyskytuje u zvířat, která byla ochuzena o složku komplementu C3, ani u mutantních zvířat bez receptory komplementu 1 a 2. Podobně mutantní IgM, který nemůže aktivovat komplement, nezvyšuje imunitní odpověď. Možným vysvětlením zesílení zprostředkovaného IgM je, že B lymfocyty zachycují komplexy IgM-antigen-komplement a transportují komplexy do oblastí ve slezině, kde se generují účinné imunitní odpovědi. Protože IgM je produkován brzy v imunitní odpovědi, může to být důležité při zahájení protilátkových odpovědí.
Syntéza
V buňkách zárodečné linie (spermie a vajíčka) nejsou geny, které nakonec kódují imunoglobuliny, ve funkční formě (viz V (D) J rekombinace ). V případě těžkého řetězce jsou tři segmenty zárodečné linie, označené V, D a J, ligovány dohromady a navázány na DNA kódující konstantní oblast těžkého řetězce u. Na počátku ontogeneze B buňky exprimují jak u, tak δ těžké řetězce; společná exprese těchto dvou těžkých řetězců, z nichž každý nese stejnou V doménu, závisí na alternativním sestřihu a alternativních poly-A adičních místech. Exprese ostatních izotypů (γ, ε a α) je ovlivněna jiným typem přesmyku DNA, procesem zvaným Přepínání třídy imunoglobulinů.[45]
Klinický význam
IgM je první imunoglobulin exprimovaný v lidském plodu (přibližně 20 týdnů)[46] a fylogeneticky nejdříve vyvinutá protilátka.[47]
IgM protilátky se objevují brzy v průběhu infekce a obvykle se znovu objevují v menší míře po další expozici. IgM protilátky neprocházejí lidskou placentou (pouze izotyp IgG ).
Tyto dvě biologické vlastnosti IgM ho činí užitečným při diagnostice infekčních onemocnění. Prokázání IgM protilátek v séru pacienta naznačuje nedávnou infekci nebo v séru novorozence označuje nitroděložní infekci (např. vrozený syndrom zarděnky ).
Vývoj anti-dárcovského IgM po transplantaci orgánu není spojen s odmítnutím štěpu, ale může mít ochranný účinek.[48]
Zjistilo se, že IgM v normálním séru se váže na specifické antigeny, a to i při absenci předchozí imunizace.[49] Z tohoto důvodu se IgM někdy říká „přirozená protilátka“. Tento jev je pravděpodobně způsoben vysokou aviditou IgM, která mu umožňuje detekovatelně se vázat i na slabě zkříženou reakci antigeny které se přirozeně vyskytují. Například IgM protilátky, které se vážou na červené krvinky Antigeny A a B. mohou vznikat v raném věku v důsledku expozice látkám podobným A a B, které jsou přítomny na bakteriích nebo možná také na rostlinných materiálech.
IgM protilátky jsou zodpovědné hlavně za shlukování (aglutinace ) z červené krvinky pokud příjemce a krevní transfúze přijímá krev, která není kompatibilní s jejich krevní skupina.
Viz také
Reference
- ^ "Imunoglobulin M". The American Heritage Dictionary of the English Language (Čtvrté vydání). Společnost Houghton Mifflin. 2004. ISBN 978-0618082308.
- ^ Alberts, B .; Johnson, A .; Lewis, J .; Walter, P .; Raff, M .; Roberts, K. (2002). „Kapitola 24“. Molekulární biologie buňky (4. vydání). Routledge. ISBN 978-0-8153-3288-6.
- ^ Capolunghi, F .; Rosado, M. M .; Sinibaldi, M .; Aranburu, A .; Carsetti, R. (2013). „Proč potřebujeme paměťové B buňky IgM?“. Imunologické dopisy. 152 (2): 114–20. doi:10.1016 / j.imlet.2013.04.007. PMID 23660557.
- ^ Williams, N .; O'Connell, P. R. (2008). „Kapitola 62“. Krátká praxe chirurgie Bailey & Love (25. vydání). CRC Press. p. 1102. ISBN 9780340939321.
- ^ Heidelberger, M .; Pedersen, K. O. (1937). „Molekulová hmotnost protilátek“. Journal of Experimental Medicine. 65 (3): 393–414. doi:10.1084 / jem.65.3.393. PMC 2133497. PMID 19870608.
- ^ Kabat, E. A. (1939). „Molekulová hmotnost protilátek“. Journal of Experimental Medicine. 69 (1): 103–118. doi:10.1084 / jem.69.1.103. PMC 2133729. PMID 19870830.
- ^ Waldenström, J. (1943). „Incipient myelomatisis or„ essential “hyoerglobulinemis with fibrinogenopenia - a new syndrome?“. Acta Medica Scandinavica. 142 (3–4): 216–247. doi:10.1111 / j.0954-6820.1944.tb03955.x.
- ^ Potter, M. (2007). Časná historie nádorů plazmatických buněk u myší, 1954-1976. Pokroky ve výzkumu rakoviny. 98. str. 17–51. doi:10.1016 / S0065-230X (06) 98002-6. ISBN 9780123738967. PMID 17433907.
- ^ Monica, T. J .; Williams, S. B .; Goochee, C. F .; Maiorella, B.L. (1995). "Charakterizace glykosylace lidského IgM produkovaného hybridem člověk-myš". Glykobiologie. 5 (2): 175–185. doi:10.1093 / glycob / 5.2.175. PMID 7780192.
- ^ Heyman, B .; Shulman, M. J. (2016). "Struktura, funkce a produkce imunoglobulinu M (IgM)". V Ratcliffe, M. (ed.). Encyklopedie imunobiologie. 2. Elsevier. s. 1–14. doi:10.1016 / B978-0-12-374279-7.05001-3. ISBN 978-0-12-374279-7.
- ^ Beale, D .; Feinstein, A. (1969). „Studie redukce lidského 19S imunoglobulinu M“. Biochemical Journal. 112 (2): 187–194. doi:10.1042 / bj1120187. PMC 1187691. PMID 4979347.
- ^ Milstein, C.P .; et al. (1975). "Interchain disulfidové můstky myšího imunoglobulinu M". Biochemical Journal. 151 (3): 615–624. doi:10.1042 / bj1510615. PMC 1172409. PMID 766753.
- ^ Halpern, M. S .; Koshland, M. E. (1970). "Nová podjednotka sekreční IgA". Příroda. 228 (5278): 1276–1278. Bibcode:1970Natur.228.1276H. doi:10.1038 / 2281276a0. PMID 5530654.
- ^ Mestecky, J .; Zikin, J .; Butler, W. T. (1971). "Imunoglobulin M sekreční imunoglobulin A: přítomnost běžného polypeptidového řetězce odlišného od lehkých řetězců". Věda. 171 (3976): 1163–1165. Bibcode:1971Sci ... 171.1163M. doi:10.1126 / science.171.3976.1163. PMID 5544873.
- ^ Frutiger, S .; et al. (1992). "Přiřazení disulfidové vazby v lidském řetězci J a jeho kovalentní párování s imunoglobulinem M". Biochemie. 31 (50): 12643–12647. doi:10.1021 / bi00165a014. PMID 1472500.
- ^ Johansen, F. E .; Braathen, R .; Brandtzaeg, P. (2000). "Role řetězce J při tvorbě sekrečního imunoglobulinu". Skandinávský žurnál imunologie. 52 (3): 240–8. doi:10.1046 / j.1365-3083.2000.00790.x. PMID 10972899.
- ^ Sørensen, V .; et al. (2000). "Strukturální požadavky na začlenění řetězce J do lidského IgM a IgA". Mezinárodní imunologie. 12 (1): 19–27. doi:10.1093 / intimm / 12.1.19. PMID 10607746.
- ^ A b Cattaneo, A .; Neuberger, M. S. (1987). „Polymerní imunoglobulin M je vylučován transfektanty nelymfoidních buněk v nepřítomnosti řetězce J imunoglobulinu“. Časopis EMBO. 6 (9): 2753–2758. doi:10.1002 / j.1460-2075.1987.tb02569.x. PMC 553699. PMID 3119328.
- ^ Fazel, S .; Wiersma, E. J .; Shulman, M. J. (1997). "Souhra řetězce J a disulfidové vazby při sestavování polymerního IgM". Mezinárodní imunologie. 9 (8): 1149–1158. doi:10.1093 / intimm / 9.8.1149. PMID 9263012.
- ^ Parkhouse, R .; Askonas, B. A .; Dourmashkin, R. R. (1970). „Elektronové mikroskopické studie myšího imunoglobulinu M; struktura a rekonstituce po redukci“. Imunologie. 18 (4): 575–584. PMC 1455497. PMID 5421036.
- ^ Schwager, J .; Hadji-Azlmi, I. (1984). "Mitogenem indukovaná diferenciace B-buněk u Xenopus laevis". Diferenciace. 27 (3): 182–188. doi:10.1111 / j.1432-0436.1984.tb01426.x. PMID 6334001.
- ^ Fillatreau, S .; et al. (2013). „Úžasná rozmanitost Ig tříd a repertoárů B buněk u teleostních ryb“. Hranice v imunologii. 4: 1–14. doi:10,3389 / fimmu.2013.00028. PMC 3570791. PMID 23408183.
- ^ Getahun, A .; et al. (1999). "Vliv C-terminální sekvence řetězce μ na polymeraci imunoglobulinu M". Imunologie. 97 (3): 408–413. doi:10.1046 / j.1365-2567.1999.00797.x. PMC 2326861. PMID 10447761.
- ^ Dolder, F. (1971). "Výskyt, izolace a mezireťazcové můstky přírodního 7-S imunoglobulinu M v lidském séru". Biochimica et Biophysica Acta. 236 (3): 675–685. PMID 4997811.
- ^ Eskeland, T .; Christensen, T. B. (1975). „IgM molekuly s nebo bez řetězce J v séru a po čištění, studovány ultracentrifugací, elektroforézou a elektronovou mikroskopií“. Skandinávský žurnál imunologie. 4 (3): 217–228. doi:10.1111 / j.1365-3083.1975.tb02620.x. PMID 807966.
- ^ Davis, A. C .; Roux, K. H .; Shulman, M. J. (1988). "O struktuře polymerního IgM". European Journal of Immunology. 18 (7): 1001–1008. doi:10.1002 / eji.1830180705. PMID 3136022.
- ^ A b Davis, A. C .; et al. (1989). „Intermolekulární disulfidová vazba v IgM: účinky nahrazení cysteinových zbytků v těžkém řetězci µ“. Časopis EMBO. 8 (9): 2519–2526. doi:10.1002 / j.1460-2075.1989.tb08389.x. PMC 401247. PMID 2511005.
- ^ Collins, C .; Tsui, F. W .; Shulman, M. J. (2002). „Diferenciální aktivace komplementu člověka a morčete pentamerním a hexamerním IgM“. European Journal of Immunology. 32 (6): 1802–1810. doi:10.1002 / 1521-4141 (200206) 32: 6 <1802 :: AID-IMMU1802> 3.0.CO; 2-C. PMID 12115664.
- ^ Davis, A. C .; et al. (1989). "Mutace myšího H řetězce, které zabraňují sestavení polymeru". Journal of Immunology. 43 (4): 1352–1357. PMID 2501393.
- ^ Smith, R. I.F .; Coloma, M. J .; Morrison, S.L. (1995). „Přidání mu-koncovky k IgG vede k polymerním protilátkám se zlepšenými efektorovými funkcemi včetně cytolýzy zprostředkované komplementem pomocí IgG4.“ Journal of Immunology. 154 (5): 2226–2236. PMID 7868896.
- ^ Sørensen, V .; et al. (1996). "Účinek sekrečních koncovek IgM a IgA na polymeraci a sekreci IgM a IgG". Journal of Immunology. 156 (8): 2858–2865. PMID 8609405.
- ^ Smith, R .; Morrison, S.L. (1994). „Rekombinantní polymerní IgG: přístup k inženýrství účinnějších protilátek“. Přírodní biotechnologie. 12 (7): 683–688. doi:10.1038 / nbt0794-683. PMID 7764912.
- ^ Wiersma, E. J .; Shulman, M. J. (1995). "Sestavení IgM: role disulfidové vazby a nekovalentní interakce". Journal of Immunology. 154 (10): 5265–5272. PMID 7730630.
- ^ Chapuis, R. M .; Koshland, M. E. (1974). "Mechanismus polymerace IgM". Proc. Natl. Acad. Sci. USA 71 (3): 657–661. Bibcode:1974PNAS ... 71..657C. doi:10.1073 / pnas.71.3.657. PMC 388071. PMID 4207070.
- ^ Mihaesco, C .; Mihaesco, E .; Metzger, H. (1973). "Variabilní obsah J-řetězce v lidském IgM". FEBS Dopisy. 37 (2): 303–306. doi:10.1016/0014-5793(73)80483-1. PMID 4202824.
- ^ Brandtzaeg, P. (1976). "Komplexní tvorba mezi sekreční složkou a lidským imunoglobulinem související s jejich obsahem řetězce J". Skandinávský žurnál imunologie. 5 (4): 411–419. doi:10.1111 / j.1365-3083.1976.tb00295.x. PMID 821140.
- ^ Grubb, A. O. (1978). "Kvantifikace řetězce J v lidských biologických tekutinách jednoduchým imunochemickým postupem". Acta Medica Scandinavica. 204 (1–6): 453–465. doi:10.1111 / j.0954-6820.1978.tb08473.x. PMID 104551.
- ^ Müller, R .; et al. (2013). "Struktury s vysokým rozlišením IgM Fc domén odhalují principy jeho tvorby hexameru". Proc. Natl. Acad. Sci. USA 110 (25): 10183–10188. Bibcode:2013PNAS..11010183M. doi:10.1073 / pnas.1300547110. PMC 3690842. PMID 23733956.
- ^ Johansen, F. E .; Braathen, R .; Brandtzaeg, P. (2000). "Role řetězce J při tvorbě sekrečního imunoglobulinu". Skandinávský žurnál imunologie. 52 (3): 240–8. doi:10.1046 / j.1365-3083.2000.00790.x. PMID 10972899.
- ^ Shima, H .; et al. (2010). "Identifikace TOSO / FAIM3 jako Fc receptoru pro IgM". Int. Immunol. 22 (3): 149–56. doi:10.1093 / intimm / dxp121. PMID 20042454.
- ^ Ouchida, R .; et al. (2012). „Kritická role receptoru IgM Fc při homeostáze IgM, přežití B-buněk a humorálních imunitních reakcích“. Proc. Natl. Acad. Sci. USA 109 (40): E2699–706. Bibcode:2012PNAS..109E2699O. doi:10.1073 / pnas.1210706109. PMC 3479561. PMID 22988094.
- ^ Heyman, B (2013). Regulace humorální imunity zprostředkovaná protilátkami. in Nimmerjahn, F. (ed.) Molekulární a buněčné mechanismy aktivity protilátky: Springer.
- ^ Urbaniak, S. J. & Greiss, M. A. (2000). "RhD hemolytické onemocnění plodu a novorozence". Blood Rev. 14 (1): 33–61. doi:10.1054 / blre.1999.0123. PMID 10805260.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Sörman A, Zhang L, Ding Z, Heyman, B. (2014). „Jak protilátky používají komplement k regulaci protilátkových odpovědí“. Mol. Immunol. 61 (2): 79–88. doi:10.1016 / j.molimm.2014.06.010. PMID 25001046.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ Murphy, K .; Weaver, C. (2016). Janewayova imunobiologie. New York, NY: Garland Science / Taylor and Francis. p. 195. ISBN 9780815345053.
- ^ van Furth, R .; Schuit, H. R .; Hijmans, W. (1965). „Imunologický vývoj lidského plodu“. Journal of Experimental Medicine. 122 (6): 1173–88. doi:10.1084 / jem.122.6.1173. PMC 2138097. PMID 4159036.
- ^ Recenze lékařské fyziologie podle William Francis Ganong
- ^ McAlister, C. C .; et al. (2004). „Ochranná produkce IgM proti dárci po křížové pozitivní transplantaci jater a ledvin“. Transplantace jater. 10 (2): 315–9. doi:10.1002 / lt.20062. PMID 14762873.
- ^ Jayasekera, J. P .; Moseman, E. A .; Carroll, M. C. (2007). „Přírodní protilátka a komplement zprostředkovávají neutralizaci viru chřipky bez předchozí imunity“. Journal of Virology. 81 (7): 3487–94. doi:10.1128 / JVI.02128-06. PMC 1866020. PMID 17202212.
externí odkazy
| Klasifikace |
|---|
- Imunoglobulin + M. v americké národní lékařské knihovně Lékařské předměty (Pletivo)
- Odkaz na nedostatek imunoglobulinu M. z Medscape.com
