Hexamminokobalt (III) chlorid - Hexamminecobalt(III) chloride
 | |
 | |
| Jména | |
|---|---|
| Název IUPAC Hexaamminokobalt (III) chlorid | |
| Ostatní jména Chlorid kobaltnatý, chlorid hexaamminokobaltitý | |
| Identifikátory | |
3D model (JSmol ) | |
| ChemSpider | |
| Informační karta ECHA | 100.030.991 |
| Číslo ES |
|
PubChem CID | |
| UNII | |
Řídicí panel CompTox (EPA) | |
| |
| |
| Vlastnosti | |
| H18N6Cl3Spol | |
| Molární hmotnost | 267,48 g / mol |
| Vzhled | žluté nebo oranžové krystaly |
| Hustota | 1,71 g / cm3, |
| Bod tání | rozkládá se |
| 0,26 M (20 ° C) tribromid: 0,04 M (18 ° C) | |
| Rozpustnost | rozpustný v NH3 |
| Struktura | |
| osmistěn | |
| 0 D | |
| Nebezpečí | |
| Hlavní nebezpečí | jed |
| Piktogramy GHS |  |
| Signální slovo GHS | Varování |
| H315, H319, H335 | |
| P261, P264, P271, P280, P302 + 352, P304 + 340, P305 + 351 + 338, P312, P321, P332 + 313, P337 + 313, P362, P403 + 233, P405, P501 | |
| Související sloučeniny | |
jiný anionty | [Co (NH3)6] Br3 [Co (NH3)6] (OAc)3 |
jiný kationty | [Cr (NH3)6] Cl3 [Ni (NH3)6] Cl2 |
Související sloučeniny | [Co (H2NCH2CH2NH2)3] Cl3 [Co (NH3)5(H2O)] Cl3 |
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |
| Reference Infoboxu | |
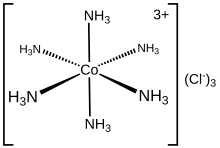
Hexaamminokobalt (III) chlorid je chemická sloučenina vzorce [Co (NH3)6] Cl3. Je to chloridová sůl koordinační komplex [Co (NH3)6]3+, který je považován za archetypální „Wernerův komplex“, pojmenovaný po průkopníkovi koordinační chemie, Alfred Werner. Samotný kation je a komplex kovových aminů se šesti amoniak ligandy připojený k kobalt (III) ion.
Původně soli [Co (NH3)6]3+ byly popsány jako luteo (Latinsky: žlutý) komplex kobaltu. Tento název byl zrušen, protože moderní chemie považuje barvu za méně důležitou než molekulární struktura. Jiné podobné komplexy měly také názvy barev, například purpureo (Latinsky: purple) pro a komplex kobalt-pentammin, a praseo (Řek: zelená) a violeo (Latinsky: violet) pro dva izomerní tetramminové komplexy.[1]
Vlastnosti a struktura
[Co (NH3)6]3+ je diamagnetický, s a nízké otáčky 3d6 osmistěn Co (III) střed. Kation se řídí 18-elektronové pravidlo a je považován za klasický příklad komplexu výměnného inertního kovu. Jako projev své inertnosti [Co (NH3)6] Cl3 lze rekrystalizovat beze změny z koncentrované kyselina chlorovodíková: NH3 je tak pevně svázán s centry Co (III), že se neoddělí, aby umožnil jeho protonaci. Naproti tomu labilní komplexy kovových aminů, jako je [Ni (NH3)6] Cl2, rychle reagují s kyselinami, což odráží labilita Ni (II) –NH3 vazby. Po zahřátí začne hexamminokobalt (III) ztrácet část svých aminových ligandů a nakonec produkuje silnější oxidant.
Chloridové ionty v [Co (NH3)6] Cl3 lze vyměnit s řadou dalších anionty jako dusičnan, bromid, jodid, sulfamát čímž se získá odpovídající [Co (NH3)6]X3 derivát. Takové soli jsou oranžové nebo jasně žluté a vykazují různé stupně rozpustnosti ve vodě. Chloridový ion lze také vyměnit za složitější anionty, jako je hexathiokyanatochromát (III), čímž se získá růžová sloučenina vzorce [Co (NH)3)6] [Cr (SCN)6], nebo ferricyanide ion.
Příprava
[Co (NH3)6] Cl3 se připravuje zpracováním chlorid kobaltnatý s amoniak a chlorid amonný následuje oxidace. Oxidanty zahrnují peroxid vodíku nebo kyslík v přítomnosti uhlíkového katalyzátoru.[2] Zdá se, že tuto sůl poprvé ohlásil Fremy.[3]
Acetátová sůl může být připravena aerobní oxidací octan kobaltnatý, octan amonný a amoniak v methanolu.[4] Acetátová sůl je vysoce rozpustná ve vodě na hladinu 1,9 M (20 ° C), oproti 0,26 M pro trichlorid.
Použití
[Co (NH3)6]3+ je součástí některých strukturní biologie metody (zejména pro DNA nebo RNA, kde kladné ionty stabilizují terciární strukturu fosfátové kostry), aby pomohly vyřešit jejich struktury pomocí Rentgenová krystalografie[5] nebo nukleární magnetická rezonance.[6] V biologickém systému by protiionty pravděpodobně byly Mg2+, ale těžké atomy kobaltu (nebo někdy iridium, jako v PDB: 2GIS) Poskytnout anomální rozptyl vyřešit fázový problém a vytvořit mapu elektronové hustoty struktury.[7]
[Co (NH3)6]3+ je neobvyklý příklad ve vodě rozpustného komplexu trojmocného kovu a je užitečný pro aplikace chránící náboj, jako je stabilizace vysoce negativně nabitých komplexů, jako jsou interakce s a mezi nukleové kyseliny.
Reference
- ^ Huheey, James E. (1983). Anorganická chemie (3. vyd.). p. 360.
- ^ Bjerrum, J .; McReynolds, J. P. (1946). Soli hexamminokobaltu (III). Inorg. Synth. Anorganické syntézy. 2. 216–221. doi:10.1002 / 9780470132333.ch69. ISBN 9780470132333.
- ^ Fremy, M. E. (1852). „Recherches sur le cobalt“. Ann. Chim. Phys. 35: 257–312.
- ^ Lindholm, R. D .; Bause, Daniel E. (1978). Komplexy kobaltu obsahující amoniak nebo ethylen diamin: soli hexaamminokobaltu (III). Inorg. Synth. Anorganické syntézy. 18. str. 67–69. doi:10.1002 / 9780470132494.ch14. ISBN 9780470132494.
- ^ Ramakrishnan, B .; Sekharudu, C .; Pan, B .; Sundaralingam, M. (2003). „Krystalová struktura s téměř atomovým rozlišením A-DNA dekameru d (CCCGATCGGG): interakce kobalt hexamminu s A-DNA“. Acta Crystallogr. D59 (Pt 1): 67–72. doi:10.1107 / s0907444902018917. PMID 12499541.
- ^ Rudisser, S .; Tinoco, I., Jr. (2000). „Struktura roztoku hexamminu kobaltu (III) komplexovaného s tetraloopem GAAA a vazba kov-ionty na nesoulady G.A“. J. Mol. Biol. 295 (5): 1211–1232. doi:10.1006 / jmbi.1999.3421. PMID 10653698.
- ^ McPherson, Alexander (2002). Úvod do makromolekulární krystalografie. John Wiley & Sons. ISBN 0-471-25122-4.
