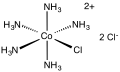
Chlorpentamminokobalt chlorid - Chloropentamminecobalt chloride
| |||
| Jména | |||
|---|---|---|---|
| Název IUPAC Chlorid pentaamminechlorokobaltitý | |||
| Ostatní jména Chlorid pentaamminechlorokobaltitý | |||
| Identifikátory | |||
3D model (JSmol ) | |||
| ChemSpider | |||
| Informační karta ECHA | 100.034.163 | ||
| Číslo ES |
| ||
PubChem CID | |||
| |||
| Vlastnosti | |||
| [Co (NH3)5Cl] Cl2 | |||
| Molární hmotnost | 250,4 g / mol | ||
| Vzhled | červenofialový krystal ve tvaru kosočtverce | ||
| Hustota | 1,783 g / ml | ||
| Bod varu | N / A | ||
| 0,4 g / 100 ml | |||
| Tlak páry | 5990 mm Hg | ||
| Termochemie | |||
Std entalpie of formace (ΔFH⦵298) | −1,0376E + 06 Jmol−1; Molární Gibbsova energie formace = −606480 J / mol | ||
Pokud není uvedeno jinak, jsou uvedeny údaje o materiálech v nich standardní stav (při 25 ° C [77 ° F], 100 kPa). | |||
| Reference Infoboxu | |||
Chlorpentamminokobalt chlorid je dichloridová sůl koordinační komplex [Co (NH3)5Cl]2+. Je to červenofialová, diamagnetická, ve vodě rozpustná sůl. Sloučenina byla akademického a historického zájmu.
Syntéza a reakce
Sůl se připravuje dvoustupňovým procesem počínaje oxidací roztoku chloridu kobaltnatého a amoniaku.[1][2]
- 2 CoCl2· 6H2O + 10 NH3 + 2 HCl + H2Ó2 → 2 [Co (NH3)5(ACH2)] Cl3 + 12 hodin2Ó
Tento meziprodukt se poté zahřeje, aby se navodila koordinace jednoho z chloridových ligandů vnější koule:
- [Co (NH3)5(ACH2)] Cl3 → [Co (NH3)5Cl] Cl2 + H2Ó
Označení [Co (NH3)5Cl]2+ idealizoval C.4v symetrie.[3][4]
Ve vodném roztoku chlorid chloropentaaminu a kobaltu (III) reformuje komplex aquopentamminu. S koncentrovaným kyselina sírová chlorid chloropentaamminokobaltnatý tvoří komplex hydrogensíranu [Co (NH3)5OSO3H]2+.
Dějiny
Komplexy kobaltu mají dlouhodobý zájem o anorganickou chemii, protože jsou četné, snadno připravitelné a barevné. Částečně to bylo na základě jeho studia chemie koordinace kobaltu Alfred Werner byl oceněn Nobelova cena za chemii. Před Wernerem modely aminových komplexů předpokládaly řetězce center pětimocného dusíku. Tento Jørgensen –Bloomstrandův model byl svržen Wernerem, který představil myšlenku, že koordinační komplexy obsahují atomy kovů oktaedrických a čtyřboká, s amoniakem a dalšími ligandy připojenými jednotlivě ke kovu. Wernerův model vysvětlil, že ligandy vnitřní koule jsou méně reaktivní.[5] V [Co (NH3)5Cl] Cl2, dva chloridové ionty jsou vnější koule (protiionty) a jeden je vázán na centrum Co (III): reakce s přebytkem dusičnanu stříbrného by okamžitě vysrážela dva chloridové protiionty, ale vázaný chloridový iont by se nevysrážel.
Viz také
Reference
- ^ Gert G. Schlessinger (1967). „Chlorpentaamminokobalt (III) chlorid“. Anorganické syntézy. 9: 160. doi:10.1002 / 9780470132401.ch43.
- ^ Williams, Gregory M; Olmsted, John, III; Preksa, Andrew P., III (1989). "Koordinační komplexy kobaltu: anorganická syntéza v laboratoři obecné chemie". Journal of Chemical Education. 66: 1043–5. doi:10.1021 / ed066p1043.CS1 maint: více jmen: seznam autorů (odkaz)
- ^ G. G. Messmer; E. L. Amma (1968). „Nové určení krystalové struktury chlorpentaamminokobaltnatého dichloridu“. Acta Crystallogr. B. 24: 417–422. doi:10.1107 / S0567740868002475.
- ^ Hambley, Trevor W .; Lay, Peter A. (1986). „Srovnání π-vazby a vodíkové vazby v izomorfních sloučeninách: [M (NH3)5Cl] Cl2 (M = Cr, Co, Rh, Ir, Ru, Os) ". Anorganická chemie. 25: 4553–8. doi:10.1021 / ic00245a020.
- ^ Schwab, E. (8. září 2003). "Kobalt". Chemické a technické novinky. 81 (36): 80. doi:10.1021 / cen-v081n036.p080.