Glykogenin-1 - Glycogenin-1 - Wikipedia
Glykogenin-1 je enzym který se podílí na biosyntéze glykogen. Je schopen samo-glukosylace, tvořící oligosacharid primer, který slouží jako substrát pro glykogensyntázu. To se děje prostřednictvím mechanismu mezi podjednotkami. Hraje také roli v regulaci metabolismu glykogenu. Rekombinantní lidský glykogenin-1 byl exprimován v E-coli a čistí se použitím konvenčních chromatografie techniky.[5]
Metabolismus glykogenu
Glykogen je vícevětvový polysacharid. Je to primární prostředek glukóza skladování v živočišných buňkách. V lidském těle jsou dvěma hlavními tkáněmi, které ukládají glykogen, játra a kosterní svalstvo.[6] Glykogen je obvykle více koncentrován v játrech, ale protože lidé mají mnohem více svalové hmoty, naše svaly ukládají asi tři čtvrtiny celkového glykogenu v našem těle.
Umístění glykogenu
Funkce jaterního glykogenu je udržovat homeostázu glukózy a generovat glukózu prostřednictvím glykogenolýza kompenzovat pokles hladiny glukózy, ke kterému může dojít mezi jídly. Díky přítomnosti glukóza-6-fosfatáza enzym, hepatocyty jsou schopné přeměnit glykogen na glukózu a uvolnit jej do krve, aby tomu zabránily hypoglykémie.
V kosterním svalu se glykogen používá jako zdroj energie pro svalovou kontrakci během cvičení. Díky různým funkcím glykogenu ve svalu nebo játrech se regulační mechanismy jeho metabolismu liší v každé tkáni.[7] Tyto mechanismy jsou založeny hlavně na rozdílech ve struktuře a na regulaci enzymů, které katalyzují syntézu, glykogen syntáza (GS) a degradace, glykogen fosforyláza (GF).
Syntéza glykogenu
Glykogenin je iniciátor biosyntézy glykogenu.[8][9] Tento protein je glykosyltransferáza, která má schopnost autoglykosilace pomocí UDP-glukózy,[10] který pomáhá v růstu sám, dokud nevytvoří oligosacharid vyrobený 8 glukosami. Glykogenin je oligomer a je schopen interakce s několika proteiny. V posledních letech byla identifikována rodina proteinů, GNIP (protein interagující s glykogeninem), který interaguje s glykogeninem a stimuluje jeho autoglykolitační aktivitu.
Glykogenin-1
U lidí dva izoformy glykogeninu lze vyjádřit: glykogenin-1 s molekulovou hmotností 37 kDa a kodifikováno genem GYG1, který je exprimován většinou ve svalech; a glykogenin-2, s molekulovou hmotností 66 kDa a kodifikovaný genem GYG2, který je exprimován hlavně v játrech, srdečním svalu a jiných typech tkání, ale ne v kosterním svalu.[11]Glykogenin-1 byl popsán analýzou glykogenu kosterního svalu. Bylo zjištěno, že tuto molekulu spojilo a kovalentní vazba ke každé zralé molekule svalového glykogenu.[12]
Gen
Struktura
Gen glykogeninu-1, který se rozprostírá přes 13 kb, se skládá ze sedmi exony a šest introny. Je to proximální promotér obsahuje a TATA box, a cyklický AMP responzivní prvek a dvě domnělá vazebná místa Sp1 v a CpG ostrov, oblast DNA s vysokou frekvencí CpG stránky. Je jich také devět E-boxy které váží základní šroubovice-smyčka-šroubovice svalových specifických transkripčních faktorů.[13]
Místo a přepis
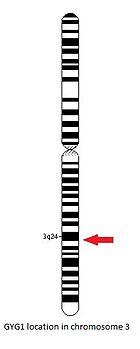
Gen GYG1 se nachází na dlouhém rameni chromozom 3, mezi pozicemi 24 a 25, ze základního páru 148 709 194 na základní pár 148 745 455.[14]
Transkripce lidského glykogeninu-1 se zahajuje hlavně při 80bp a 86bp před translatorem kodon začátek. Faktory transkripce mají pro svůj vývoj různá vazebná místa, některými příklady jsou: GATA, aktivátorový protein 1 a 2 (AP-1 a AP-2) a řada potenciálních vazebných míst pro oktamer-1.[15]
Nedostatek
Nedostatek glykogeninu-1 vede k Nemoc skladování glykogenu typ XV.
Mutace
Nedostatek glykogeninu-1 je detekován v sekvenci genu pro glykogenin-1, GYG1, který odhalil nesmyslnou mutaci v jednom alela a a missense mutace, Thr83Met, ve druhé. Missense mutace vedla k inaktivaci autoglykosylace glykogeninu-1, která je nezbytná pro aktivaci syntézy glykogenu ve svalu. Autoglykosylace glykogeninu-1 probíhá na Tyr195 vazbou gulosa-1-O-tyrosin. Indukovaná missense mutace tohoto zbytku vede k inaktivované autoglykosylaci. Bylo však také prokázáno, že missense mutace ovlivňující některé další zbytky glykogeninu-1 eliminuje autoglykosilaci.
Důsledky
Fenotypové rysy kosterního svalu u pacienta s touto poruchou jsou vyčerpání svalového glykogenu, mitochondriální proliferace a výrazná převaha pomalých oxidačních svalových vláken. Mutace v genu pro glykogenin-1 GYG1 jsou také příčinou kardiomyopatie a arytmie.[11]
Viz také
Reference
- ^ A b C GRCh38: Vydání souboru 89: ENSG00000163754 - Ensembl, Květen 2017
- ^ A b C GRCm38: Vydání souboru 89: ENSMUSG00000019528 - Ensembl, Květen 2017
- ^ „Human PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ „Myš PubMed Reference:“. Národní centrum pro biotechnologické informace, Americká národní lékařská knihovna.
- ^ Podrobnosti o glykogeninu-1, 1-333 aa, rekombinantní protein. [1].
- ^ Alonso MD, Lomako J, Lomako WM, Whelan WJ (červen 1995). „Katalytické aktivity glykogeninu navíc k autokatalytické auto-glukosylaci“. The Journal of Biological Chemistry. 270 (25): 15315–9. doi:10.1074 / jbc.270.25.15315. PMID 7797519.
- ^ Newsholme EA a Start C. (1973). V regulaci v metabolismu J. Wiley a synové. eds. Londýn Kapitola 3.
- ^ Lomako J, Lomako WM, Whelan WJ (prosinec 1988). „Self-glukosylační protein je základem pro biosyntézu glykogenu králičího svalu“. FASEB Journal. 2 (15): 3097–103. doi:10.1096 / fasebj.2.15.2973423. PMID 2973423. S2CID 24083688.
- ^ Viskupic E, Cao Y, Zhang W, Cheng C, DePaoli-Roach AA, Roach PJ (prosinec 1992). "Králičí kosterní sval glykogenin. Molekulární klonování a produkce plně funkčního proteinu v Escherichia coli". The Journal of Biological Chemistry. 267 (36): 25759–63. PMID 1281472.
- ^ Skurat AV, Roach PJ (leden 1996). „Několik mechanismů pro fosforylaci C-koncových regulačních míst v glykogensyntáze králičího svalu exprimovaných v buňkách COS“. The Biochemical Journal. 313 (Pt 1) (Pt 1): 45–50. doi:10.1042 / bj3130045. PMC 1216907. PMID 8546708.
- ^ A b Moslemi AR, Lindberg C, Nilsson J, Tajsharghi H, Andersson B, Oldfors A (duben 2010). „Nedostatek glykogeninu-1 a inaktivovaná aktivace syntézy glykogenu“. The New England Journal of Medicine. 362 (13): 1203–10. doi:10.1056 / NEJMoa0900661. PMID 20357282.
- ^ Zhai L, Dietrich A, Skurat AV, Roach PJ (leden 2004). „Strukturně-funkční analýza GNIP, proteinu interagujícího s glykogeniny“. Archivy biochemie a biofyziky. 421 (2): 236–42. doi:10.1016 / j.abb.2003.11.017. PMID 14984203.
- ^ van Maanen MH, Fournier PA, Palmer TN, Abraham LJ (červenec 1999). "Charakterizace lidského genu pro glykogenin-1: identifikace svalové specifické regulační domény". Gen. 234 (2): 217–26. doi:10.1016 / s0378-1119 (99) 00211-5. PMID 10395894.
- ^ „Kde se nachází gen GYG1?“ [2].
- ^ van Maanen M, Fournier PA, Palmer TN, Abraham LJ (říjen 1999). "Charakterizace myšího glykogeninu-1 cDNA a promotorové oblasti". Biochimica et Biophysica Acta (BBA) - genová struktura a exprese. 1447 (2–3): 284–90. doi:10.1016 / s0167-4781 (99) 00159-1. PMID 10542328.
externí odkazy
- van Maanen M, Fournier PA, Palmer TN, Abraham LJ (říjen 1999). "Charakterizace myšího glykogeninu-1 cDNA a promotorové oblasti". Biochimica et Biophysica Acta (BBA) - genová struktura a exprese. 1447 (2–3): 284–90. doi:10.1016 / s0167-4781 (99) 00159-1. PMID 10542328.
- van Maanen MH, Fournier PA, Palmer TN, Abraham LJ (červenec 1999). "Charakterizace lidského genu pro glykogenin-1: identifikace svalové specifické regulační domény". Gen. 234 (2): 217–26. doi:10.1016 / s0378-1119 (99) 00211-5. PMID 10395894.




