Glia limitans - Glia limitans
| Gliální omezující membrána | |
|---|---|
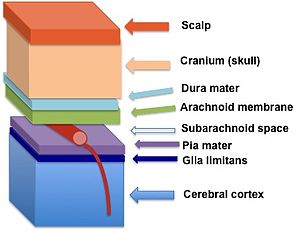 Glia limitans (tmavě modrá) leží mezi pia mater a mozková kůra | |
| Detaily | |
| Díly | Astrocyty, Bazální lamina |
| Identifikátory | |
| latinský | Glia limitans |
| NeuroLex ID | nlx_subcell_100209 |
| Anatomické pojmy neuroanatomie | |
The glia limitans, nebo gliální omezující membrána, je tenká bariéra z astrocyty procesy nohou spojené s parenchymální bazální lamina obklopující mozek a mícha. Je to nejvzdálenější vrstva nervová tkáň Mezi její odpovědnosti patří prevence nadměrné migrace neurony a neuroglia, podpůrné buňky nervového systému, do mozkové pleny. Glia limitans také hraje důležitou roli při regulaci pohybu malých molekul a buněk do mozkový parenchym spoluprací s ostatními složkami EU centrální nervový systém (CNS) tak jako hematoencefalická bariéra (BBB).[1]
Umístění a struktura
Perivaskulární chodidla astrocytů tvoří úzkou souvislost s bazální laminou mozkový parenchym[2] vytvořit glia limitans. Tato membrána leží hluboko k pia mater a dílčí prostor a obklopuje perivaskulární prostory (Virchow-Robinovy prostory). Jakákoli látka vstupující do centrální nervové soustavy z krve nebo mozkomíšní mok (CSF) musí překročit limit glia.
Dvě různé klasifikace gliové omezující membrány, glia limitans perivascularis a glia limitans superficialis, mají téměř identické struktury, lze je však od sebe odlišit umístěním v mozku. Glia limitans perivascularis přiléhá k perivaskulárnímu prostoru obklopujícímu parenchymální cévy a funguje jako podpůrná složka hematoencefalické bariéry. Naproti tomu neparenchymální krevní cévy přítomné v subarachnoidální prostor nejsou pokryty limitem glia. Místo toho je celý subarachnoidální prostor utěsněn směrem k nervové tkáni glia limitans superficialis.[3] Tyto dvě části glia limitans jsou spojité; konvence však diktuje, že část, která pokrývá povrch mozku, se označuje jako superficialis a část, která obklopuje krevní cévy v mozku, se nazývá perivascularis.
Funkce
Fyzická bariéra

Hlavní rolí glia limitans je působit jako fyzická bariéra proti nežádoucím buňkám nebo molekulám, které se pokoušejí vstoupit do CNS. Glia limitans rozděluje mozek na izolaci parenchymu od cévních a subarachnoidálních oddílů.[4] V mozku je gliová omezující membrána důležitou složkou hematoencefalické bariéry. Pokusy s použitím markerů hustoty elektronů zjistily, že funkčními složkami hematoencefalické bariéry jsou endoteliální buňky které tvoří samotné plavidlo. Tyto endotelové buňky obsahují vysoce nepropustné těsné spojení které způsobují, že cévy mozku nevykazují žádnou „netěsnost“ nalezenou v tepny a žíly jinde v těle.[5] Prostřednictvím obou in vivo a in vitro experimenty ukázaly, že procesy astrocytické nohy u glia limitans indukují tvorbu těsných spojů endotelových buněk během vývoje mozku.[6] Pokus in vivo zahrnoval sklizené krysí astrocyty, které byly umístěny do přední komory kuřatého oka nebo na choriolantois. Propustné krevní cévy z obou duhovka nebo chorioallantois se stal nepropustným pro modrý albumin, jakmile vstoupili do transplantovaného bolusu astrocytů. V experimentu in vitro byly endoteliální buňky nejprve kultivovány samostatně a těsné spojení byly pozorovány v replikách zmrazených zlomenin jako diskontinuální a prošpikované mezery. Poté byly mozkové endoteliální buňky kultivovány s astroctyty, což vedlo ke zvýšení těsných spojení a snížené frekvenci mezerových spojení.
Glia limitans také působí jako druhá obranná linie proti všemu, co prochází hematoencefalickou bariérou. Protože jsou však astrocyty obklopující cévy spojeny mezery, není považována za součást BBB a materiál může snadno procházet mezi procesy chodidla.
Imunologická bariéra
Astrocyty glia limitans jsou zodpovědné za oddělení mozku do dvou primárních oddílů. První kompartment je imunitní privilegovaný mozek a mícha parenchyma. Toto oddělení obsahuje několik imunosupresivních buněčných povrchových proteinů, jako jsou CD200 a CD95L, a umožňuje uvolňování protizánětlivých faktorů. Druhým kompartmentem je subarachnoidální, subpialální a perivaskulární prostor, který nemá imunitu. Tato oblast je plná prozánětlivých faktorů, jako je protilátky, doplňují proteiny, cytokiny, a chemokiny. Astrocyty glia limitans jsou považovány za složku mozku, která vylučuje pro- a protizánětlivý faktory.[1]
Rozvoj
Vývoj buněčných procesů dlouhých astrocytů, které jsou nedílnou součástí struktury glia limitans, byl spojen s přítomností meningeálních buněk v pia mater.[7] Meningeální buňky jsou specializované fibroblasty -jako buňky, které obklopují CNS a hlavní krevní cévy. Bylo zjištěno, že spolupracují s astrocyty při počáteční tvorbě glia limitans během vývoje a podílejí se na jeho další údržbě po celý život. Bylo zjištěno, že uměle vyvolaná destrukce meningeálních buněk během vývoje CNS vede ke změně subpiální extracelulární matrix a narušení glia limitans.[8]
Glia limitans se také ukázal jako důležitý při obnově CNS po úrazech. Když jsou na povrchu mozku vytvořeny léze, meningeální buňky se rozdělí a migrují do léze, případně lemující celou dutinu poranění. Pokud zranění významně snížilo hustotu astrocytů a vytvořilo prostor v tkáni, meningeální buňky napadnou ještě více rozptýleně. Když se invazní meningeální buňky dostanou do kontaktu s astrocyty, mohou vyvolat tvorbu nového funkčního glia limitans. Nové glia limitans vytvořené po poranění CNS se obvykle představují jako bariéra regenerujících axonů.[9]
Klinický význam
Existuje celá řada onemocnění spojených s problémy nebo abnormalitami glia limitans. Mnoho nemocí může vzniknout při porušení glia limitans, při kterém již nebude moci plnit svou funkční roli bariéry. Níže jsou popsána dvě nejčastější onemocnění vyplývající z porušení glia limitans.
Vrozená svalová dystrofie typu Fukuyama (FCMD)
Byly spojeny přestupky v komplexu glia limitans-bazální lamina Vrozená svalová dystrofie typu Fukuyama (FCMD), o kterém se předpokládá, že je výsledkem mikropolygyri nebo malé výčnělky nervové tkáně.[10] Ačkoli základní mechanismus vzniku těchto porušení je do značné míry neznámý, nedávný výzkum ukázal, že tento protein fukutin je přímo spojen s vyvíjejícími se lézemi. Mutace ve fukutinovém proteinu vedou k depresivní úrovni jeho exprese v mozku a míše novorozeneckých subjektů, o čemž se zjistilo, že přispívá k oslabení strukturní integrity glia limitans. Neuronální a gliové buňky migrují oslabenou bariérou, což vede k akumulaci nervové tkáně v subarachnoidálním prostoru. Tato abnormální migrace, známá jako kortikální dysplázie, je považována za jednu z hlavních příčin FCMD.[11]
Experimentální autoimunitní encefalomyelitida (EAE)
Bylo prokázáno, že klinické příznaky experimentální autoimunitní encefalomyelitida (EAE) jsou patrné až po proniknutí zánětlivých buněk přes glia limitans a po vstupu do parenchymu CNS. Aktivita matice metaloproteinázy, konkrétně MMP-2 a MMP-9, jsou vyžadovány pro penetraci glia limitans zánětlivými buňkami. To je pravděpodobně způsobeno biochemií parenchymální bazální membrány a procesy astrocytové nohy. MMP-2 a MMP-9 jsou vyráběny společností myeloidní buňky, které obklopují T buňky v perivaskulárním prostoru. Tyto metaloproteinázy umožňují imunitním buňkám porušit glia limitans a dosáhnout parenchymu CNS za účelem napadení parenchymálních buněk CNS. Jakmile imunitní buňky dosáhnou parenchymu CNS a probíhá imunitní útok, jsou parenchymální buňky CNS obětovány za účelem boje s infekcí. Autoimunitní reakce na EAE vede k chronickému záchvatu oligodendrocyty a neurony, které propagují demyelinizace a axonální ztráta. To může nakonec vést ke ztrátě neuronů CNS.[3]
Srovnávací anatomie
Vzhledem k tomu, že glia limitans slouží tak důležité strukturální a fyziologické funkci u lidí, není překvapením, že u mnoha jiných zvířat lze nalézt evoluční prekurzory gliové omezující membrány.
Hmyz mít otevřený oběhový systém, takže se v nich nenacházejí žádné krevní cévy ganglia. Mají však plášť perineuriální gliové buňky který obklopuje nervový systém a vykazuje stejné těsné okluzivní křižovatky, které jsou indukovány glia limitans u lidí. Tyto buňky fungují jako bariéra a jsou odpovědné za stanovení gradientů propustnosti.
V některých měkkýši, je pozorována gliálně-intersticiální tekutinová bariéra bez přítomnosti těsných spojů. Hlavonožce zejména měkkýši mají mozková ganglia, která mají mikrocirkulace, často viděný ve složení vyšších organismů. Gliální buňky často vytvoří plynulé pouzdro zcela kolem krevního prostoru. Bariéra se skládá z zonulární mezibuněčné spoje, spíše než těsná spojení, s rozštěpy tvořenými extracelulárními fibrily. Kromě ochrany z krve se předpokládá, že tyto bariéry vykazují lokální kontrolu nad mikroprostředím kolem specifických neuronových skupin, což je funkce vyžadovaná pro komplexní nervový systém.[6]
Bylo zjištěno, že opice a další primáti mají gliální omezující membránu extrémně podobnou lidem. Studie na těchto zvířatech odhalily, že tloušťka glia limitans se nejen velmi liší u různých druhů, ale také v různých oblastech centrální nervové soustavy stejného organismu. Další pozorování mladých i starých opice prokázali, že mladší jedinci mají tenčí membrány s méně vrstvami astrocytárních procesů, zatímco starší opice mají mnohem silnější membrány.[12]
Aktuální výzkum
Od roku 2011 se výzkum zaměřuje na obousměrnou komunikaci mezi neurony a gliovými buňkami. Komunikace mezi těmito dvěma typy buněk umožňuje axonální vedení, synaptický přenos i zpracování informací k regulaci a lepší kontrole procesů centrálního nervového systému. Mezi různé formy komunikace patří neurotransmise, iontové toky a signální molekuly. Ještě v roce 2002 publikovali R. Douglas Fields a Beth Stevens-Graham nové informace o procesu komunikace neuron-glia. K objasnění toho použili pokročilé zobrazovací metody iontové kanály vidět v gliových buňkách nepřispěl akční potenciály ale spíše umožnil glii určit úroveň neuronální aktivity v blízkosti. Bylo zjištěno, že gliální buňky vzájemně komunikují pouze chemickými signály a dokonce mají specializované signalizační systémy gliální-gliální a neuron-gliální neurotransmiter. Dále bylo zjištěno, že neurony uvolňují chemické posly v extrasynaptických oblastech, což naznačuje, že neuron-gliový vztah zahrnuje funkce mimo synaptický přenos. Bylo známo, že Glia pomáhá synapse formování, regulace síly synapsí a zpracování informací, jak je uvedeno výše. Proces pro adenosintrifosfát (ATP), glutamát Uvolňování dalších chemických poslů z glia je diskutováno a je považováno za směr pro budoucí výzkum.[13]
Reference
- ^ A b Helmut Kettenmann; Bruce R. Ransom (2005). Neuroglia. Oxford University Press USA. 303–305. ISBN 978-0-19-515222-7. Citováno 20. března 2011.
- ^ Saladin, Kenneth S. (2011). Anatomie člověka. str. 358. ISBN 9780071222075.
- ^ A b Engelhardt B, Coisne C (2011). „Tekutiny a bariéry CNS vytvářejí imunitní privilegium tím, že omezují imunitní dohled na dvouplášťový hradní příkop obklopující hrad CNS“. Bariéry tekutin CNS. 8 (1): 4. doi:10.1186/2045-8118-8-4. PMC 3039833. PMID 21349152.
- ^ Alekseǐ Nestorovich Verkhratskiǐ; Arthur Butt (2007). Gliová neurobiologie: učebnice. John Wiley and Sons. str. 24. ISBN 978-0-470-01564-3. Citováno 20. března 2011.
- ^ Alan Peters; Sanford L. Palay; Henry deF. Webster (1991). Jemná struktura nervového systému: neurony a jejich podpůrné buňky. Oxford University Press. str. 292–293. ISBN 978-0-19-506571-8. Citováno 25. března 2011.
- ^ A b Brightman, Milton (1991). „Důsledek astroglie v bariéře krev - mozek“. V Abbot, NJ (ed.). Gliálně-neuronální interakce. Newyorská akademie věd. str. 633. ISBN 0-89766-680-1.
- ^ Struckhoff, Gernot (1995). „Cocultures of Meningeal and Astrocytic Cells- A Mode for the Form of the Glial-Limiting Membrane“. Int. J. Devl Neuroscience. 13.6 (6): 595–606. doi:10.1016 / 0736-5748 (95) 00040-N.
- ^ B. Castellano López; Bernardo Castellano; Manuel Nieto-Sampedro (15. září 2003). Funkce gliových buněk. Gulf Professional Publishing. str. 18. ISBN 978-0-444-51486-8. Citováno 25. března 2011.
- ^ Mathias Bähr (2006). Oprava mozku. Gulf Professional Publishing. str. 19. ISBN 978-0-306-47859-8. Citováno 25. března 2011.
- ^ Saito Y, Murayama S, Kawai M, Nakano I (říjen 1999). „Porušený komplex mozkových glia limitans - bazální lamina u vrozené svalové dystrofie typu Fukuyama“. Acta Neuropathol. 98 (4): 330–6. doi:10,1007 / s004010051089. PMID 10502035.
- ^ Nakano, Imaharu; Funahashi, M; Takada, K; Toda, T (1996). „Jsou porušení glia limitans primární příčinou mikropolygyrie u vrozené svalové dystrofie typu Fukuyama (FCMD)? - Patologická studie mozkové kůry plodu FCMD.“ Acta Neuropathologica. 91 (3): 313–321. doi:10,1007 / s004010050431. PMID 8834545.
- ^ Ennio Pannese (1994). Neurocytologie: jemná struktura neuronů, nervové procesy a neurogliální buňky. Thieme. 173–175. ISBN 978-0-86577-456-8. Citováno 25. března 2011.
- ^ Fields, Douglas; Stevens-Graham, B (2002). „Nové poznatky o komunikaci Neuron-Glia“. Věda. 298 (5593): 556–562. Bibcode:2002Sci ... 298..556F. doi:10.1126 / science.298.5593.556. PMC 1226318. PMID 12386325.
