Databáze genových chorob - Gene Disease Database
| Klasifikace | Bioinformatika |
|---|---|
| Subklasifikace | Databáze |
| Typ databází | Biologický |
| Podtyp databází | Genová nemoc |
v bioinformatika, a Databáze genových chorob je systematizovaný sběr dat, obvykle strukturovaný pro modelování aspektů reality, způsobem, jak pochopit základní mechanismy komplexních onemocnění, porozuměním více složeným interakcím mezi fenotyp -genotyp vztahy a mechanismy genových chorob.[1] Databáze genových chorob integrují asociace lidských genových chorob z různých odborně upravených databází a dolování textu odvozené asociace včetně Mendelovských, komplexních a environmentálních chorob.[2][3]
Úvod
Odborníci v různých oblastech biologie a bioinformatika se dlouhodobě snaží pochopit molekulární mechanismy nemocí a navrhnout preventivní a terapeutické strategie. U některých nemocí se ukázalo, že se vytváří správné množství nepřátelství, které nestačí k získání indexu genů souvisejících s onemocněním, ale k odhalení toho, jak narušení molekulárních mřížek v buňce vede k fenotypům onemocnění.[4] Navíc, i přes bezprecedentní množství dostupných informací, je získání takových katalogů extrémně obtížné.
Genetický Obecně řečeno, genetická onemocnění jsou způsobena aberacemi v genech nebo chromozomy. Mnoho genetických chorob se vyvíjí před narozením. Genetické poruchy představují významný počet zdravotních problémů v naší společnosti. Pokrok v porozumění této nemoci zvýšil délku života i kvalitu života mnoha osob postižených genetickými poruchami. Nedávný vývoj v bioinformatice a laboratorní genetice umožnil lepší vymezení určitých syndromů malformace a mentální retardace, aby bylo možné porozumět jejich způsobu dědičnosti. Tato informace umožňuje genetickému poradci předvídat riziko výskytu velkého počtu genetických poruch.[2] Většina genetického poradenství je poskytována až poté, co alespoň jeden postižený jedinec upozornil rodinu na její zálibu mít děti s genetickou poruchou. Asociace jednoho genu k nemoci je vzácná a genetické onemocnění může, ale nemusí, být přenosnou poruchou.[5] Některá genetická onemocnění se dědí z genů rodičů, jiná jsou způsobena novými mutace nebo změny DNA. V jiných případech, stejné nemoci, například některé formy karcinom nebo melanom, může pramenit z inbredního stavu u některých lidí, z nových změn u jiných lidí a z negenetických příčin u ještě dalších jedinců.[6]
Existuje více než šest tisíc známých jednogenových poruch (monogenních), které se vyskytují přibližně u 1 z každých 200 porodů.[1] Jak naznačuje jejich termín, tato onemocnění jsou způsobena mutací v jednom genu. Naproti tomu polygenní poruchy jsou způsobeny několika geny, pravidelně v kombinaci s faktory prostředí.[7] Mezi příklady genetických fenotypů patří Alzheimerova choroba, rakovina prsu, leukémie, Downov syndrom, srdeční vady a hluchota; proto je nutná katalogizace, aby se vyřešily všechny nemoci související s geny.
Výzvy s tvorbou
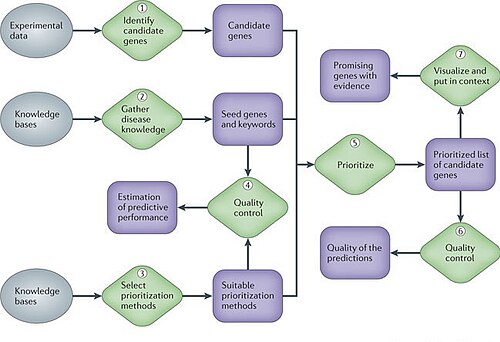
V různých fázích jakéhokoli projektu genového onemocnění molekulární biologové je třeba zvolit, i po pečlivé statistické analýze dat, které geny nebo bílkoviny zkoumat dále experimentálně a které vynechat kvůli omezeným zdrojům. Výpočtové metody, které integrují složité, heterogenní datové soubory, jako jsou data exprese, informace o sekvencích, funkční anotace a biomedicínská literatura, umožňují upřednostňovat geny pro budoucí studium informovanějším způsobem. Takové metody mohou podstatně zvýšit výtěžek navazujících studií a stávají se neocenitelnými pro výzkumníky. Takže jeden z hlavních problémů v biologické a biomedicínské výzkum spočívá v rozpoznání základních mechanismů za těmito složitými genetickými fenotypy. Velké úsilí bylo vynaloženo na nalezení genů souvisejících s chorobami[8]
Stále více důkazů však poukazuje na to, že většinu lidských nemocí nelze připsat jednomu genu, ale vznikají v důsledku složitých interakcí mezi více genetickými variantami a rizikovými faktory prostředí. Bylo vyvinuto několik databází, které uchovávají asociace mezi geny a chorobami, jako je komparativní toxikogenomická databáze (CTD), online Mendelian Inheritance in Man (OMIM), genetická asociační databáze (GAD) nebo genetická asociační databáze nemocí (DisGeNET). Každá z těchto databází se zaměřuje na různé aspekty vztahu fenotyp-genotyp a vzhledem k povaze procesu úpravy databáze nejsou úplné, ale svým způsobem se navzájem plně doplňují.[9]
Druhy databází
V zásadě existují čtyři typy databází: spravované databáze, prediktivní databáze, databáze literatury a integrační databáze[1]
Upravené databáze
Termínem kurátorská data se rozumí informace, které mohou zahrnovat nejsofistikovanější výpočetní formáty pro strukturovaná data, vědecké aktualizace a kurátorské znalosti, které byly sestaveny a připraveny na základě nařízení jednoho nebo více odborníků považovaných za kvalifikované k účasti na aktivita[10] Z toho vyplývá, že výsledná databáze je vysoce kvalitní. Kontrast je v porovnání s daty, která mohla být shromážděna nějakým automatizovaným procesem nebo použitím zvláště nízké nebo neodborné nepodporované kvality dat a možná nedůvěryhodné.[10] Mezi nejběžnější příklady patří: CTD a UNIPROT.
Srovnávací databáze toxikogenomiky (CTD)
The Srovnávací databáze toxikogenomiky, pomáhá porozumět účinkům sloučenin životního prostředí na lidské zdraví integrací dat z odborné vědecké literatury k popisu biochemických interakcí s geny a proteiny a vazeb mezi nemocemi a chemickými látkami a chorobami a geny nebo proteiny.[11] CTD obsahuje kurátorská data definující mezidruhové interakce chemicko-genové / proteinové a chemicko- a genově-chorobné asociace k osvětlení molekulárních mechanismů, které jsou podkladem variabilní citlivosti a chorob ovlivňovaných životním prostředím. Tato data přinášejí pohledy do komplexních sítí pro interakci chemicko-genových a proteinových interakcí. Jedním z hlavních zdrojů v této databázi jsou vybrané informace od OMIM.[11]
CTD je jedinečný zdroj, kde specialisté na bioinformatiku čtou vědeckou literaturu a ručně upravují čtyři typy základních údajů:
- Interakce chemických genů
- Sdružení chemických chorob
- Sdružení genových chorob
- Chemicko-fenotypové asociace
Univerzální zdroj bílkovin (UNIPROT)
Univerzální zdroj bílkovin (UniProt ) je inkluzivní zdroj pro proteinovou sekvenci a data anotací. Jedná se o komplexní, prvotřídní a volně přístupnou databázi proteinových sekvencí a funkčních informací, z nichž je odvozeno mnoho záznamů genom sekvenční projekty. Obsahuje velké množství informací o biologické funkci proteinů odvozených ze studijní literatury, které mohou naznačovat přímou souvislost mezi onemocněním gen-protein.[12]
| Obsah | |
|---|---|
| Popis | UniProt je univerzální protein zdroj, centrální úložiště protein data vytvořená kombinací Swiss-Prot, TrEMBL a PIR-PSD databáze. |
| Typy dat zajat | Anotace proteinu |
| Organismy | Všechno |
| Kontakt | |
| Výzkumné centrum | EMBL-EBI, SPOJENÉ KRÁLOVSTVÍ; SIB, Švýcarsko; PIR, USA. |
| Primární citace | Probíhající a budoucí vývoj v Universal Protein Resource[13] |
| Přístup | |
| Datový formát | Vlastní plochý pilník, FASTA, GFF, RDF, XML. |
| webová stránka | www www |
| Stáhnout URL | www |
| webová služba URL | Ano - JÁVA API viz informace tady & ZBYTEK viz informace tady |
| Nástroje | |
| Web | Pokročilé vyhledávání, VÝBUCH, Clustal O, hromadné načítání / stahování, mapování ID |
| Smíšený | |
| Licence | Creative Commons Attribution-NoDerivs |
| Správa verzí | Ano |
| Uvolnění dat frekvence | 4 týdny |
| Kurátorská politika | Ano - manuální a automatické. Pravidla pro automatickou anotaci generovanou kurátory databáze a výpočetními algoritmy. |
| Bookmarkable subjekty | Ano - jak jednotlivé položky proteinů, tak vyhledávání |

Vybraná data mohou zahrnovat proces od praktických zkušeností a přezkoumání literatury po webové publikování databáze[14]
Prediktivní databáze
Prediktivní databáze je databáze založená na statistických závěrech. Jeden konkrétní přístup k takové inference je známý jako prediktivní inference, ale predikce může být provedena v rámci některého z několika přístupů ke statistickým inferencím. Jeden popis biostatistiky ve skutečnosti spočívá v tom, že poskytuje prostředek k přenosu znalostí o vzorku genetické populace na celou populaci (genomika ) a na další příbuzné geny nebo genomy, které stejně jako predikce v čase nemusí být nutně.[15] Když jsou informace přenášeny v čase, často do konkrétních časových bodů, je proces znám jako prognóza. Tři z hlavních příkladů databází, které lze v této kategorii vzít v úvahu, jsou: Databáze genomu myší (MGD), Databáze genomu krys (RGD), OMIM a nástroj SIFT od společnosti Ensembl.[1]
Databáze genomu myší (MGD)
Databáze myší genomu (MGD) je zdroj mezinárodního společenství pro integrované genetické, genomové a biologické údaje o laboratorní myši. MGD poskytuje úplnou anotaci fenotypů a asociací lidských onemocnění pro myší modely (genotypy) pomocí termínů z fenotypové savčí fenotypie a názvů chorob od OMIM.[16]
Databáze krysích genomů (RGD)
| Obsah | |
|---|---|
| Popis | The Databáze krysích genomů |
| Organismy | Rattus norvegicus (krysa) |
| Kontakt | |
| Výzkumné centrum | Medical College of Wisconsin |
| Laboratoř | Lidské molekulární a genetické centrum |
| Autoři | Mary E. Shimoyama, PhD; Howard J. Jacob, PhD |
| Primární citace | PMID 25355511 |
| Přístup | |
| webová stránka | rgd |
| Stáhnout URL | Zveřejnění dat RGD |
The Databáze krysích genomů (RGD) začalo jako společné úsilí mezi předními výzkumnými institucemi zabývajícími se genetickým a genomickým výzkumem potkanů. Krysa je nadále výzkumníky široce využívána jako modelový organismus pro zkoumání biologie a patofyziologie onemocnění. V posledních několika letech došlo k rychlému nárůstu genetických a genomických údajů o potkanech.[17] Tato exploze informací zdůraznila potřebu centralizované databáze pro efektivní a efektivní shromažďování, správu a distribuci kryptoměnového pohledu na tato data výzkumným pracovníkům z celého světa. Databáze genomů potkanů byla vytvořena, aby sloužila jako úložiště genetických a genomických dat potkanů, jakož i mapování, kmenů a fyziologických informací. Rovněž usnadňuje výzkumné úsilí vyšetřovatelů tím, že poskytuje nástroje pro vyhledávání, těžbu a předpovídání těchto údajů.[17]
Data na RGD, která jsou užitečná pro výzkumníky zkoumající geny chorob, zahrnují anotace chorob pro krysí, myší a lidské geny. Annotations are manually curated from the literature, or downloading via automated pipelines from other disease-related databases. Stažené anotace jsou mapovány do stejného slovníku nemocí, který se používá pro manuální anotace, aby byla zajištěna konzistence v celé datové sadě. RGD také udržuje kvantitativní údaje o fenotypu krysy související s onemocněním (PhenoMiner).[18]
Online Mendelian Inheritance in Man (OMIM )
| Obsah | |
|---|---|
| Popis | OMIM je souhrn lidských genů a genetických fenotypů. |
| Organismy | Člověk (H. Sapiens) |
| Kontakt | |
| Výzkumné centrum | NCBI |
| Primární citace | PMID 25398906 |
| Přístup | |
| webová stránka | www |
Online Mendelian Inheritance in Man (OMIM) je databáze, která katalogizuje všechny známé nemoci s genetickou složkou a předpovídá jejich vztah k relevantním genům v lidském genomu a poskytuje odkazy na další výzkum a nástroje pro genomickou analýzu. katalogizovaného genu.[19] OMIM je komplexní a směrodatný souhrn lidských genů a genetických fenotypů, který je každý den volně dostupný a aktualizovaný. Databáze byla použita jako prostředek pro předpovídání příslušných informací zděděným podmínkám.[19]
Ensembl SIFT nástroj
 | |
|---|---|
| Obsah | |
| Popis | Ensembl |
| Kontakt | |
| Výzkumné centrum | |
| Primární citace | Hubbard, et al. (2002)[20] |
| Přístup | |
| webová stránka | www |
Jedná se o jeden z největších zdrojů dostupných pro všechny genomické a genetické studie a poskytuje centralizovaný zdroj pro genetiky, molekulární biology a další výzkumníky, kteří studují genomy našeho vlastního druhu a dalších obratlovců a modelových chorobných organismů. Ensembl je jedním z několika známých prohlížečů genomu pro získávání informací o genomových onemocněních. Ensembl importuje údaje o variantách z různých zdrojů, Ensembl předpovídá účinky variant.[21] Pro každou variantu, která je mapována na referenční genom, je identifikován každý transkript Ensembl, který tuto variantu překrývá. Potom používá přístup založený na pravidlech k předpovědi účinků, které může mít každá alela variace na přepis. Sada termínů následků definovaných sekvenční ontologií (SO) může být aktuálně přiřazena ke každé kombinaci alely a přepisu. Každá alela každé variace může mít v různých přepisech jiný účinek. K předpovědi lidských mutací v databázi Ensembl se používá celá řada různých nástrojů, jedním z nejpoužívanějších je SIFT, který předpovídá, zda substituce aminokyselin pravděpodobně ovlivní funkci proteinu na základě sekvenční homologie a fyzikálně-chemické podobnosti mezi alternativní aminokyseliny. Data poskytovaná pro každou aminokyselinovou substituci jsou skóre a kvalitativní předpověď (buď „tolerovaná“, nebo „škodlivá“). Skóre je normalizovaná pravděpodobnost, že je změna aminokyseliny tolerována, takže skóre blízko 0 bude pravděpodobně škodlivější. Z tohoto skóre je odvozena kvalitativní předpověď, takže substituce se skóre <0,05 se nazývají „škodlivé“ a všechny ostatní se nazývají „tolerovány“. SIFT lze použít na přirozeně se vyskytující nesynonymní polymorfismy a laboratorně indukované missense mutace, což povede k vytvoření vztahů ve fenotypových charakteristikách, proteomika a genomika.[21]
Databáze literatury
Tento druh databází shrnuje knihy, články, recenze knih, disertační práce a poznámky o databázích genových chorob. Některé z následujících příkladů jsou tohoto typu: GAD, LGHDN a BeFree Data.
Databáze genetické asociace (GAD)
Databáze genetické asociace je archiv studií lidské genetické asociace komplexních nemocí. GAD se primárně zaměřuje na archivaci informací o běžných komplexních lidských onemocněních spíše než o vzácných Mendelianových poruchách, jak jsou uvedeny v OMIM. Zahrnuje souhrnná souhrnná data extrahovaná z publikovaných článků v recenzovaných časopisech o kandidátních genech a studiích genomové asociace (GWAS ).[22] GAD byl zmrazen k 1. 1. 2014, ale je stále k dispozici ke stažení.[23]
Síť lidských genových chorob odvozená z literatury (LHGDN)
Síť lidských genových chorob odvozená z literatury (LHGDN) je databáze odvozená z těžby textu se zaměřením na extrakci a klasifikaci asociací genových chorob s ohledem na několik biomolekulárních podmínek. Využívá algoritmus založený na strojovém učení k extrakci vztahů sémantických genů a chorob z textového zdroje zájmu. Je součástí údajů o propojeném životě LMU v německém Mnichově.[1]
BeFree Data
Extrahuje asociace gen-nemoc z abstraktu MEDLINE pomocí systému BeFree. BeFree se skládá z biomedicínského modulu Named Entity Recognition (BioNER) pro detekci nemocí a genů a modulu extrakce relací na základě morfosyntaktických informací.[24]
Integrační databáze
Tento druh databází zahrnuje Mendelovy choroby, choroby sloučenin a prostředí v archivu integrovaných asociací genových nemocí a ukazuje, že koncept modularity platí pro všechny z nich. Poskytují funkční analýzu chorob v případě důležitých nových biologických poznatků, které nemusí být objeveno při samostatném zvažování každé ze asociací genových chorob. Představují tedy vhodný rámec pro studium toho, jak genetické a environmentální faktory, jako jsou léky, přispívají k nemocem. Nejlepším příkladem pro tento druh databáze je DisGeNET.[8][25]
Databáze asociací genových chorob DisGeNET
| Obsah | |
|---|---|
| Popis | Integruje asociace lidských genových chorob |
| Typy dat zajat | Databáze asociací |
| Organismy | Člověk (H. Sapiens) |
| Kontakt | |
| Výzkumné centrum | Výzkumný program biomedicínské informatiky (GRIB) IMIM-UPF |
| Laboratoř | Integrativní skupina biomedicínské informatiky |
| Autoři | Ferran Sanz a Laura I. Furlong (Pinero et al, 2015) |
| Primární citace | PMID 25877637 |
| Přístup | |
| webová stránka | www |
| Smíšený | |
| Uvolnění dat frekvence | roční |
| Verze | 3 |
DisGeNET je komplexní databáze asociací genových nemocí, která integruje asociace z několika zdrojů pokrývající různé biomedicínské aspekty nemocí.[25] Zaměřuje se zejména na současné znalosti lidských genetických chorob včetně mendelovských, komplexních a environmentálních chorob. Pro posouzení konceptu modularity lidských onemocnění tato databáze provádí systematické studium naléhavých vlastností sítí lidských genových chorob pomocí topologie sítě a analýzy funkčních anotací.[1] Výsledky naznačují vysoce sdílený genetický původ lidských onemocnění a ukazují, že pro většinu nemocí, včetně Mendelovských, komplexních a environmentálních chorob, existují funkční moduly. Kromě toho bylo zjištěno, že základní soubor biologických cest je spojen s většinou lidských onemocnění. Získání podobných výsledků při studiu shluky Z nálezů v této databázi vyplývá, že by mohla nastat související onemocnění v důsledku dysfunkce běžných biologických procesů v buňce. Síťová analýza této integrované databáze poukazuje na to, že pro získání komplexního pohledu na genetickou krajinu lidských chorob je nutná integrace dat a že genetický původ komplexních nemocí je mnohem častější, než se očekávalo.[1]

Popis každého typu asociace v této ontologii je: # Terapeutická asociace: Gen / protein má terapeutickou roli při zmírnění onemocnění. # Sdružení biomarkerů: Gen / protein hraje roli v etiologii onemocnění (účastní se například molekulárního mechanismu, který vede k onemocnění), nebo je biomarkerem onemocnění. # Genetická variace asociace: Používá se, když je variace sekvence (mutace, SNP) spojena s fenotypem nemoci, ale stále neexistují důkazy, které by říkaly, že variace způsobuje onemocnění. V některých případech přítomnost variant zvyšuje náchylnost k onemocnění. Obecně jsou poskytovány identifikátory NCBI SNP. #Altered Expression Association: Změny ve funkci proteinu prostřednictvím změněné exprese genu jsou spojeny s fenotypem nemoci. # Posttranslační modifikační asociace: Změny ve funkci proteinu pomocí posttranslačních modifikací (methylace nebo fosforylace proteinu) jsou spojeny s fenotypem onemocnění. [1]
Některé případy použití
Některé z nejzajímavějších případů využívajících databáze genových nemocí naleznete v následujících dokumentech:[1][8]
- Santiago, Jose A .; Potashkin, Judith A. (2014). "Síťový přístup ke klinické intervenci u neurodegenerativních onemocnění". Trendy v molekulární medicíně. 20 (12): 694–703. doi:10.1016 / j.molmed.2014.10.002. PMID 25455073.
- Kaikkonen, Minna U .; Niskanen, Henri; Romanoski, Casey E .; Kansanen, Emilia; Kivelä, Annukka M .; Laitalainen, Jarkko; Heinz, Sven; Benner, Christopher; Glass, Christopher K .; Ylä-Herttuala, Seppo (2014). „Řízení transkripčních programů VEGF-A pozastavením a genomickou kompartmentací“. Výzkum nukleových kyselin. 42 (20): 12570–12584. doi:10.1093 / nar / gku1036. PMC 4227755. PMID 25352550.
- Grosdidier, Solène; Ferrer, Antoni; Faner, Rosa; Piñero, Janet; Roca, Josep; Cosío, Borja; Agustí, Alvar; Gea, Joaquim; Sanz, Ferran; Furlong, Laura I. (2014). „Analýza síťové medicíny multimorbidit CHOPN“. Respirační výzkum. 15: 111. doi:10.1186 / s12931-014-0111-4. PMC 4177421. PMID 25248857.
- Cristiano, Francesca; Veltri, Pierangelo (2014). „Nástroj založený na R pro analýzu a korelaci dat miRNA s klinickými ontologiemi“. Sborník z 5. konference ACM o bioinformatice, výpočetní biologii a zdravotnické informatice - BCB '14. str. 768–773. doi:10.1145/2649387.2660847. ISBN 9781450328944.
- Gallagher, Suzanne Renick; Dombrower, Micah; Goldberg, Debra S. (2014). "Využití 2-uzlových shlukových koeficientů hypergrafu pro analýzu sítí genů nemocí". Sborník z 5. konference ACM o bioinformatice, výpočetní biologii a zdravotnické informatice - BCB '14. 647–648. doi:10.1145/2649387.2660817. ISBN 9781450328944.
- Mannil, Deepthi; Vogt, Ingo; Prinz, Jeanette; Campillos, Monica (2015). „Heterogenita orgánových systémů DB: databáze pro vizualizaci fenotypů na úrovni orgánových systémů“. Výzkum nukleových kyselin. 43 (Problém s databází): D900 – D906. doi:10.1093 / nar / gku948. PMC 4384019. PMID 25313158.
- Vogt, Ingo; Prinz, Jeanette; Campillos, Mónica (2014). „Molekulárně a klinicky související léky a nemoci jsou obohaceny o fenotypicky podobné páry drog a nemocí“. Genomová medicína. 6 (7). doi:10.1186 / s13073-014-0052-z.
- Santiago, Jose A .; Potashkin, Judith A. (2014). „Systémové přístupy k dekódování molekulárních vazeb u Parkinsonovy choroby a cukrovky“. Neurobiologie nemocí. 72: 84–91. doi:10.1016 / j.nbd.2014.03.019. PMID 24718034.
- Lee, In-Hee; Lee, Kyungjoon; Hsing, Michael; Choe, Yongjoon; Park, Jin-Ho; Kim, Shu Hee; Bohn, Justin M .; Neu, Matthew B .; Hwang, Kyu-Baek; Green, Robert C .; Kohane, Isaac S .; Kong, Sek Won (2014). „Stanovení priorit variant, genů a cest souvisejících s chorobami pomocí interaktivního potrubí pro analýzu celého genomu“. Lidská mutace. 35 (5): 537–547. doi:10,1002 / humu.22520. PMC 4130156. PMID 24478219.
- Liu, Ming-Xi; Chen, Xing; Chen, Geng; Cui, Qing-Hua; Yan, Gui-Ying (2014). „Výpočetní rámec pro odvození dlouhých nekódujících RNA souvisejících s lidskými chorobami“. PLOS One. 9 (1): e84408. Bibcode:2014PLoSO ... 984408L. doi:10.1371 / journal.pone.0084408. PMC 3879311. PMID 24392133.
- Zhao, Yilei; Wang, Chen; Wu, Jianwei; Wang, Yan; Zhu, Wenliang; Zhang, Yong; Du, Zhimin (2013). "Cholin chrání před srdeční hypertrofií vyvolanou zvýšenou zátěží". International Journal of Biological Sciences. 9 (3): 295–302. doi:10,7150 / ijbs.5976. PMC 3596715. PMID 23493786.
- Koczor, Christopher A .; Lee, Eva K .; Torres, Rebecca A .; Boyd, Amy; Vega, J. David; Uppal, Karan; Yuan, Fan; Fields, Earl J .; Samarel, Allen M .; Lewis, William (2013). „Detekce diferenčně methylovaných promotorů genů při selhání a nefunkčním myokardu levé srdeční komory pomocí výpočetní analýzy“. Fyziologická genomika. 45 (14): 597–605. doi:10.1152 / fyziolgenomika 00013.2013. PMC 3727018. PMID 23695888.
- Gu, Ying; Liu, Guang-Hui; Plongthongkum, Nongluk; Benner, Christopher; Yi, Fei; Qu, Jing; Suzuki, Keiichiro; Yang, Jiping; Zhang, Weiqi; Limonáda; Montserrat, Nuria; Crespo, Isaac; Del Sol, Antonio; Esteban, Concepcion Rodriguez; Zhang, Kun; Izpisua Belmonte, Juan Carlos (2014). „Globální methylace DNA a transkripční analýzy lidských kardiomyocytů získaných z ESC“. Protein & Cell. 5: 59–68. doi:10.1007 / s13238-013-0016-x. PMC 3938846. PMID 24474197.
- Galhardo, Mafalda; Sinkkonen, Lasse; Berninger, Philipp; Lin, Jake; Sauter, Thomas; Heinäniemi, Merja (2014). „Integrovaná analýza transkripční regulace metabolismu odhaluje uzly lidské metabolické sítě související s chorobami“. Výzkum nukleových kyselin. 42 (3): 1474–1496. doi:10.1093 / nar / gkt989. PMC 3919568. PMID 24198249.
- Tieri, Paolo; Termanini, Alberto; Bellavista, Elena; Salvioli, Stefano; Capri, Miriam; Franceschi, Claudio (2012). "Mapování NF-κB Pathway Interactome Map". PLOS One. 7 (3): e32678. Bibcode:2012PLoSO ... 732678T. doi:10.1371 / journal.pone.0032678. PMC 3293857. PMID 22403694.
Poznámky k budoucnosti v databázích genových chorob

Dokončení lidského genomu změnilo způsob, jakým se provádí hledání genů onemocnění. V minulosti byl přístup zaměřen na jeden nebo několik genů najednou. Nyní projekty jako DisGeNET ilustrují snahu systematicky analyzovat všechny genové změny spojené s jednou nebo více nemocemi.[26] Dalším krokem je získání úplného obrazu o mechanistických aspektech nemocí a návrhu léků proti nim. K tomu bude zapotřebí kombinace dvou přístupů: systematické vyhledávání a hloubkové studium každého genu. Budoucnost oboru bude definována novými technikami pro integraci velkých souborů dat z různých zdrojů a pro začlenění funkčních informací do analýza rozsáhlých údajů generovaných bioinformatickými studiemi.[1]
Bioinformatika je jak termín pro tělo studií biologických genových onemocnění, které používají počítačové programování jako součást své metodiky, tak i odkaz na specifické analytické kanály, které se opakovaně používají, zejména v oblasti genetiky a genomiky.[1] Mezi běžná použití bioinformatiky patří identifikace kandidátských genů a nukleotidů, SNP. Často se taková identifikace provádí s cílem lépe porozumět genetickému základu nemoci, jedinečným adaptacím, žádoucím vlastnostem nebo rozdílům mezi populacemi. Méně formálním způsobem se bioinformatika také snaží pochopit organizační principy v sekvencích nukleových kyselin a proteinů.[1]
Odezva bioinformatiky na nové experimentální techniky přináší nový pohled na analýzu experimentálních dat, což dokazují pokroky v analýze informací z databází genových onemocnění a dalších technologií. Očekává se, že tento trend bude pokračovat s novými přístupy reagujícími na nové techniky, jako jsou technologie sekvenování nové generace. Například dostupnost velkého počtu jednotlivých lidských genomů podpoří vývoj výpočetních analýz vzácných variant, včetně statistického dolování jejich vztahů k životnímu stylu, lékových interakcí a dalších faktorů.[1]Biomedicínský výzkum bude také řízen naší schopností efektivně těžit velké množství stávajících a nepřetržitě generovaných biomedicínských dat. Zejména techniky těžby textu, jsou-li kombinovány s jinými molekulárními daty, mohou poskytnout informace o genových mutacích a interakcích a stanou se zásadními pro udržení náskoku před exponenciálním růstem dat generovaných v biomedicínském výzkumu. Další oblastí, která těží z pokroku v těžbě a integraci molekulární, klinické a lékové analýzy, je farmakogenomika. In silico studie vztahů mezi lidskými variacemi a jejich účinkem na nemoci budou klíčem k vývoji personalizované medicíny.[8]Stručně řečeno, databáze genových chorob již transformovaly hledání genů onemocnění a mají potenciál stát se rozhodující součástí dalších oblastí lékařského výzkumu.[1]
Viz také
- Informatika o biologické rozmanitosti
- Bioinformatické společnosti
- Biomedicína
- Výpočetní biologie
- Výpočetní biomodeling
- Výpočetní genomika
- Identifikace genu nemoci
- Evropský bioinformatický institut
- Funkční genomika
- Zdravotnická informatika
- Projekt lidského genomu
- Integrativní bioinformatika
- Mezinárodní společnost pro výpočetní biologii
- Skákací knihovna
- Seznam bioinformatických časopisů
- Seznam biologických databází
- Seznam open-source bioinformatického softwaru
- Patologie
- Fylogenetika
- Strukturální bioinformatika
Reference
- ^ A b C d E F G h i j k l m n A. Bauer-Mehren, „Analýza sítě s genovými chorobami odhaluje funkční moduly v Mendelian, Složité a environmentální nemoci „PLOS One, s. 1-3, 2011.
- ^ A b Botstein, D (2003). „Objevování genotypů, které jsou základem lidských fenotypů: minulé úspěchy Mendelovy choroby, budoucí přístupy ke komplexní chorobě“. Genetika přírody. 33 (1): 228–237. doi:10.1038 / ng1090. PMID 12610532.
- ^ Wren JD, Bateman A (2008). „Databáze, datové hrobky a prach ve větru“. Bioinformatika. 24 (19): 2127–8. doi:10.1093 / bioinformatika / btn464. PMID 18819940.
- ^ Americká asociace lékařské informatiky, „Strategický plán Americké asociace lékařské informatiky“, srpen 2011. [Online]. Dostupný: http://www.amia.org/inside/stratplan/. [Zpřístupněno 15. října 2014].
- ^ Oti, M (2007). "Modulární povaha genetických chorob". Klinická genetika. 71 (1): 1–11. doi:10.1111 / j.1399-0004.2006.00708.x. PMID 17204041.
- ^ Davis, A .; King, B. (2011). „Srovnávací databáze toxikogenomiky: aktualizace 2011“. Nucleic Acids Res. 39 (1): 1067–1072. doi:10.1093 / nar / gkq813. PMC 3013756. PMID 20864448.
- ^ Davis, A .; Wiegers, T. (2013). „Těžba textu efektivně zaznamenává a hodnotí literaturu pro zlepšení léčby chemickými geny a chorobami ve srovnávací databázi toxikogenomiky“. PLOS One. 8 (4): 1–29. Bibcode:2013PLoSO ... 858201D. doi:10.1371 / journal.pone.0058201. PMC 3629079. PMID 23613709.
- ^ A b C d Bauer-Mehren, A .; Rautscha, M. (2010). „DisGeNET: plugin Cytoscape k vizualizaci, integraci, vyhledávání a analýze sítí genových chorob“. Bioinformatika. 26 (22): 2924–2926. doi:10.1093 / bioinformatika / btq538. PMID 20861032.
- ^ Vogt, I. (2014). „Systematická analýza vlastností genů ovlivňujících fenotypy orgánových systémů při poruchách savců“. Bioinformatika. 30 (21): 3093–3100. doi:10.1093 / bioinformatika / btu487.
- ^ A b Buneman, P. (2008). "Upravené databáze". Bibliometrie. 978 (1): 152–162.
- ^ A b Murphy, C .; Davis, A. (2009). „Srovnávací databáze toxikogenomiky: znalostní databáze a nástroj pro objevování sítí chemicko-genových chorob“. Bioinformatika. 37 (1): 786–792. doi:10.1093 / nar / gkn580. PMC 2686584. PMID 18782832.
- ^ „Univerzální zdroj bílkovin (UniProt)“. Výzkum nukleových kyselin. 36 (1): 190–195. 2008. doi:10,1093 / nar / gkm895. PMC 1669721. PMID 18045787.
- ^ Uniprot, C. (2010). „Probíhající a budoucí vývoj na univerzálním zdroji bílkovin“. Výzkum nukleových kyselin. 39 (Problém s databází): D214 – D219. doi:10.1093 / nar / gkq1020. PMC 3013648. PMID 21051339.
- ^ K. Brown, „Online predikovaná databáze interakcí s lidmi“ Bioinformatika, sv. 21, č. 9, s. 2076-2082, 2005.
- ^ S. Hunter a P. Jones, „InterPro v roce 2011: nový vývoj v rodinné a doménové predikční databázi,“ Výzkum nukleových kyselin, sv. 10, č. 1, s. 12-22, 2011
- ^ C. Bult a J. Eppig, „Databáze genomu myší (MGD): biologie a modelové systémy myší,“ Výzkum nukleových kyselin, sv. 36, č. 1, s. 724-728, 2007
- ^ A b M. Dwinell, E. Worthey a S. M, „The Rat genome Database 2009: variation, ontologies and draways,“ Výzkum nukleových kyselin, sv. 37, č. 1, s. 744-749, 2009
- ^ Shimoyama M, De Pons J, Hayman GT a kol. (2015). „Databáze krysích genomů 2015: genomové, fenotypové a environmentální variace a choroby“. Výzkum nukleových kyselin. 43 (Problém s databází): D743–50. doi:10.1093 / nar / gku1026. PMC 4383884. PMID 25355511.
- ^ A b A. Homosh, „Online Mendelian Inheritance in Man (OMIM), znalostní databáze lidských genů a genetických poruch,“ Výzkum nukleových kyselin, sv. 33, č. 1, s. 514-517, 2005
- ^ Hubbard T a kol. (Leden 2002). „Projekt databáze genomu Ensembl“. Výzkum nukleových kyselin. 30 (1): 38–41. doi:10.1093 / nar / 30.1.38. PMC 99161. PMID 11752248. Citováno 11. listopadu 2014.
- ^ A b P. Flicek a M. Ridwan, „Ensembl 2012“ Výzkum nukleových kyselin, sv. 40, č. 1, s. 84-90, 2012
- ^ Becker, K .; Barnes, K. (2004). „Databáze genetické asociace“. Genetika přírody. 36 (5): 431–432. doi:10.1038 / ng0504-431. PMID 15118671.
- ^ https://geneticassociationdb.nih.gov/
- ^ Bravo, A; et al. (2014). „Extrakce vztahů mezi geny a chorobami z textu a rozsáhlé analýzy dat: důsledky pro translační výzkum“. BMC bioinformatika. 16 (1): 55. doi:10.1186 / s12859-015-0472-9. PMC 4466840. PMID 25886734.
- ^ A b Piñero; et al. (2015). „DisGeNET: platforma pro objevování pro dynamické zkoumání lidských nemocí a jejich genů“. Databáze. 2015: bav028. doi:10.1093 / databáze / bav028. PMC 4397996. PMID 25877637.
- ^ Oti, M (2006). „Predikce chorobných genů pomocí interakcí protein-protein“. J. Med. Genet. 43 (8): 691–698. doi:10.1136 / jmg.2006.041376. PMC 2564594. PMID 16611749.
